全身麻醉對大鼠學習記憶能力及腦額葉、海馬和杏仁核半胱氨酸蛋白酶-3基因表達的影響
周 園,陳 琦
(渭南市中心醫院麻醉科,陜西 渭南 714000)
隨著人口老齡化的進展,臨床接受麻醉手術患者數量逐年增加,有研究發現,全身麻醉藥物是患者出現術后認知功能障礙的因素之一[1]。相關研究證實嚙齒類動物吸入麻醉藥物后可引起大腦神經元凋亡,進而加重其術后認知功能下降。靜脈麻醉藥物種類較多,臨床上一般復合使用。丙泊酚是應用最為廣泛的全身麻醉藥,有研究認為其對患者認知能力會造成短暫影響[2]。氯胺酮是一種具有鎮痛作用的靜脈麻醉藥,亦有研究表明其可影響患者記憶能力、干擾記憶形成,從而導致認知功能障礙[3]。因此如何為患者提供更安全的麻醉藥物是臨床研究的重點所在。宋程光等[4]指出,半胱氨酸蛋白酶-3(Cysteinyl aspartate specific protease-3,Caspase-3)基因與細胞凋亡及修復有關。故本研究觀察全身麻醉對大鼠學習記憶能力及腦額葉、海馬和杏仁核Caspase-3基因表達的影響,以從基因水平評價麻醉藥物作用機制。
1 材料與方法
1.1 實驗材料 選用80只SD大鼠,均為雄性,平均體重(220±20)g,來自北京愛思益普生物科技有限責任公司。實驗前均進行1周適應性喂養,所有大鼠飼養條件:12/12 h光照(6:00~18:00為光照時間),溫度在22~25 ℃,濕度在30%~50%,大鼠在飼養時均可自由進食及飲水。試劑:2,6-二異丙基苯酚(生產批號180309),2-鄰氯苯基-2-甲氨基環己酮(生產批號180501)。
1.2 實驗方法
1.2.1 實驗分組:80只SD大鼠隨機分為四組,每組20只。分別為對照組、低劑量組、中劑量組、高劑量組。
1.2.2 全身麻醉:大鼠麻醉前肌注阿托品0.01~0.03 mg/kg,開放靜脈通道后,對照組注射生理鹽水1 ml/kg,不做任何處理。低劑量組、中劑量組、高劑量組分別腹腔注射1.0 mg/kg氯胺酮誘導復合2 mg/kg丙泊酚、1.5 mg/kg氯胺酮誘導復合2 mg/kg丙泊酚、2.0 mg/kg氯胺酮誘導復合2 mg/kg丙泊酚。待大鼠翻正反射消失后,常規消毒上腹部中線附近,于正中線做一1.5 cm切口,探查腹部15 min后,使用縫線縫合傷口,并使用紅霉素軟膏涂抹,術中均執行無菌操作,保持大鼠呼吸道通暢。麻醉處理后第1天各組分別斷頭取腦10只,分離前額葉皮層、海馬區、杏仁核,將其放入液氮中,轉入-80 ℃冰箱中保存。各組其余10只于術后進行Morris水迷宮測驗。
1.3 觀察指標
1.3.1 Morris水迷宮測試:大鼠麻醉前6 d進行Morris水迷宮[5]定位試驗訓練,2次/d,共進行6 d。于大鼠麻醉后第1、2、3天進行測試,大鼠逃避潛伏期:將大鼠面向池壁放入水池中,從其入水至找到隱蔽平臺的時間記為逃避潛伏期,若大鼠找不到隱蔽平臺則引導大鼠至平臺停留數秒并記潛伏期為60 s,大鼠每天進行4次測試,取當天平均潛伏期為成績。平臺有效期逗留時間為其進行翻轉空間探索試驗后到達對側象限之前的時間。
1.3.2 海馬區神經元凋亡檢測:采用雙氧水制作大鼠海馬區組織切片,使用PBS溶液每5 min清洗一次。吸收干凈PBS后,滴加足夠量的TUNEL檢測液,45 ℃避光孵育1 h。PBS溶液清洗后,加入轉化劑過氧化物酶37 ℃孵育30 min,PBS清洗后進行DAB染色,蘇木精復染,脫水封片。顯微鏡(×400)下隨機選擇5個視野觀察凋亡細胞,陽性細胞為染色質凝聚或核裂解細胞。
1.3.3 Western blot檢測Caspase-3蛋白濃度:取小鼠海馬組織,研磨打碎后加入細胞裂解液和蛋白酶抑制劑,冰上操作提取海馬總蛋白,以測定蛋白濃度。取100 μg海馬總蛋白,使用凝膠電泳成像系統分離蛋白。于5%濃縮膠中濃縮90 min,電壓60 V;12%分離膠中分離150 min,電壓80 V;轉膜120 min,電壓120 V。轉移后的濾膜使用離子水洗3次,0.5%脫脂奶粉封閉2 h,4 ℃過夜。過夜后加入1∶1000稀釋的兔抗人Caspase-3、山羊抗小鼠β-actin一抗,再加入1∶1000稀釋的羊抗兔IgG二抗室溫孵育1 h,洗膜5 min,進行3次,使用電化學發光條帶進行顯影,使用Quantity One軟件分析各蛋白條帶的灰度值。
1.3.4 Caspase-3基因mRNA水平檢測:使用Trizol法提取細胞DNA,合成cDNA,轉入-20 ℃保存;將一個樣本的cDNA稀釋后作為基因定量PCR,擴增條件為95 ℃下變性15 min,94 ℃下變性15 s,72 ℃退火45 s,40個循環后,于72 ℃下延伸10 min。PCR引物序列見表1。使用1.5%瓊脂凝膠電泳進行分析。

表1 PCR引物序列

2 結 果
2.1 各組大鼠Morris水迷宮結果比較 對照組處理后第1、2、3 天逃避潛伏期及平臺有效期逗留時間比較,差異均無統計學意義(均P>0.05);與對照組相比,低劑量組、中劑量組可見麻醉后逃避潛伏期、翻轉空間有效逗留區時間少量增加,但組間比較差異均無統計學意義(均P>0.05),高劑量組明顯增加(均P<0.05);低劑量組、中劑量組第2、3天逃避潛伏期、翻轉空間有效逗留區時間較術后第1天縮短(均P>0.05),高劑量組明顯縮短(均P<0.05)。見表2。
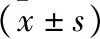
表2 各組大鼠Morris水迷宮結果比較
2.2 各組大鼠海馬區神經元凋亡情況 對照組、低劑量組、中劑量組、高劑量組大鼠神經元凋亡率分別為(5.23±0.46)%、(25.35±3.54)%、(27.43±4.14)%、(38.34±4.75)%,組間數據相比差異均有統計學意義(均P<0.05)。高劑量組細胞凋亡率較對照組、低劑量組、中劑量組顯著升高,組間數據相比差異均有統計學意義(均P<0.05)。見圖1。

圖1 TUNEL法檢測各組海馬區神經元凋亡情況(×400)(紅綠箭頭為凋亡細胞)
2.3 各組大鼠腦額葉、海馬區、杏仁核Caspase-3基因表達水平 Western blot結果顯示,高劑量組Caspase-3蛋白表達量較對照組、低劑量組、中劑量組明顯升高(均P<0.05)。與對照組相比,低劑量組、中劑量組額葉皮層、海馬、杏仁核Caspase-3基因mRNA水平少量增加(均P>0.05);高劑量組Caspase-3基因mRNA水平明顯升高,差異有統計學意義(均P<0.05)。見表3,圖2、3。

圖2 RT-PCR產物瓊脂糖凝膠電泳圖

表3 各組大鼠腦額葉、海馬區、杏仁核Caspase-3基因mRNA水平(Caspase-3/β-actin)

圖3 Western blot檢測各組Caspase-3蛋白表達水平
3 討 論
有研究發現,全麻藥物代謝后仍然會對大腦產生功能及形態上的影響,以及持續的學習能力損害,因此全麻藥物對腦部功能的影響是患者出現術后認知功能障礙的重要原因之一[6]。腦額葉損傷可降低機體對氣味、行為的敏感性,且孫縵利等[7]認為,阿爾茨海默癥患者前額皮層厚度及神經元體積較正常指標更小。海馬區是與學習、行為、記憶相關的重要腦區,也是應激損傷的靶器官之一。杏仁核是自主神經內分泌功能的執行部位,與記憶恐懼、焦慮有一定關系。同時,Caspase-3基因是參與細胞凋亡的主要因子。本研究取大鼠細胞腦額葉、海馬區、杏仁核神經細胞Caspase-3基因水平進行觀察,為全身麻醉與術后不良反應提供了新的診療思路。
有學者發現,丙泊酚等麻醉藥物可增加神經細胞內鈣離子震蕩,導致軸突生長速度減慢,這可能是因為這類藥物可通過妨礙海馬神經元內突觸的形成促進神經細胞凋亡[8]。尚瑞媛等[9]對大鼠給予氯胺酮進行試驗,結果顯示目標大鼠出現神經細胞凋亡,提示氯胺酮可能會產生一定神經毒性,從而改變神經系統生理功能。Morris水迷宮可全面、有效反應生物的空間認知能力及記憶能力,可廣泛應用于學習記憶、老年癡呆等研究中。本研究對大鼠進行Morris水迷宮試驗,結果顯示與對照組相比,低劑量組、中劑量組可見麻醉后逃避潛伏期、翻轉空間有效逗留區時間少量增加,高劑量組明顯增加。提示麻醉藥物對大鼠學習記憶能力會產生一定影響。同時,研究結果顯示,低劑量、中劑量、高劑量組大鼠術后2 d可恢復正常,提示合理的麻醉藥物劑量是安全有效的,與喬霖等[10]研究結果一致。
細胞凋亡是指細胞出現程序性死亡,是指細胞在外界刺激下的生化過程,也是引起機體生長發育、生理性死亡、病理性死亡的重要機制[11]。且Caspase-3大量激活可導致DNA損傷修復酶降解,同時激活核酸內切酶,在細胞凋亡中發揮關鍵作用[12]。國內外研究發現,抑制Caspase-3基因可阻斷神經元凋亡,而Caspase-3基因過度表達可促進細胞凋亡[13-14]。黃雄峰等[15]研究發現,腦部損傷患者的腦額葉、海馬區Caspase-3基因表達增加,提示Caspase-3基因是腦組織損傷的原因之一。本研究結果發現,全身麻醉可在一定程度上影響大鼠Caspase-3基因mRNA水平,從而降低大鼠術后認知能力。且高劑量組Caspase-3蛋白表達量較對照組、低劑量組、中劑量組明顯下降,提示丙泊酚、氯胺酮等全身麻醉藥物可有效激活Caspase-3表達,促進神經元凋亡。應迪琪等[16]認為,丙泊酚可造成機體海馬區生成活性氧類物質,增加活性氧介導的氧化應激反應,進而促進神經細胞死亡。由此可見,大鼠腦額葉、海馬、杏仁核基因中的Caspase-3基因mRNA水平可促使腦細胞出現凋亡,而高劑量的全身麻醉藥物可促進這一進程,導致腦額葉、海馬、杏仁核中相關基因表達水平增高,從而實現認知功能下降。本研究結果得出不同劑量的麻醉藥物對實驗結果有不同影響,但需要更多實驗來證實。臨床上對全身麻醉后對基因的影響研究還不夠全面,許多研究均使用推理得出結論,且樣本數量有限。本研究作為動物實驗,結果不能完全推廣于人類,但今后的深入研究可為我們進一步明確神經細胞凋亡機制,有助于臨床選擇合理麻醉藥物。
綜上所述,高濃度的全身麻醉對腦額葉、海馬、杏仁核Caspase-3基因表達有一定影響,可影響細胞凋亡水平,但影響時間較短,本研究可為今后選擇麻醉藥物劑量、降低相關不良反應做出指導。

