13例腎上腺畸胎瘤臨床診療分析并文獻復習
楊過 孟慶軍 田雨冬 崔林剛 徐鵬超 楊濤
鄭州大學第一附屬醫院泌尿外科 鄭州 450052
畸胎瘤是一種來源于全能細胞的生殖細胞腫瘤,常見于睪丸、卵巢,較少發生于縱隔、骶尾部、腹膜后等部位,而腎上腺畸胎瘤(adrenal teratoma,AT)更為罕見[1-2]。國內外文獻對于該病的報道較少,多為個案。本研究通過回顧性分析2012-10—2019-03間鄭州大學第一附屬醫院收治的13例AT患者的臨床及隨訪資料,并進行相關文獻復習,探討AT的臨床特征及外科診療方法,旨在提高對AT的認識。
1 材料與方法
1.1 研究對象選取2012-10—2019-03間就診于鄭州大學第一附屬醫院術后病理診斷為AT的患者為研究對象。病理診斷皆由我院病理科兩位高級職稱醫生進行獨立診斷,排除同時罹患腎上腺外的畸胎瘤者。共13例。
1.2 分析方法(1)收集并詳細記錄患者病歷資料(包括性別、年齡、現病史、既往史、體格檢查等),術前實驗室檢查及影像學檢查結果等。(2)記錄手術方式、手術時間、腫物的特征,以及術中生命體征、出血量和術后恢復情況。(3)記錄大體病理形態及組織病理檢查結果。(4)通過電話或門診復查隨訪。隨訪內容包括術后是否行放、化療和相關內科治療,癥狀緩解與否,以及進行內分泌、腫瘤標記物和腹部CT等檢查。
1.3 一般資料及術前檢查13例患者中位年齡31歲,其中男1例(7.7%)、女12例(92.3%);均為單側發病,其中左側8例、右側5例。3例因腹部不適或脹痛就診,10例為體檢發現。均無高血壓、糖尿病病史。所有患者入院后均完善血常規、肝腎功能、電解質、腎上腺相關激素檢查,及腫瘤標記物等檢查。其中1例上午8時促腎上腺皮質激素(adrenocorticotropic hormone,ACTH)為78.4 pg/dl(正常7.2~63.3 pg/dl),1例下午4時皮質醇為511 g/L(正常64~327(g/L),其余患者未見異常。術前腹部CT顯示腫瘤最小為25 mm×20 mm×15 mm,最大為152 mm×103 mm×99.7 mm。2例(15.4%)考慮腎上腺髓樣脂肪瘤,11例(84.6%)考慮AT。見圖1。
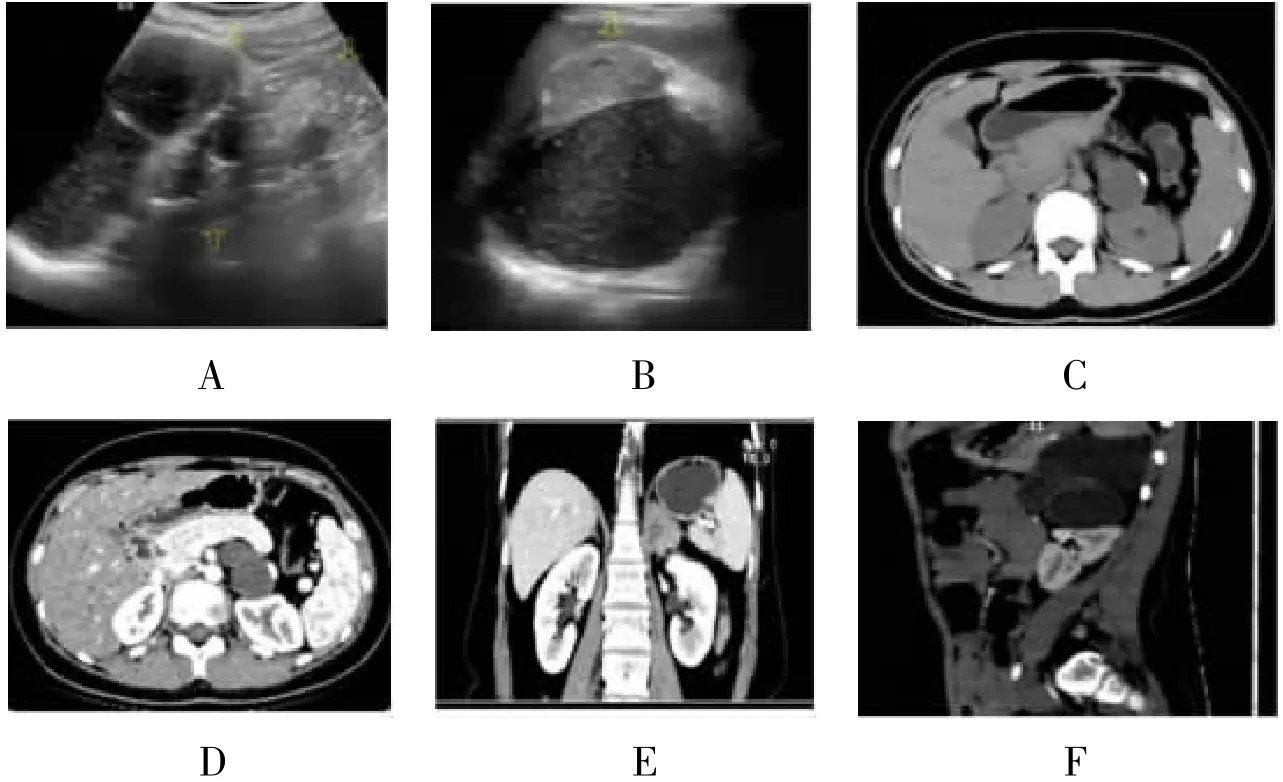
圖1 AT的彩超、平掃及增強CT影像圖
1.4 手術方法10例行腹腔鏡腎上腺切除術(9例經腹腔入路,1例經腹膜后入路),3例行開腹腎上腺切除術。術中見腫瘤與周圍臟器粘連,小心分離腫物,可見腫物形狀規則,呈卵圓形,質地中等,未見腫物破裂出血及周圍浸潤。術中均無明顯血壓波動,出血量少,未予輸血。完整切除腫物后術區均留置引流管。
1.5 統計學方法數據采用SPSS 22.0統計學軟件進行處理。計量資料以(±s)表示,行t檢驗;計數資料用n(%)表示,采用χ2檢驗。P<0.05表示差異有統計學意義。
2 結果
2.1 手術時間等指標腹腔鏡組的手術時間、拔除引流管時間、腸胃功能恢復時間及術后住院日均短于開放手術組,術中出血量少于開放手術組,差異有統計學意義(P<0.05)。見表1。所有患者切口均愈合良好,無圍手術期并發癥。
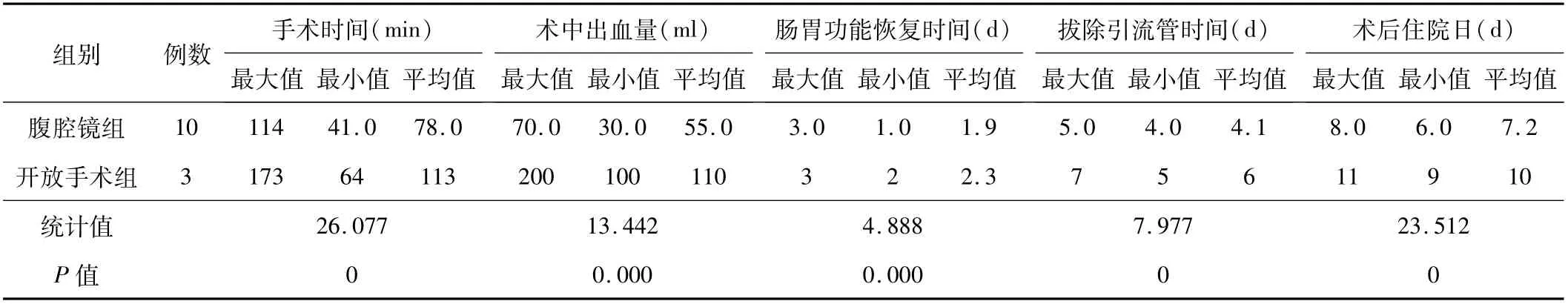
表1 2組患者手術時間等指標比較
2.2 術后病理結果大體病理:標本呈卵圓狀,切開后呈囊性,可見淡黃色或褐色黏稠樣液體流出,組織間隙可見油脂樣物及少量毛發。組織病理:腎上腺成熟性畸胎瘤,其中1例行免疫組化后明確其為腎上腺成熟性畸胎瘤。見圖2。免疫組化結果:AE1/AE3[CK(上皮+)],CD56(56C04)×(-),SYN(+),NSE(-)。

圖2 AT大體病理及光鏡下病理
2.3 臨床特征及術后隨訪13例患者均獲5~81個月隨訪。其間均未行放、化療及相關內科治療。其中3例因腹部不適就診者癥狀消失,2例ACTH和皮質醇異常者恢復正常。血甲胎蛋白(AFP)、人絨毛膜促性腺激素(HCG)和癌胚抗原(CEA)未見異常。腹部CT均未見復發或癌變。見表2。
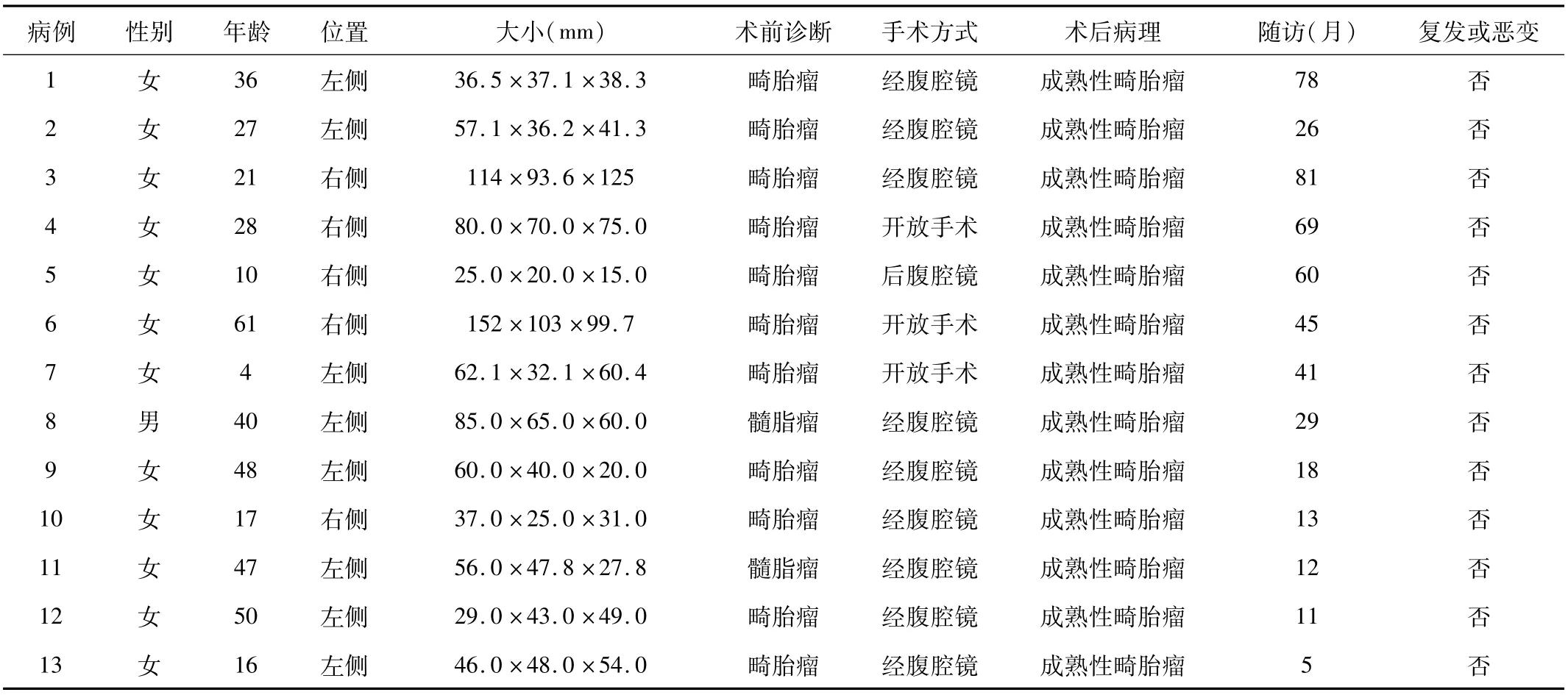
表2 2組患者的臨床資料與隨訪結果
3 討論
畸胎瘤是一種起源于全能細胞的生殖細胞腫瘤,并具備向不同體細胞多向分化的潛能。常發生于人體的生殖腺內,較少發生于骶尾部、腹膜后等部位,AT更為罕見[1-2]。按分化程度畸胎瘤可分為成熟性畸胎瘤和未成熟性畸胎瘤,成熟性畸胎瘤約占95%,又稱為皮樣囊腫。囊壁由鱗狀上皮、骨組織、毛發及牙齒等構成,囊內可見淡黃色黏稠樣液體[3-4]。AT以女性多見,往往單側發病,至今未見國內外文獻報道雙側發病者[5]。其臨床癥狀不典型,多由體檢發現,較少因腫瘤較大壓迫周圍臟器或破裂出血引起腰痛、腹痛等癥狀[6-7]。本組男性1例,女性12例,全部為單側成熟性畸胎瘤,僅有3例出現腹部不適等癥狀,與上述文獻相符。
AT無典型臨床特征,主要靠超聲、CT及MRI檢查診斷,并為術前評估及術式選擇提供依據。超聲多顯示為鈣化、骨化高回聲,以及脂肪、囊性低回聲影。CT多見低密度的囊性和脂肪性區域以及高密度鈣化,可明確腫瘤的生長部位及與周圍臟器的關系,便于手術方式的確定[8]。MRI顯示畸胎瘤周圍血管及浸潤方面有明顯優勢,多表現為T1和T2加權圖像均顯示混合信號,其中脂肪含量高[9]。
AT通常表現為無內分泌功能的“偶發瘤”,可行內分泌檢查與腎上腺來源的其他腫瘤進行鑒別,如皮質醇增多癥、原發性醛固酮增多癥以及腎上腺嗜鉻細胞瘤。然而AT易與含脂肪成分的其他腎上腺腫瘤相混淆,因此術前仍需影像學檢查與以下幾種疾病進行鑒別:(1)髓樣脂肪瘤:是一種少見的腎上腺腫瘤,多為良性,大部分患者無自覺癥狀,腎上腺內分泌相關檢查均為陰性,CT通常表現為圓形或類圓形的以脂肪密度為主的低密度影,CT值為-150 HU~-40 HU,可呈條索狀以及不規則云絮狀等,增強掃描通常無強化或輕微強化。如腫瘤合并出血和鈣化,則兩者鑒別困難,應結合超聲、MRI檢查信號特點綜合分析。(2)腎上腺囊腫:大多無臨床癥狀,體檢發現居多。腎上腺內分泌檢查多為陰性。CT常提示囊腫壁薄而均勻,增強掃描囊內未見強化。(3)脂肪肉瘤:起病隱匿,發現時腫瘤往往已經很大。CT表現為脂肪密度腫塊內包含軟組織成分,或軟組織成分內包含脂肪密度腫塊。(4)腹膜后血管平滑肌脂肪瘤:一般體積較大,CT顯示邊緣不清晰,其內密度不均勻,含有大量的脂肪和軟組織密度影。增強后輕度不均勻強化。(5)神經鞘瘤:大都包膜完整,界線清楚,腫瘤增大時可有壞死、囊性變等。CT顯示內部鈣化灶往往為散在的斑點樣,而畸胎瘤的鈣化灶常常為碎片狀或是凝固狀。
本組患者中,有11例術前CT診斷為AT,2例術前CT診斷與術后病理診斷不相符。可見術前CT并不能完全確診。有學者認為,CT引導下穿刺活檢可用來術前診斷,因有穿刺失敗,腫瘤破裂等風險,故有一定局限性。如術前評估能完整切除腫瘤,不建議穿刺活檢。但對于術前或其他相關治療前需要明確診斷的患者,應選擇穿刺活檢[10-11]。術后病理檢查是AT診斷的“金標準”。成熟性畸胎瘤肉眼下多呈囊性,組織間隙可見油脂樣物,鏡下可見來自三個胚層的成熟組織,如皮膚、皮膚附屬器、骨及軟骨等。未成熟畸胎瘤肉眼下多呈實性腫塊。鏡下可見原始神經上皮管等未成熟成分。成熟性畸胎瘤完全由來自三個胚層的成熟組織構成,必須對腫瘤進行充分取材和徹底檢查,因為含有未成熟成分會完全改變腫瘤的預后。對普通病理鑒別診斷困難者,可行免疫組化進行鑒別診斷。有學者對3例腎上腺畸胎瘤免疫表型分析,其中2例成熟性畸胎瘤WT-l、Syn、CK、CgA、MyoDl、desmin、CD34血管呈陽性,CD56、S-100、CD99均呈陰性。成熟性畸胎瘤Ki67增殖指數5%,未成熟性畸胎瘤Ki67增殖指數70%[12]。
AT大多數為成熟性畸胎瘤,雖為良性腫瘤,但仍有惡變的可能,而且隨著腫瘤的增大可出現周圍臟器壓迫癥狀,甚至有破裂出血和感染的可能。因此一經診斷,應盡快手術治療[13]。腹腔鏡手術因具有效果好、切口小、術后恢復快,已成為治療小于6 cm腎上腺腫瘤的“金標準”[14]。腹腔鏡手術有經腹腔和經腹膜后兩種入路,根據術者的經驗和個人習慣,無明顯優劣之分[15]。對大于6 cm的AT,開放手術是切除腫瘤的主要方法。但有學者指出,對腎上腺良性腫瘤,只要術前影像學上或術中無局部侵犯,腹腔鏡手術是安全、可行的[5]。長期以來,針對大于6 cm的腎上腺腫瘤,是采用腹腔鏡手術還是開放手術,一直存在爭議,主要是出于腫瘤控制和手術難度的考慮。近年來,隨著醫療技術水平提高,腹腔鏡治療大于6 cm的腎上腺腫瘤已經成為可能[16]。本組有2例大于6 cm的AT患者采用腹腔鏡手術,均獲良好預后。結合相關文獻和我們的體會,AT治療的關鍵是完整切除腫瘤,術者可結合患者的具體病情及自身經驗,選擇合適的手術方式[15]。圍術期需特別注意以下幾點:(1)由于腫瘤與腹腔臟器、血管關系密切,術前應充分做好胃腸道準備及備血。(2)術中應在不損傷周圍臟器的情況下完整切除腫瘤[17]。由于AT往往與腎動脈、腎靜脈、肝臟,胰腺及下腔靜脈等粘連較重,術中應小心鈍性分離。若畸胎瘤表面有明顯凹陷,應仔細查看周圍有無血管包繞等[18]。若術中發現腫瘤血管豐富或周圍浸潤,應當考慮惡變的可能,必要時結合術中快速病理檢查,適當擴大手術范圍[18]。(3)術后及時肌注腎上腺皮質激素,以免出現腎上腺皮質功能不全。本組13例患者術后全部補充腎上腺皮質激素,均未見圍手術期及遠期并發癥。(4)腎上腺成熟性畸胎瘤多為囊性畸胎瘤,術中因粘連易導致囊壁破裂,且術中無法明確其生物學行為。因此應小心分離囊壁周圍組織,如有囊壁破裂及內容物流出,建議及時用蒸餾水沖洗術區,以防止腫瘤殘留或擴散[4,19]。
有報道稱約1.46%成熟性畸胎瘤會發生惡性轉歸,而腎上腺成熟性囊性畸胎瘤分化程度高,且對于放化療不敏感,因此術后不必行放化療,只需定期隨訪[20]。本組13例均行手術完整切除腫瘤,術后未行放、化療及相關內科治療,長期隨訪未見腫瘤復發或癌變。對未成熟畸胎瘤,其復發及轉移率較高,術后仍然需放、化療并且終身隨訪[21]。某些未成熟畸胎瘤常伴有AFP、HCG和CEA升高,這些對于術前診斷及預后判斷具有重要意義[22]。對腎上腺未成熟性畸胎瘤,應在切除的基礎上輔以化療,目前尚無標準的化療方案。Leandros等[20]報道了1例采用BEP方案(博來霉素、依托泊苷、順鉑)化療的案例,術后隨訪13個月未見復發及轉移。Nishioka等[12]認為對于成熟性和未成熟性畸胎瘤的預后和隨訪都應該詳細檢查和治療,且仍需進一步探討其具體的放療、化療方案。
綜上所述,AT是一種罕見的生殖細胞來源腫瘤,發病年齡跨度大,臨床表現缺乏特異性,術前診斷主要依靠影像學檢查,病理檢查是確診的根本依據。完整切除腫瘤是AT治療的關鍵。成熟性畸胎瘤切除術后預后良好,因其具有惡性轉歸風險,術后定期隨訪是必要的。未成熟畸胎瘤術后易復發,需輔助放、化療,且終身隨訪。術后定期復查有利于監測腫瘤復發情況,基于以往研究,AFP水平與畸胎瘤的復發情況具有相關性,其可作為觀察療效的預測指標[11]。然而由于本組案例數量有限,目前的結果并不全面,今后還需要更進一步的研究和長期跟蹤隨訪。

