胃腸道間質瘤術后復發因素分析及藥物治療
鞠 雷
0 引言
胃腸道間質瘤(Gastrointestinal stromal tumor,GIST)是消化道最常見的間質性腫瘤[1-2],源于間質細胞(Cajal細胞)表達的酪氨酸激酶受體c-KIT等的突變所致該細胞失控生長形成腫瘤[3]。臨床表現多無特異性,多以腹痛、嘔血、黑便、腹部腫塊等為表現,診斷上多以胃腸鏡及盆腹腔CT為主要手段,確診需要病理組織學和免疫組化檢查。治療上如無手術禁忌,原則上應以手術治療為首選,術后應用伊馬替尼治療。然而許多患者治療后又出現了新發病灶或局部進展復發,本研究旨在分析復發因素,以及出現上述復發情況時,如何選擇和應用藥物,從而更好地指導臨床治療。
1 資料與方法
1.1 一般資料 選取2012年12月至2016年9月我院收治的52例胃腸道間質瘤患者作為研究對象。納入標準:年齡23~65歲;有明確的手術指征;美國麻醉師協會(ASA)風險評估1~2級者;無嚴重凝血功能障礙及認知功能障礙者。排除標準:腫瘤有破潰,合并出血、穿孔,合并有冠心病及肺部感染者;合并精神疾病者;有吸毒經歷、藥物成癮和耐藥史者;凝血功能異常者。
1.2 方法
1.2.1 完善術前準備 除外手術禁忌證后,采用腹腔鏡或開腹手術治療,手術方式包括:胃楔形切除,胃大部切除,腸部分切除吻合術。無并發癥出現,術后指導患者口服伊馬替尼,400 mg/d,術后每3個月復查盆腹腔CT,使用choi標準[4]進行療效評估。每個月復查1次血常規和肝腎功能。
1.2.2 所有患者均進行定期隨訪 內容包括患者腫瘤復發情況和患者生存情況。隨訪時間為36個月。比較各組患者復發情況,分析腫瘤復發的危險因素。復發患者按隨機數表法分為伊馬替尼組和舒尼替尼組,分別為10例和11例。比較兩組患者生存時間和不良反應情況,生存時間規定為手術當日起至死亡時間或最后隨訪時間。采用NCI-CTCAE4.3標準評價不良反應。

2 結果
2.1 患者腫瘤復發情況分析 對患者術后復發情況進行分析,結果表明,復發情況與腫瘤的大小、手術的根治程度、核分裂像及危險度分級相關(P<0.05)。見表1。
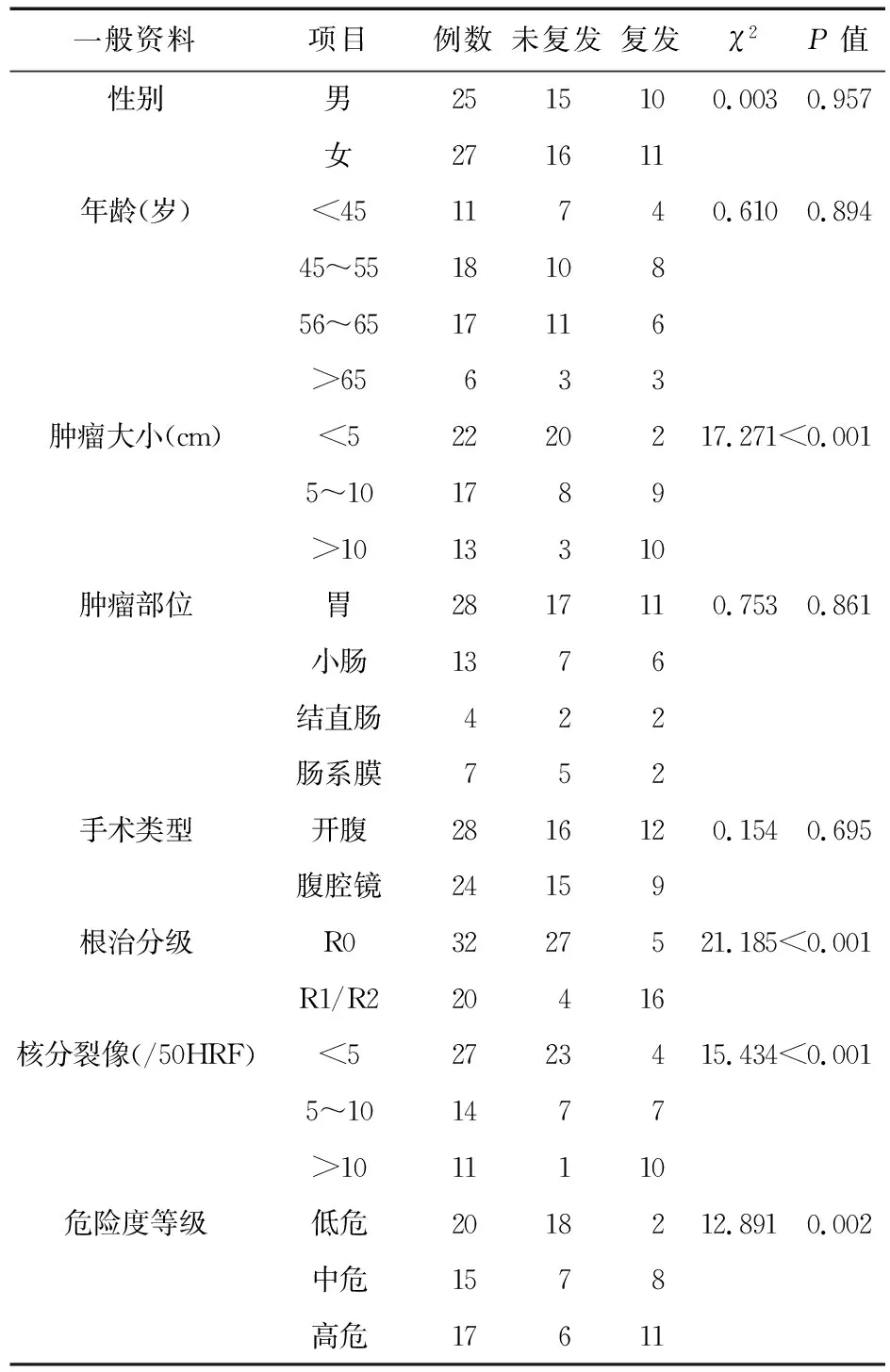
表1 患者腫瘤復發情況分析
2.2 腫瘤復發的危險因素分析 根據復發患者的各項指標和復發情況進行Logistic回歸分析,將患者是否出現復發作為因變量,有統計學意義的因素作自變量。結果顯示,腫瘤的大小、根治程度、核分裂像以及危險度等級均是胃腸間質瘤術后復發的獨立危險因素。見表2。
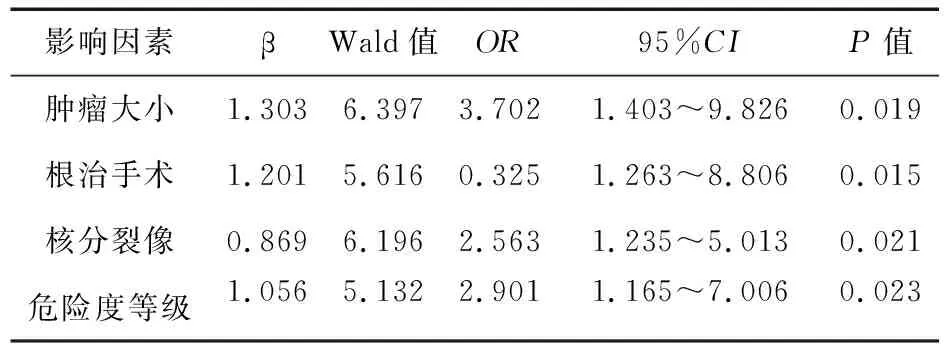
表2 術后復發患者的Logistic回歸分析
2.3 兩組腫瘤復發患者一般資料比較 兩組患者一般資料比較,差異無統計學意義(P>0.05),具有可比性。見表3。
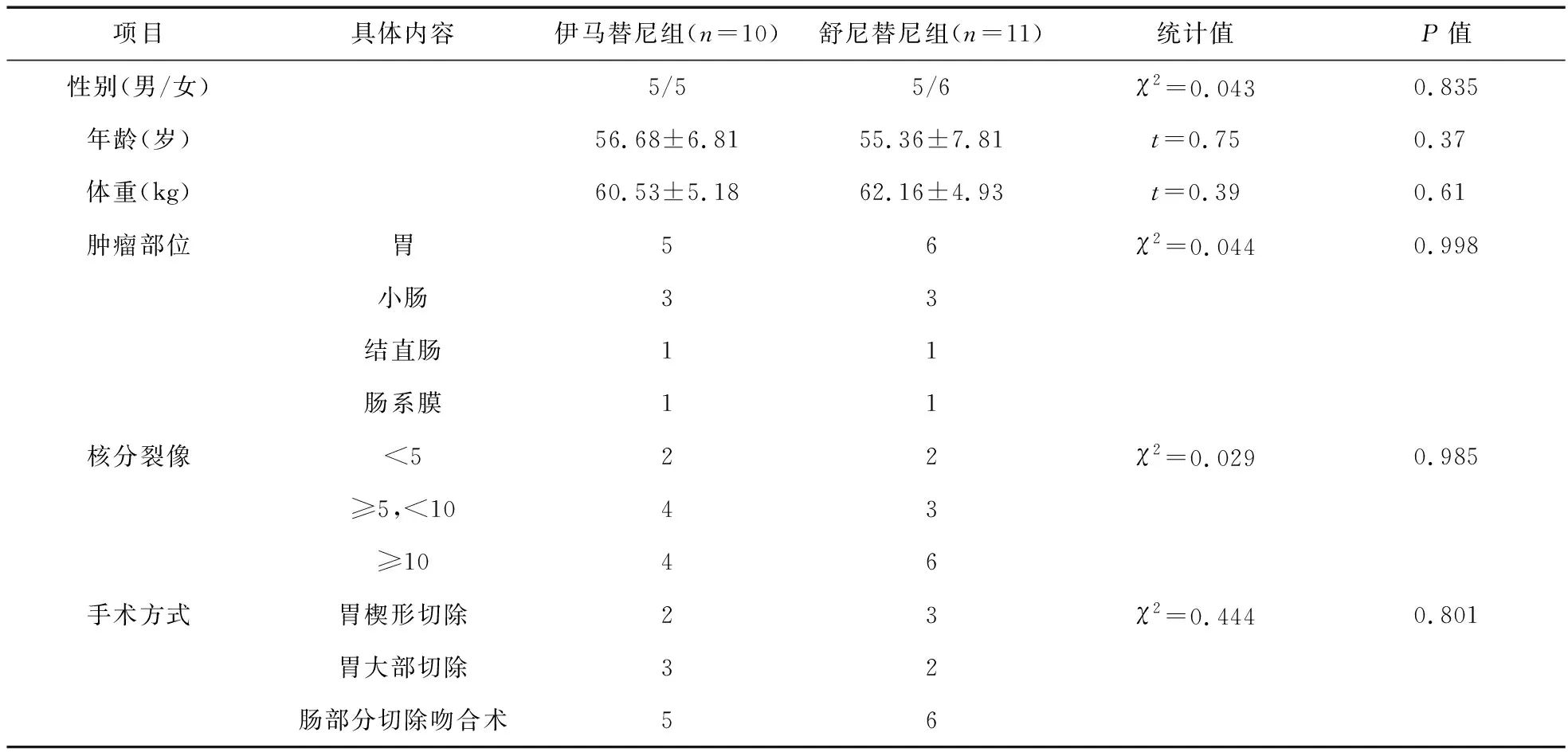
表3 兩組一般資料比較
2.4 兩組腫瘤復發患者總生存時間比較 計算兩組患者總生存時間(Overall survival,OS),舒尼替尼組總生存時間高于伊馬替尼組,差異有統計學意義(P<0.01)。見圖1。
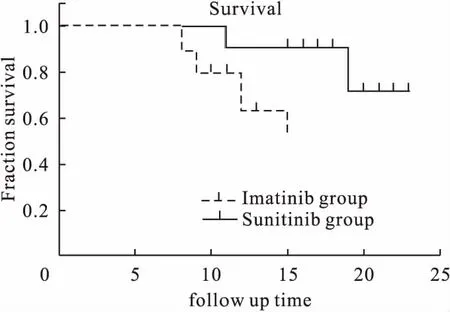
圖1 兩組患者總生存時間比較
2.5 兩組腫瘤復發患者不良反應比較 兩組均有惡心嘔吐、腹瀉、血常規異常(白細胞下降,血小板下降)及肝功能異常(丙氨酸基轉移酶增高)等不良反應的發生,換用舒尼替尼組不良反應總發生率(36.4%)低于伊馬替尼增量組(80.0%) (P<0.01)。見表4。

表4 兩組患者不良反應發生情況比較[例(%)]
3 討論
胃腸道間質瘤是胃腸道最常見的間葉源性腫瘤,其發生發展是一個復雜過程,與基因亞型、蛋白質、酶類以及生物分子等密不可分[5]。60%的胃腸間質瘤發生于胃部,以胃體及胃底處多見,其次是小腸[6],另有一小部分來源于腸系膜、腹膜后、胰腺等部位[7]。本研究顯示,伊馬替尼組中胃間質瘤所占比例為50%,舒尼替尼組中胃間質瘤所占比例為54%。當腫瘤直徑較小時,臨床多無癥狀,但隨著腫瘤的生長,可以出現消化道出血、腹痛、腹部包塊、消化道梗阻、甚至穿孔等[8]。其診斷主要依靠超聲內鏡、腹部增強CT、MRI等手段。Sekine等[9]研究顯示,通過超聲內鏡引導下的細針穿刺抽吸,可以將GIST診斷的敏感度和陽性預測值提高至82.5%和100%,甚至對于直徑小于2 cm的GIST,其敏感度也可達到81.3%。治療上,由于GIST對放化療都不敏感,所以手術切除仍為最有效和最主要的治療。近年來,隨著腹腔鏡技術的發展,國內外多中心的研究已證實了腹腔鏡下胃腸間質瘤的切除手術是安全、有效的[10-11]。目前,分子靶向藥物的研發大大提高了患者的生存率和生活質量,其一線藥物鹽酸伊馬替尼作為GIST首選藥物,廣泛應用于臨床中。國內應用伊馬替尼晚于歐美國家。有研究顯示,歐美國家患者的5年總體生存率高于國內患者[12],因此,伊馬替尼具有一定的有效性[13]。此外,伊馬替尼的藥物不良反應多較輕微,最常見的為眶周水腫,其次為白細胞或血小板減少、胃腸道反應等[14-15]。
影響胃腸道間質瘤的預后因素很多,目前,腫瘤的起始部位、直徑以及核分裂像是最為公認的預測其復發和轉移風險的指標。本研究并未得出腫瘤的各起始部位對于患者預后差異具有統計學意義,考慮可能與入組的病例數較少有關。對于早期發現的較小的腫瘤,行手術治療后預后一般較好。當腫瘤較大時,腫瘤侵及深度較廣,即使手術切除,術后預后也往往較差。本研究結果表明,腫瘤直徑<5 cm的22例患者中,僅有2例患者復發;在腫瘤直徑5~10 cm的17例患者中,有9例患者復發;在腫瘤直徑>10 cm的13例患者中,有10例患者出現復發。因此,腫瘤的大小可以成為胃腸道間質瘤的獨立危險因素。腫瘤越大,惡性程度越高,預后越差。核分裂數也決定著腫瘤細胞的增殖活性以及患者的預后程度。核分裂數越多,腫瘤細胞活性越高,增殖越快,惡性程度越高,預后越差。本研究結果表明,在核分裂數小于5的27例患者中,僅有4例復發;在核分裂數5~10的14例患者中,有7例患者復發;在核分裂數大約10的11例患者中,有10例患者復發。此外,腫瘤是否壞死、淋巴細胞與中性粒細胞的比值、C反應與白蛋白比值、CD34和CD117的表達等也是影響預后及復發的因素[16-18]。
通過精準評估復發風險,可以更好地指導臨床治療,從而使患者獲得更大受益[19]。本研究探討兩種治療方式的優劣,對比兩組的治療效果以及不良反應,結果顯示,舒尼替尼組疾病完全緩解的例數和疾病部分緩解的例數均多于伊馬替尼組,疾病未緩解例數少于伊馬替尼組。舒尼替尼組惡心嘔吐、腹瀉、血常規異常(白細胞下降,血小板下降)及肝功能異常(丙氨酸氨基酶增高)等不良反應的總發生率均低于伊馬替尼組。此外,舒尼替尼組的總生存時間長于伊馬替尼組。
綜上所述,本研究表明,當伊馬替尼常規劑量治療無效時,不應再增加劑量,而應當及時更換二線藥物舒尼替尼繼續治療。但因為樣本數量較小,此結果還需要進一步的大樣本研究分析。

