溫度和水分對干熱河谷耕地和草地土壤微生物的影響
彭思利,武仁杰,張 鑫,葛之葳,楊 楠
(南京林業大學南方現代林業協同創新中心 / 南京林業大學生物與環境學院, 江蘇 南京 210037)
干熱河谷是我國西南地區一種特有的生態現象,主要分布于金沙江、怒江、元江和南盤江等地[1]。元謀干熱河谷地處滇中高原北部,云貴高原北緣金沙江一級支流龍川江下游的河谷地帶,是西南干熱河谷的典型代表區。該區屬低緯度高原季風氣候,年日照率約為60%,年降水量615.1 mm,90%以上集中在6 月 - 10 月的雨季,年蒸發量大,為降水量的5~6 倍[2],自然植被以灌草叢植被為主[1]。特殊的氣候、地理和植被類型導致該區生態環境十分脆弱。不過,由于光熱資源豐富,河谷地區適宜種植多種糧食作物和經濟作物,是全國少有的冬季蔬菜露天種植區,為區域經濟發展提供了重要支撐[3]。
在全球氣候變暖的背景下,干熱河谷區近幾十年來與該變化有相背離的趨勢:年平均氣溫、最冷月均溫、年日照時數及年均蒸發量都下降,年均降水量整體上具有增長之勢[2-4]。從理論上講,該區轉涼變濕的氣候變化趨勢,能緩解該區突出的水熱矛盾,一定程度上改善土壤環境。土壤微生物作為陸地生態系統重要功能組分,土壤環境變化將使土壤微生物及其生態功能發生變化,進而導致生態系統地球化學循環發生根本改變[5-6]。已有研究表明,水熱條件是限制該區植物生長和分布的主要因素[7-8],而溫度和水分變化對土壤微生物特征的研究相對較少。因此,本研究以元謀干熱河谷兩種典型土地利用方式下的土壤(耕地和草地土壤)為研究對象,在不同的溫度(15、25 和35 ℃)和水分(80%、60%和40%最大田間持水量)條件下進行純培養試驗,測定了不同溫度和水分處理7、14 和28 d 后土壤微生物呼吸速率、累積呼吸量和微生物代謝熵,以及培養28 d 的土壤細菌群落結構,為預測全球氣候變化背景下該區土壤微生物群落結構和生態功能變化提供理論基礎。
1 材料與方法
1.1 研究區概況和樣品采集
本研究中純培養所用土壤采自中國科學院元謀干熱河谷溝蝕崩塌觀測研究站附近,選擇干熱河谷區兩種典型土地利用方式下的土壤,即草地和耕地土壤。草地以耐干熱的多年生草本植物為主,優勢種為扭黃茅(Heteropogon contortus)和孔穎草(Bothriochloa pertusa),零星分布小灌木車桑子(Dodonaea viscosa);耕地種植模式為玉米(Zea mays)和蔬菜套種,蔬菜為菜豆(Phaseolus vulgaris)或番茄(Lycopersicon esculentum)。土壤樣品采集于2013 年4 月,取樣深度為0 - 20 cm。將野外采集的新鮮土壤過2 mm 篩后置于室內風干后,冷藏備用。供試土壤基本理化性質如表1所列。
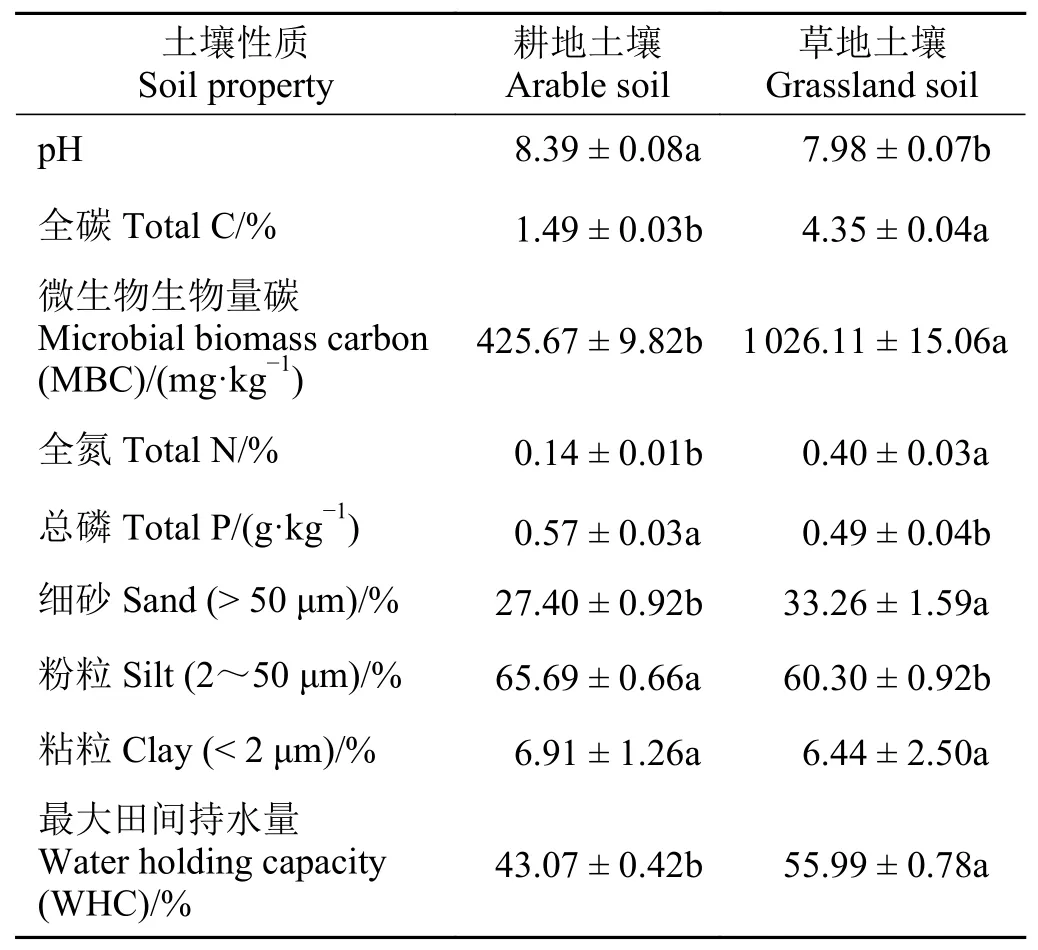
表1 供試土壤基本理化性質Table 1 Properties of experimental soils
1.2 培養試驗
稱取約150 g 土壤放置于350 mL 的組培玻璃瓶中,分別在3 個溫度條件(15、25 和35 ℃)和3 個水分條件[80% 、60%和40% 的田間最大持水量(WHC)]下進行避光培養。溫度采用RGX 型人工氣候培養箱進行控制,在培養過程中通過稱重法適時補水以保證土壤水分穩定。試驗設置溫度、水分和土壤類型3 個因素,共18 個處理,每個處理9 個重復,共162 瓶。
1.3 樣品采集與測定
分別在培養1、2、3、4、5、6、7、9、11、14、16、18、21、24 和28 d 時測定土壤微生物呼吸速率,土壤微生物呼吸速率乘以時間即可得到土壤微生物累積呼吸量,計算培養7、14 和28 d 時的土壤微生物累積呼吸量;并在培養7、14和28 d 時每種處理取3 個平行破壞性取樣(3 個取樣時間 × 3 個平行,共設置9 個重復)測定土壤微生物生物量碳(microbial biomass carbon, MBC),將土壤微生物呼吸速率與MBC作比值得到微生物代謝熵(qCO2);最后,在各處理進行后的28 d,將同種土壤同種溫度和水分處理的3 個平行土樣混勻后取樣測定土壤細菌群落結構。
土壤微生物呼吸速率采用NaOH 吸收法測定:將裝有10 mL 0.2 mol·L-1NaOH 溶液的杯子放入組培瓶中,用以吸收土壤呼吸釋放出的CO2,密封培養2 h 后,通過HCl 反滴定NaOH 的方法計算出CO2的釋放量,同時設置兩個不加入土壤的培養瓶作為對照。MBC 采用氯仿熏蒸K2SO4提取-TOC 儀測定法。土壤細菌群落結構采用高通量測序的方法進行測定[9],具體步驟:使用土壤DNA 試劑盒(OMEGA,E.Z.N.A)抽提DNA,1%瓊脂糖凝膠電泳檢測抽提的DNA 后進行PCR 擴增。細菌16S rRNA擴增采用通用引物27F 5′-AGAGTTTGATCCTGG CTCAG-3′和533R 5′-TTACCGCGGCTGCTGGCA C-3′(測序端)。PCR 儀為ABI GeneAmp? 9700 型,采用TransGen:TransStart Fastpfu DNA Polymerase,20 μL反應體系,參數如下:95 ℃預變性2 min;95 ℃變性30 s,55 ℃退火30 s,72 ℃延伸30 s,重復25 個循環;72 ℃延伸5 min。使用AXYGEN 公司的AxyPrepDNA凝膠回收試劑盒切膠回收PCR 產物,Tris-HCl 洗脫;2%瓊脂糖電泳檢測,2 μL 上樣檢測電泳圖。將已構建好的PCR 產物文庫參照電泳初步定量結果,使用藍色熒光定量(Promega Corporation, CA, USA),經 過emPCR 之 后(Roche, Mannheim, Germany),采用Roche GS-FLX 454 (Roche, Mannheim, Germany)平臺測序,測序送至上海美吉生物醫藥科技有限公司完成。
1.4 數據分析
利用SPSS 18.0 軟件對土壤微生物呼吸速率、累積呼吸量和微生物代謝熵進行雙因素(溫度和水分處理)方差分析,并在同一水分水平下對各指標進行單因素(溫度處理)方差分析(One-way ANOVA),采用LSD 法(P< 0.05)對各指標在不同處理間的差異進行顯著性分析。為了得到溫度每增加10 ℃時土壤微生物呼吸速率增加的倍數,采用指數關系模型計算Q10,即R=a×ebT,Q10= e10b,式中:R為土壤微生物呼吸,T為溫度,a和b為擬合參數。將測序后的數據剔除標簽(Barcode)和引物(Primer)序列,Flash軟件進行序列拼接,并將長度 < 200 bp 或質量較低的序列從數據集中刪除,再用UCHIME 軟件去除嵌合體序列[10],得到有效序列。所有有效序列使用軟件Mothur 通過歸類操作,將序列按照彼此的相似性(相似性水平≥ 97%)分歸為不同的分類操作單元(OTUs),根據SILVA 庫中的參考序列對OTUs 進行種屬鑒定,并計算細菌群落多樣性(Shannon 指數)[11]。在門(Phylum)水平和屬(Genus)水平統計各樣本細菌群落優勢類群(平均相對豐度≥ 0.2%)相對豐度,并進行雙因素(溫度和水分處理)方差分析。采用R 語言vegan 軟件包對細菌群落結構(基于OTUs)進行非度量多維度分析(Non-metric multidimensional scaling,NMDS),并采用ANOSIM 基于土壤類型、溫度和水分處理進行差異顯著性分析[12]。最后用Origin 2018 作圖。
2 結果
2.1 土壤微生物呼吸速率和累積呼吸量
不同溫度和水分處理下,草地土壤在各個培養期內土壤微生物呼吸速率均高于對應時期耕地土壤(表2)。溫度處理對各個培養時期土壤微生物呼吸速率均產生顯著影響(P< 0.05):隨著溫度升高,土壤微生物呼吸速率有增加趨勢。水分處理僅對培養28 d 后的耕地土壤微生物呼吸速率有顯著影響,即供水水平60% WHC 下的土壤微生物呼吸速率顯著高于80%供水下的值;而水分處理對培養7 d 和14 d 后的草地土壤微生物呼吸速率有顯著影響,且60% WHC 和80% WHC 供水水平下的土壤微生物呼吸速率顯著高于40% WHC 下的值(P< 0.05)。溫度和水分交互效應對培養前期(7 d)土壤微生物呼吸速率產生顯著影響(P< 0.05)。總的來說,隨著培養時間的增加,土壤微生物呼吸速率逐漸減小,培養7 d 的土壤呼吸速率均高于培養28 d 時的值。
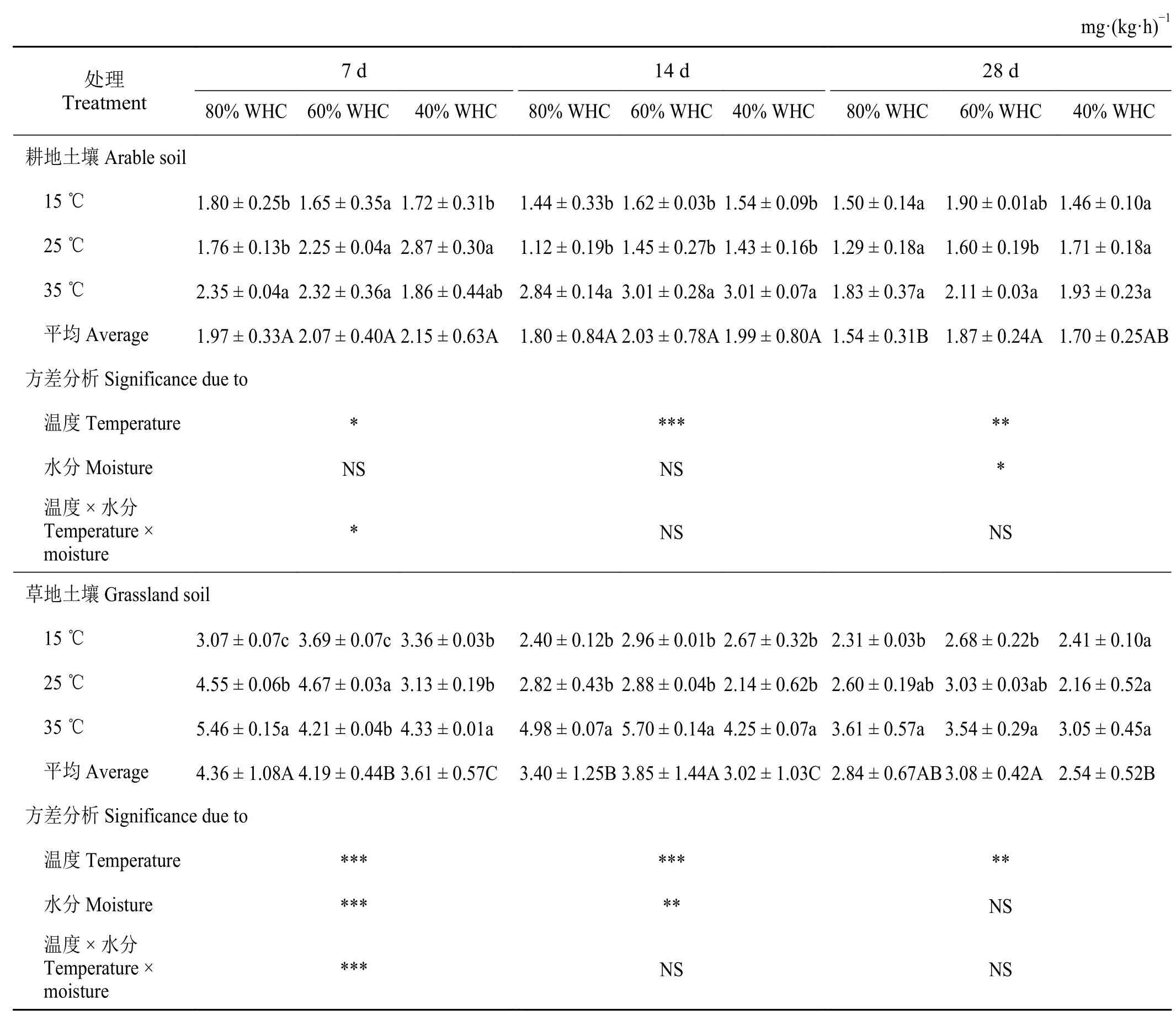
表2 不同溫度和水分處理下土壤微生物呼吸速率的變化Table 2 Soil microbial respiration rate under different temperature and water treatments
土壤微生物呼吸速率乘以時間得到土壤微生物累積呼吸量(表3)。不同溫度和水分處理下,草地土壤在各個培養期內土壤微生物累積呼吸量均高于對應時期耕地土壤(表3)。在3 個取樣時間節點(7、14 和28 d),溫度處理均顯著影響著累積呼吸量(P< 0.001):隨著溫度的升高累積呼吸量顯著增加。水分處理對培養14 和28 d 后的耕地土壤累積呼吸量有顯著影響,且供水水平60% WHC 下的土壤微生物累積呼吸量顯著高于80% WHC 條件下的值;而水分處理對所有培養時期草地土壤微生物累積呼吸量均有顯著影響,且60% WHC 和80% WHC 供水水平下的土壤微生物累積呼吸量顯著高于40% WHC 下的值(P< 0.05)。溫度和水分交互效應對培養7 和14 d 后的土壤微生物累積呼吸量有顯著影響(P< 0.05)。總的來說,隨著培養時間的增加,土壤微生物累積呼吸量逐漸增加,耕地土壤平均微生物累積呼吸量從426.1 mg·kg-1(7 d)增加至1 360.7 mg·kg-1(28 d);草地土壤平均微生物累積呼吸量從924.0 mg·kg-1(7 d)增加至2 560.1 mg·kg-1(28 d),且3 個培養時期土壤微生物累積呼吸量間均有差異。
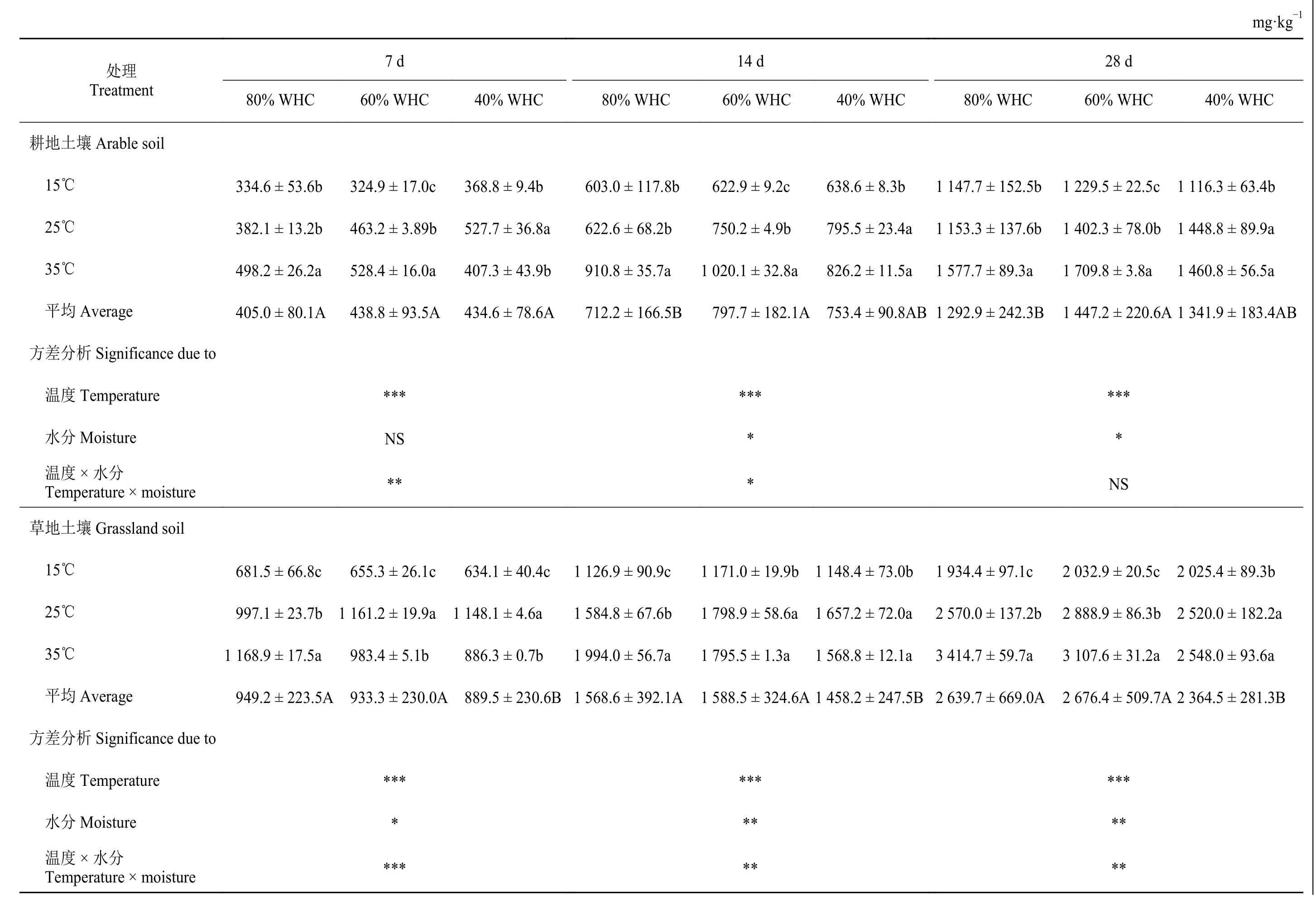
表3 不同溫度和水分處理下土壤微生物累積呼吸量的變化Table 3 Cumulative soil microbial respiration under different temperature and water treatments
通過計算Q10來表示不同水分條件下的土壤微生物呼吸溫度敏感性(圖1)。Q10隨著培養時間的增加呈現先增加后降低的趨勢,即培養中期(14 d)的Q10明顯高于培養前期(7 d)和后期(28 d)。同時,在不同培養時期,水分處理對不同土壤Q10值的影響不同。耕地土壤在培養前期,60% WHC > 80% WHC > 40%WHC;培養中期,80% WHC > 40% WHC > 60% WHC;培養后期則表現為40% WHC > 80% WHC > 60%WHC。而對草地土壤而言,在所有培養時期80%WHC 下的Q10值均為最大,培養前期40% WHC >60% WHC;而在培養中期和后期,則表現為60%WHC > 40% WHC。
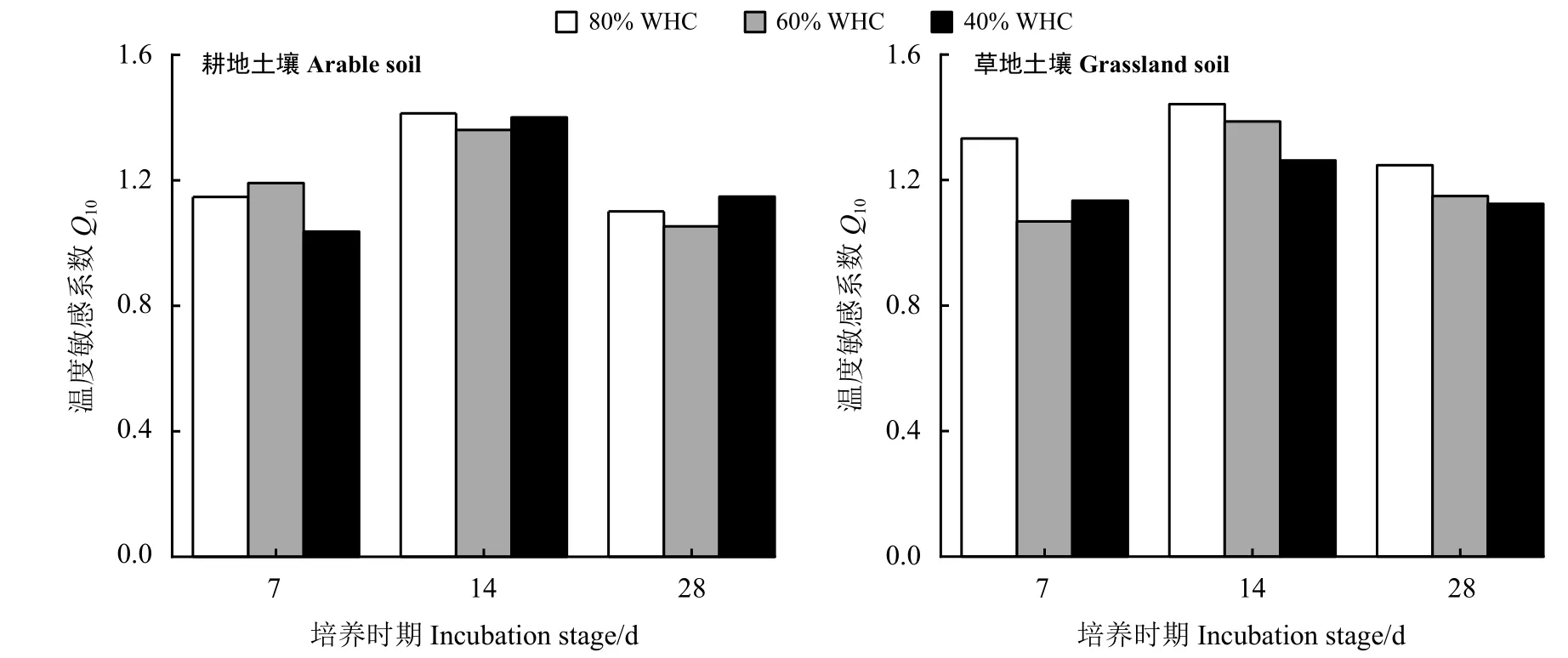
圖1 不同培養時期不同水分處理下土壤微生物呼吸溫度敏感系數Q10Figure 1 Soil microbial respiratory temperature sensitivity coefficient Q10 under different water treatments and incubation stages
2.2 土壤微生物代謝熵
培養7、14 和28 d 后,草地土壤微生物代謝熵(qCO2)含量均低于對應時期耕地土壤qCO2值(表4)。溫度處理對草地和耕地qCO2均有顯著影響(P<0.05);水分處理對各個培養時期草地土壤qCO2有顯著影響,而僅對培養7 d時的耕地土壤qCO2有顯著影響(P< 0.05)。耕地土壤不同培養時期下的土壤qCO2差異不明顯,而草地土壤培養7 d 的土壤qCO2明顯高于14 和28 d (P< 0.05);同時,不同時期土壤qCO2值隨著溫度和水分的變化方式也有所不同。培養前期(7 d),25 ℃下耕地土壤qCO2均顯著高于15 ℃和35 ℃下的值(P< 0.05);耕地土壤80%WHC 供水條件下qCO2顯著低于60% WHC 和40%WHC 處理下的值,草地土壤各供水條件間的qCO2值差異均達到顯著水平(P< 0.05),表現為60%WHC > 80% WHC > 40% WHC。培養中期(14 d),隨著培養溫度的增加,耕地和草地土壤qCO2均呈增加趨勢,且大多在35 ℃下的值顯著高于15 ℃和25 ℃ (P< 0.05)。培養后期(28 d),耕地和草地土壤qCO2均表現為35 ℃ > 15 ℃ > 25 ℃,35 ℃下的值分別為5.61 和3.13 μg·(mg·h)-1;且草地土壤qCO2在3 種水分條件間的差異達到顯著水平,表現為60% WHC > 80% WHC > 40% WHC。
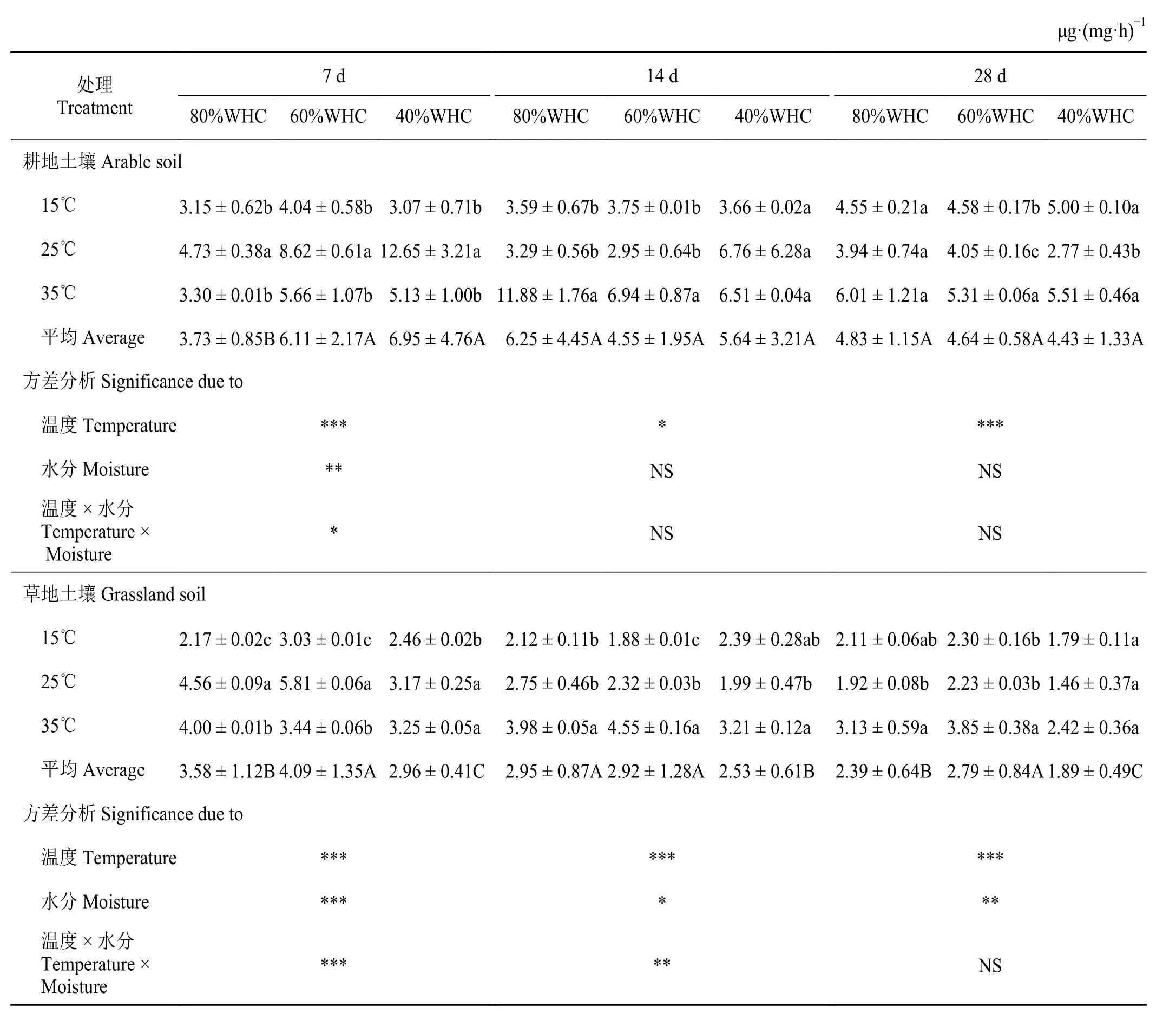
表4 不同溫度和水分處理下土壤微生物代謝熵(qCO2)的差異Table 4 Microbial metabolic quotient (qCO2) determined under different temperature and water treatments
2.3 土壤細菌群落結構組成和多樣性
對純培養28 d 后的土壤進行高通量測序,兩種土壤溫度和水分處理的18 個樣品共得到182 838 條16s rRNA 有效序列,將這些有效序列去雜得到優化的135 653 條高效序列,每個樣品平均7 536 條。對所有樣本序列進行隨機抽樣作稀釋曲線(圖2),所有樣本的稀釋曲線均基本趨于平緩,表明本研究中的測序深度能夠反映土壤樣本中的細菌群落結構。根據序列97%相似性的原則,共有122 295 條序列劃分到不同的OTUs 中。不同溫度和水分處理后,草地土壤細菌群落Shannon 指數明顯高于對應處理下的耕地土壤(表5),同時,25 ℃下的耕地土壤細菌群落多樣性顯著高于35 ℃;而溫度和水分處理對草地土壤細菌群落Shannon 指數無顯著影響。
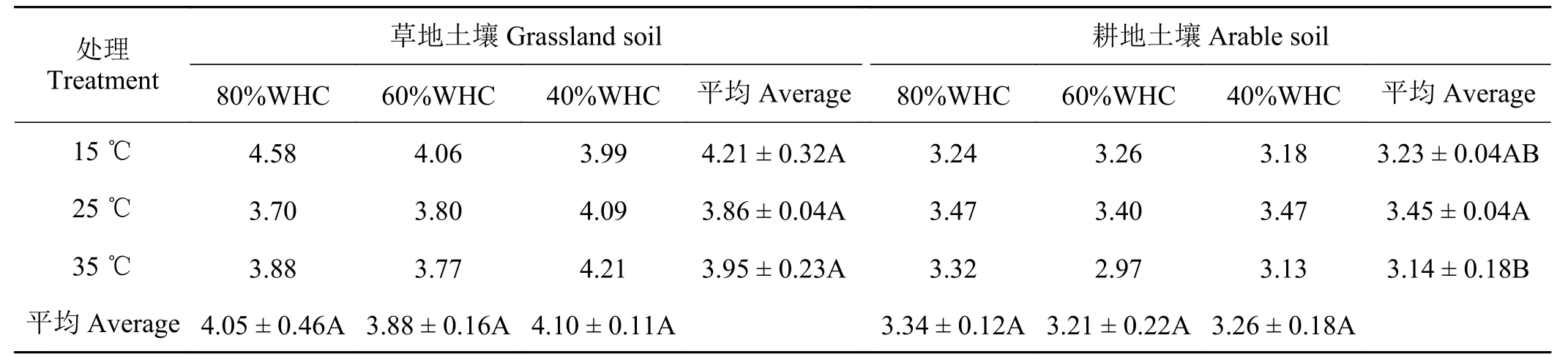
表5 不同溫度和水分處理下土壤細菌群落多樣性(Shannon 指數)的差異Table 5 The changes in soil bacterial community diversity (Shannon index) under different temperature and water treatments
圖2 土壤細菌群落豐度稀釋曲線Figure 2 Rarefaction curves for bacterial community of each soil sample
將所有處理土壤細菌群落結構組成(基于OTUs)進行NMDS 排序分析(圖3)。ANOSIM 相似性檢驗結果表明,耕地土壤和草地土壤經不同溫度和水分處理后細菌群落結構組成顯著差異(r= 0.715,P<0.01)。同種土壤不同溫度和水分處理后細菌群落結構差異均不顯著,但相較于耕地土壤(溫度r= 0.119,P= 0.196;水分r= 0.136,P= 0.185),溫度和水分處理對草地土壤(溫度r= 0.226,P= 0.056;水分r=0.202,P= 0.095)細菌群落結構的影響更大。
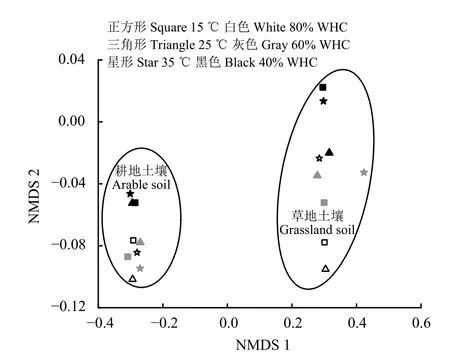
圖3 不同溫度和水分處理下細菌群落結構(基于OTUs)NMDS 排序圖Figure 3 Non-metric multidimensional scaling of soil bacterial community compositions (based on OTUs)under different temperature and water treatments after 28 d incubation
為了得到每個OTUs 對應的物種分類信息,根據SILVA 庫中的參考序列對97%相似水平的OTUs代表序列進行分類學分析,在土壤中存在門水平和屬水平的主要細菌優勢類群(平均相對豐度 ≥0.2%)相對豐度變化如圖4 和圖5 所示。兩種土壤中檢測到的主要細菌群落有:厚壁菌門(Firmicutes)、綠彎菌門(Chloroflexi)、變形菌門(Proteobacteria)、酸桿菌門(Acidobacteria)、放線菌門(Actinobacteria)、擬桿菌(Bacteroidetes)、浮霉菌門(Planctomycetes)、芽單胞桿菌門(Gemmatimonadetes)、Candidate_division_TM7、Unclassified bacteria、硝化螺旋菌門(Nitrospirae)和藍菌門(Cyanobacteria),其相對豐度之和達到99%以上。其中,厚壁菌門(Firmicutes)細菌99%以上屬于Bacillus和Lactococcus屬;綠彎菌門(Chloroflexi)中的優勢類群為KD4-96_norank 屬;變形菌門(Proteobacteria)的優勢類群有Thermomonas、Sphingomonas、GR-WP33-30_norank 和Defluviicoccus屬;酸桿菌門(Acidobacteria)則有約66%為Subgroup_6_norank、Subgroup_25_norank和Blastocatella屬;放線菌門(Actinobacteria)約58%為Marmoricola、 MB-A2-108_norank、 OCS155_marine_group_norank 和 uncultured_norank 屬; 擬 桿 菌 門(Bacteroidetes)主 要 是Flexibacter屬; 浮 霉 菌 門(Planctomycetes)中 有 25%為 WD2101_soil_group_norank 屬;芽單胞桿菌門(Gemmatimonadetes)中的優勢種主要為S0134_terrestrial_group_norank 屬,約占芽單胞桿菌門的25%;硝化螺旋菌門(Nitrospirae)有約50%屬于Nitrospira屬。
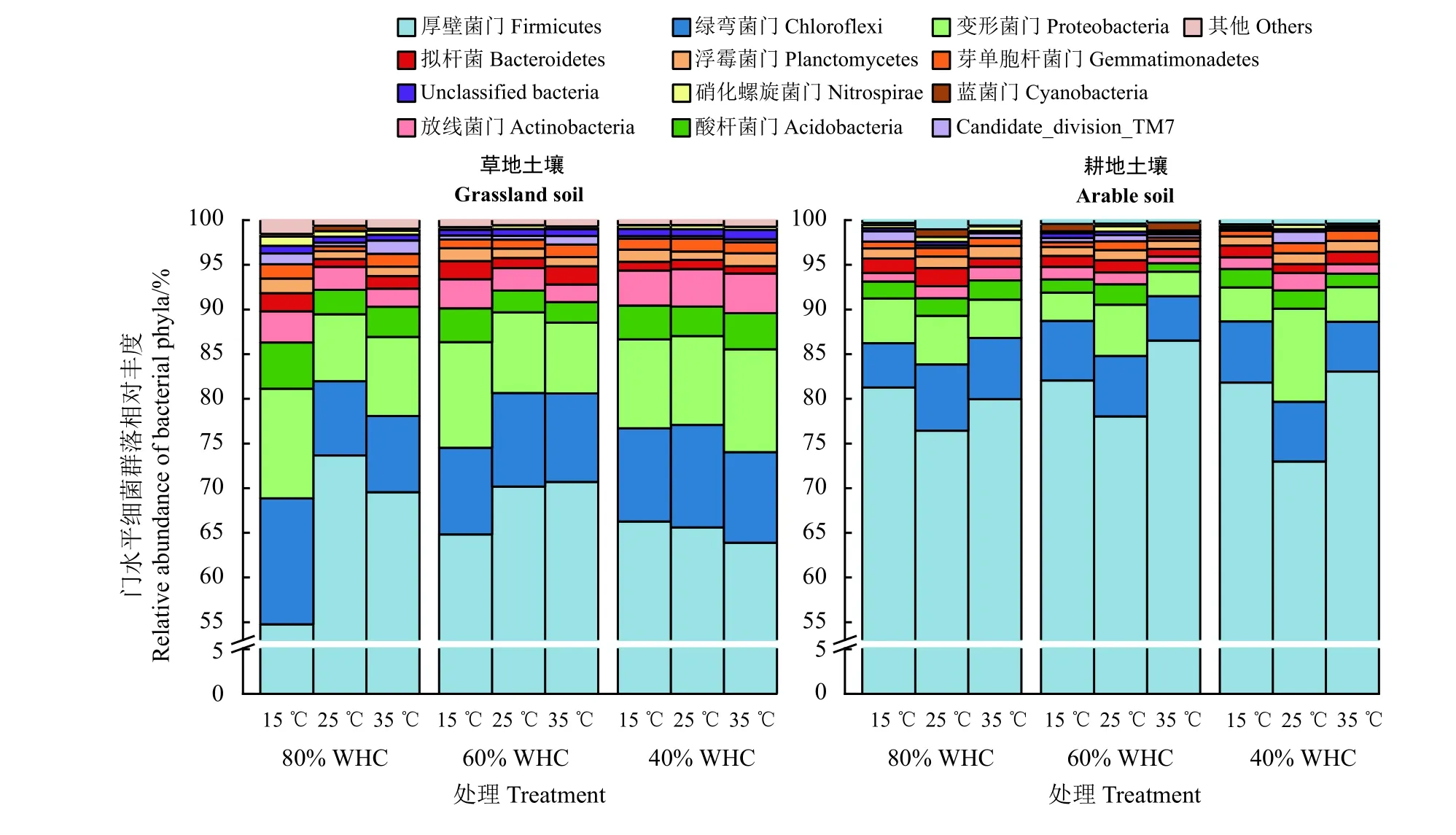
圖4 不同溫度和水分處理下土壤主要細菌群落在門水平相對豐度的變化Figure 4 The changes in relative abundance of the dominant bacterial groups at the phylum levels under different temperature and water treatments after 28 d incubation
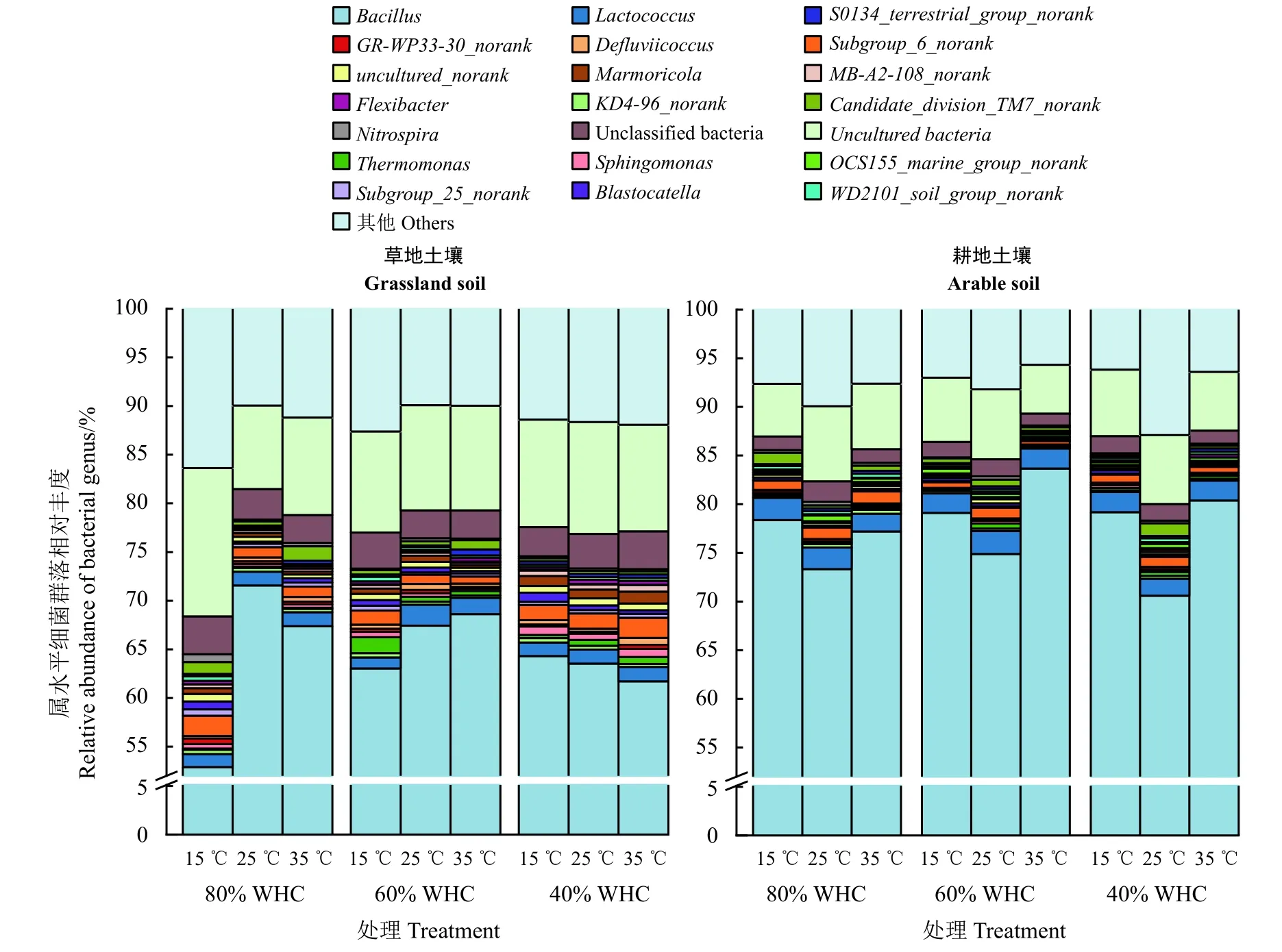
圖5 不同溫度和水分處理下土壤主要細菌群落在屬水平相對豐度的變化Figure 5 The changes in relative abundance of the dominant bacterial groups at the genus levels under different temperature and water treatments after 28 d incubation
草地土壤中厚壁菌門(Firmicutes)、Bacillus屬、Lactococcus屬 和OCS155_marine_group_norank 屬 相對豐度顯著低于耕地土壤;而綠彎菌門(Chloroflexi)、變形菌門(Proteobacteria)、酸桿菌門(Acidobacteria)、放 線 菌 門 (Actinobacteria)、 芽 單 胞 桿 菌 門(Gemmatimonadetes)、Sphingomonas屬、GR-WP33-30_norank 屬、Defluviicoccus屬、Subgroup_6_norank 屬、Subgroup_25_norank 屬、Blastocatella屬、Marmoricola屬、MB-A2-108_norank 屬和Flexibacter屬相對豐度則明顯高于耕地土壤。
不同土壤中優勢類群相對豐度隨溫度和水分變化方式有著明顯不同。總的來說,草地土壤40% WHC下的Actinobacteria 門、Sphingomonas屬、Marmoricola屬和MB-A2-108_norank 屬細菌相對豐度明顯高于60% WHC 和80% WHC;40% WHC 和60% WHC 水分條件下的Cyanobacteria 門細菌相對豐度明顯低于80% WHC。隨著處理溫度的增加,草地土壤KD4-96_norank 屬和Blastocatella屬細菌相對豐度逐漸減少,15 ℃下的值明顯高于25 ℃和35 ℃;對于耕地土壤而言,25 ℃下Firmicutes 門和Bacillus屬細菌相對豐度明顯低于15 ℃和35 ℃;而25 ℃下Nitrospirae 門和Nitrospira屬細菌相對豐度則明顯高于15 ℃。
3 討論和結論
土壤是陸地生態系統中最大的碳庫,其碳儲量相當于大氣碳庫的3.3 倍和植物碳庫的4.5 倍[13]。土壤碳庫大小主要受動植物殘體輸入量以及土壤有機質分解速率影響。土壤有機質的分解是由微生物介導的復雜過程,與土壤溫度和濕度密切相關[14]。土壤微生物呼吸是土壤呼吸的重要組成部分,在不同生態系統中對總呼吸的貢獻量可達30%~90%[15]。本研究中純培養所使用的耕地土壤和草地土壤,是元謀干熱河谷兩種典型土地利用類型下的土壤。干熱河谷不論是自然還是人工生態系統,土地生產力在雨季都非常高,有機碳通過植物凋落物向土壤輸入量不低[16]。草地土壤全碳含量顯著高于耕地土壤(分別為4.35%和1.49%) (表1),即草地土壤中可供微生物呼吸利用的底物碳較多,導致草地土壤微生物呼吸速率和累積呼吸量明顯高于耕地土壤(表2、表3)。同時,草地土壤微生物代謝熵(qCO2)含量均低于對應時期耕地土壤qCO2值(表4),表明草地土壤微生物利用底物的效率較高,構造微生物生物量碳比例相對較大,單位生物量中通過呼吸損失的碳較少[17]。
隨著溫度的升高,各培養期土壤微生物呼吸速率和累積呼吸量均顯著增加(表2、表3)。在一定的溫度范圍內,土壤呼吸與溫度呈正相關關系[18-19]。Q10是反映土壤呼吸溫度敏感性的指標,本研究中,Q10隨著培養時間的增加呈現先增加后降低的趨勢(圖1),即在培養中期(14 d),無論是草地土壤還是耕地土壤,有機碳的微生物降解對溫度最敏感。土壤微生物呼吸的溫度敏感性主要受底物供應水平和微生物活性的影響[20]。Conant 等[21]的培養試驗結果表明,有機碳含量高的土壤養分利用效率越高,微生物活性越強,土壤呼吸作用增強,Q10值也越大。除有機碳含量外,有機質質量(如抵抗分解的能力)也是影響Q10值的重要因素[22]。不同的試驗方法、測定方法和計算方法會影響Q10值的大小,其變化范圍大致為1~12[23]。本研究中,耕地土壤和草地土壤Q10變化范圍為1.05~1.44,總體上屬于較低的水平,這可能與本研究所用培養方法只考慮了土壤微生物呼吸作用有關。此外,本研究中,溫度處理顯著影響著兩種土壤qCO2,培養14 和28 d 時35 ℃下qCO2值明顯增加,這與溫度增加后土壤微生物呼吸速率增加有關,qCO2值的增加也表明土壤有機碳降解會隨之增加[24]。
土壤水分一方面可以直接控制微生物生命活動,另一方面可以通過控制可溶性有機質的有效性和可移動性,影響土壤微生物用于呼吸的底物和能量物質,進而影響土壤呼吸作用[25-26]。土壤水分狀況與土壤呼吸之間的關系模型有很多,包括線性、對數、二次式和拋物線等多種函數關系[27]。本研究中,水分處理對不同培養時期的土壤微生物呼吸速率產生顯著影響,且60% WHC 條件下土壤微生物累積呼吸量呈現增加的趨勢。由于干熱河谷區大部分時間處于干燥的環境中,蒸發量大于降水量,野外土壤水分含量常處于重度脅迫狀態,在該區轉暖變濕的情況下,耕地和草地土壤微生物累積呼吸量可能會隨著土壤水分脅迫狀態的改善而增加,在60% WHC 時達到最大值。
草地和耕地土壤經溫度和水分處理后細菌群落結構組成有著明顯的差異(r= 0.715,P< 0.01) (圖3),這與前人的研究結果類似[28-29],采自不同環境的土壤經過相同的溫度和水分處理后,微生物群落結構仍表現出較大差異。本研究中,草地土壤中厚壁菌門(Firmicutes, 含Bacillus屬 和Lactococcus屬)和OCS155_marine_group_norank 屬相對豐度顯著低于耕地土壤;而其綠彎菌門(Chloroflexi)、變形菌門(Proteobacteria, 含Sphingomonas屬、 GR-WP33-30_norank 屬和Defluviicoccus屬)、酸桿菌門(Acidobacteria,含Subgroup_6_norank 屬、Subgroup_25_norank 屬和Blastocatella屬)、 放 線 菌 門 (Actinobacteria, 含Marmoricola屬和MB-A2-108_norank 屬)和芽單胞桿菌門(Gemmatimonadetes)和Flexibacter屬相對豐度顯著高于耕地土壤。同種土壤不同溫度和水分處理后細菌群落結構差異均不顯著,相對于耕地土壤,溫度和水分處理對草地土壤細菌群落結構的影響更大(圖3)。這可能是由兩種土地類型在歷史環境中所經歷的條件不同導致的:草地土壤受到的擾動較小,土壤溫度和水分變化主要受氣候條件的影響;而耕地土壤在人為灌溉、翻耕等的影響下其土壤溫度和水分常常發生變化。同樣,采自北極不同海拔的土壤經歷兩周的凍融交替處理后,相對于高海拔上的群落變化,氣候變暖使得低海拔土壤正在經歷著凍融交替,細菌群落結構在低海拔上的變化相對較穩定[30]。在不同溫度和水分處理下,各門水平的土壤細菌群落顯示出不同的應對策略:相對豐度大的少數細菌群落變化幅度大;而其余相對豐度小的大多數變化幅度也較小。不同土壤細菌群落可能存在適宜其生長的水分和溫度生態位[31]。草地土壤40% WHC 下的放線菌門(Actinobacteria)以及其下的Marmoricola屬和MB-A2-108_norank 屬細菌相對豐度顯著高于60% WHC 和80% WHC (圖3)。Barnard等[32]也發現在干旱環境時放線菌門細菌豐度增加,而酸桿菌門細菌在濕潤時相對豐度較大。不過,本研究中酸桿菌門細菌相對豐度隨水分的變化方式不固定。由于土壤本身是個非常復雜的環境,在面對溫度水分變化時,一方面會直接對各細菌群落相對豐度產生影響;另一方面一種群落相對豐度的變化可能會導致另一群落豐度的變化。總的來說,從門水平上看,兩種土壤中主要的細菌群落變化不大,如厚壁菌門、變形菌門、酸桿菌門、放線菌門、綠彎菌門和芽單胞桿菌門,這些主要的細菌門在各溫度和水分處理下的耕地和草地土壤中均存在。
綜上,在各個培養時期,草地土壤微生物呼吸速率和累積呼吸量顯著高于耕地土壤,而草地土壤qCO2顯著低于耕地土壤。隨著溫度的升高,各培養期土壤微生物呼吸速率和累積呼吸量均顯著增加;水分處理對土壤微生物呼吸有顯著影響,但不同土壤影響方式有差異,60% WHC 條件下兩種土壤微生物累積呼吸量呈現增加的趨勢。土壤類型對細菌群落結構的影響較大(R= 0.715,P< 0.01),草地土壤中厚壁菌門相對豐度顯著低于耕地土壤;而綠彎菌門、變形菌門、酸桿菌門、放線菌門和芽單胞桿菌門相對豐度顯著高于耕地土壤。相對于耕地土壤,溫度和水分處理對草地土壤細菌群落結構組成的影響更大:草地土壤放線菌門(含Marmoricola屬和MB-A2-108_norank 屬)、藍 菌 門 和Sphingomonas屬細菌相對豐度隨水分條件的變化發生顯著改變;隨著溫度條件的變化,草地土壤KD4-96_norank 屬和Blastocatella屬,以及耕地土壤厚壁菌門(含Bacillus屬)和硝化螺旋菌門(含Nitrospira屬)細菌相對豐度發生顯著改變。

