光交聯PVA-SBQ/透明質酸納米纖維的制備及性能
宋曉艷,楊 哲,徐如夢,邢金峰
(1.天津工業大學材料學院,天津 300387; 2.天津大學化工學院,天津 300350)
靜電紡絲是一種制備微納米纖維的常用方法。靜電紡納米纖維膜具有很高的比表面積,可調節孔隙度和孔徑等優點,被廣泛應用于傷口敷料、組織工程、藥物遞送等生物醫用領域[1-4]。聚己內酯、聚乳酸、纖維素、透明質酸等生物材料都可以通過靜電紡絲技術制備納米纖維膜。透明質酸(HA)是由D-葡萄糖醛酸和N-乙酰-D-葡糖胺二糖單元組成的天然線性多糖,是細胞質基質的重要組成部分[5]。由于HA具有優異的生物相容性、可降解性,被廣泛應用于生物醫學領域,但是HA易溶于水、降解速度較快且黏彈性很高,可紡性較差,所以很多研究中通過對其改性或與其他物質混合來提高可紡性和耐水溶性。Takahashi等[6]分別用疊氮基和環辛基修飾HA,使其在PBS中降解時間超過14 d,提高了HA的耐水溶性;Ma等[7]將HA與殼聚糖混紡制備具有核殼結構的纖維,HA為核,提高了HA的可紡性和耐水溶性。
聚乙烯醇-苯乙烯吡啶(PVA-SBQ)是一種新型光敏高分子材料,在紫外光輻照下會發生交聯形成具有網絡結構的聚合物。由于PVA-SBQ具有良好的生物相容性、儲存性能和光敏性,被廣泛的用作光交聯材料[8]。Tao等[9]利用PVA-SBQ與透明質酸成膜來提高透明質酸膜的耐水溶性,Liu等[10]對PVA-SBQ與PVA的電轉移進行了研究,并應用于藥物遞送。
5-氟尿嘧啶(5-FU)是一種抗癌藥物,對實體腫瘤具有廣泛的活性,可用于乳腺癌、結直腸癌等惡性腫瘤的治療[11-14]。但是5-FU在體內裸釋速度較快且副作用嚴重,因此研究合適的給藥載體,降低5-FU的釋放速度具有重要的意義。
本研究利用甲基丙烯酸縮水甘油酯對透明質酸進行改性得到帶雙鍵的GMHA,GMHA和PVA-SBQ均可在紫外光下發生交聯,形成復合纖維網絡。采用靜電紡絲技術制備了PVA-SBQ/GMHA纖維膜,并通過紫外光交聯形成復合纖維膜,對輻照交聯的最適宜時間以及交聯前后纖維膜的耐水溶性、不同環境下的溶脹性能和藥物釋放進行了研究,表明交聯后的纖維膜的耐水溶性和藥物緩釋性能都有明顯的改善。
1 實驗部分
1.1 主要原料
甲基丙烯酸縮水甘油酯(GMA),分析純,上海阿拉丁生化科技股份有限公司;透明質酸(HA),分析純,上海阿拉丁生化科技股份有限公司;聚乙烯醇-苯乙烯吡啶鹽(PVA-SBQ),168-H型,上海光毅印刷器材科技有限公司;2-羥基-4′-(2-羥乙氧基)-2-甲基苯丙酮(I2959),分析純,上海阿拉丁生化科技股份有限公司;5-氟尿嘧啶(5-FU),分析純,上海晶純生化科技股份有限公司;鹽酸(37%水溶液),天津光復科技發展有限公司。
1.2 主要設備及儀器
電導率儀,METTLER TOLED FE38,梅特勒-托利多國際貿易(上海)有限公司;傅里葉紅外光譜儀(FT-IR),Nicolet iS50,賽默飛世爾科技公司;冷場發射掃描電子顯微鏡(SEM),Hitachi S-4800,日本HITACHI公司;透射電子顯微鏡(TEM),Hitachi H7650,日本HITACHI公司;紫外分光光度計,Lambda35,PerkinElmer公司。
1.3 樣品制備
1.3.1 GMHA的合成
取1 g HA溶于100 mL蒸餾水中,加入2.2 mL三乙胺、2.2 mL GMA、2.2 g四丁基溴化銨,反應24 h,將產物在蒸餾水中透析48 h,冷凍干燥得到GMHA樣品[15]。
1.3.2 PVA-SBQ/GMHA纖維膜的制備
將一定質量的PVA-SBQ在90 ℃下完全溶解于水配制5 mL濃度為40%的溶液,加入0.01 g GMHA,制備PVA-SBQ/GMHA的紡絲液。在電壓20 kV、接收距離20 cm、給料速率1.0 mL/h的條件下靜電紡得到PVA-SBQ/GMHA纖維膜。在PVA-SBQ/GMHA紡絲液中加入1.0%(質量分數,下同)的5-氟尿嘧啶,在相同的紡絲條件下制備載藥PVA-SBQ/GMHA纖維膜。
1.4 結構表征與性能測試
1.4.1 FT-IR分析
將研磨后的GMHA、HA樣品和溴化鉀混合、壓片,用傅里葉紅外光譜儀測試。
1.4.2 SEM分析
將溶脹前后的纖維膜干燥,噴金,在冷場發射掃描電子顯微鏡下觀察形貌,采用X特征射線能譜儀測定纖維膜表面F元素的含量,利用軟件Nano Measurer測量纖維直徑并求其平均值。
1.4.3 紡絲液電導率測試
用電導率儀測試紡絲液的電導率,每種溶液重復測量3次,取平均值。
1.4.4 纖維膜溶脹比與溶失率的測定
將PVA-SBQ、未光照的以及紫外光照不同時間的PVA-SBQ/GMHA纖維膜原樣的質量記為w0,將纖維膜原樣分別放入等體積的緩沖溶液中,每間隔2 h取出纖維膜,除去表面水分,3次稱量其質量取平均值記為wh,將浸水后的樣品烘干至恒質量后再次稱取其質量記為w1,利用公式(1)求其溶脹比q1,利用公式(2)求其溶失率q2;同樣將PVA-SBQ/GMHA纖維膜分別放置于不同pH值、溫度的緩沖溶液中,按照上述方法求其溶脹比q1。
q1=wh/w0
(1)
q2=(w0-w1)/w0×100%
(2)
式(1)和式(2)中:w0為膜原樣的質量,wh為浸水不同時間后吸水膜的質量,w1為浸水不同時間后干燥膜的質量。
1.4.5 纖維膜載藥釋放測試
取一定質量的PVA-SBQ/GMHA載藥纖維膜分別放置于相同體積的緩沖溶液中進行藥物釋放測試,在不同的時間間隔內量取5 mL的藥物釋放溶液于比色皿中,在波長為267 nm處測量溶液的吸光度,然后將溶液倒回。根據所測量的吸光度和5-FU的標準釋放曲線,計算不同時間藥物的累積釋放量,結合纖維膜中藥物的理論含量求出藥物的累積釋放百分比[16]。
樣品纖維膜的理論載藥量:
m=m1a/(a+b+c)
(3)
式(3)中:m為纖維膜中藥物的理論含量;m1為樣品纖維膜的質量;a為紡絲液中藥物的質量;b為紡絲液中GMHA的質量;c為紡絲液中PVA-SBQ的質量。
釋放藥物累積百分比:
p=mt/m×100%
(4)
式(4)中:p為藥物累積釋放百分比;mt為藥物累積釋放量;m為載藥纖維膜樣品的理論載藥量。
2 結果與討論
2.1 透明質酸的修飾
圖1為HA與GMHA的紅外譜圖。
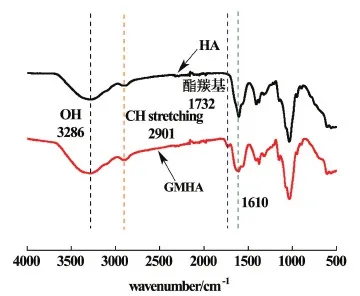
圖1 HA與GMHA的紅外光譜Fig.1 FTIR spectra of HA and GMHA powders

2.2 形貌分析
圖2是未載藥及載藥1.0%和2.5%的PVA-SBQ/GMHA纖維膜的掃描電鏡、纖維直徑分布及EDX元素分析圖。隨著藥物含量增加,PVA-SBQ/GMHA纖維平均直徑有所減小,原因是在紡絲溶液中加入藥物后電導率增加(如表1所示),導致紡絲過程中流體受到的電場力增大,纖維直徑減小[18-20]。載藥1.0%的PVA-SBQ/GMHA纖維膜表面出現少量藥物聚集,而加入2.5%藥后,有很多紡錘狀PVA-SBQ/GMHA纖維出現,并且纖維膜表面出現了藥物顆粒,其主要原因是5-FU在溶劑中的溶解度的限制,當載藥量為1.0%時藥物可以完全溶解,由于紡絲過程中溶劑揮發,部分5-FU裸露在纖維表面,當載藥量增加到2.5%時,部分5-FU以顆粒的狀態存在于紡絲溶液中,影響紡絲并在紡絲過程中直接附著在纖維表面[21-22]。EDX能譜測試結果也證明了這一點,載藥前的纖維膜表面有微量的F元素存在,1.0%的載藥纖維膜表面有少量的F元素存在,而2.5%的載藥纖維膜表面有較多的F元素存在。

表1 不同載藥量PVA-SBQ/GMHA紡絲液的電導率Table 1 Conductivity of PVA-SBQ/GMHA spinning solution with different drug loadings
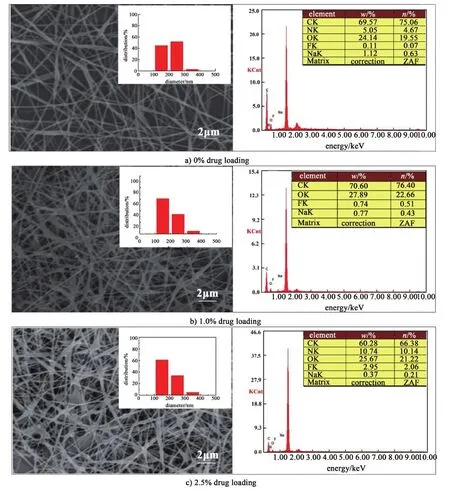
圖2 PVA-SBQ/GMHA 纖維膜掃描電鏡及纖維直徑分布圖Fig.2 EDX and SEM of PVA-SBQ/GMHA fiber membrane
圖3是不同光照時間下的PVA-SBQ/GMHA纖維膜在水中溶脹后的掃描電鏡圖。
由圖3中可以看出未光照的纖維膜在浸水的瞬間發生溶解,纖維形貌消失;而經過紫外光輻射之后,浸水的纖維發生溶脹,仍能保留纖維的形貌,并且隨光照時間的增長,浸水后纖維的形貌越明顯,這是由于在光照條件下水溶性的PVA-SBQ/GMHA纖維發生交聯,且隨時間的增長交聯程度增加,溶解度降低[23-24];然而當光照時間達2.0 h時,浸水后的纖維膜纖維形貌消失,這是因為光照時間較長時透明質酸發生降解,交聯網絡破壞,纖維膜的耐水性變差[25-28],纖維形貌破壞。對比發現當紫外光照射時長為1.0 h時,溶脹后的PVA-SBQ/GMHA纖維膜形貌最好。
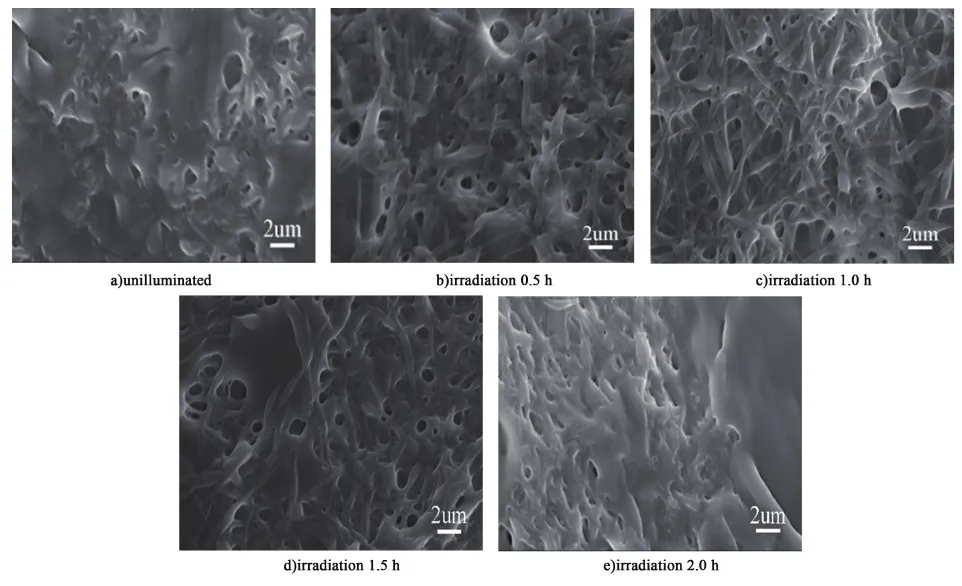
圖3 不同光照時間下的纖維膜浸水后的SEM圖Fig.3 SEM image of fiber membrane immersed in water for half an hour under different illumination time
2.3 溶脹比分析
圖4是PVA-SBQ、PVA-SBQ/GMHA纖維膜溶脹曲線。
由圖4中可以看出,加入GMHA之后纖維膜的溶脹比有所增加,這是由于GMHA分子鏈中含有大量的親水基團,如—COOH和—OH等,可以與水分子以氫鍵的形式結合,提高了纖維膜的溶脹比,然而纖維膜中GMHA的含量較少,所以溶脹比變化較小。
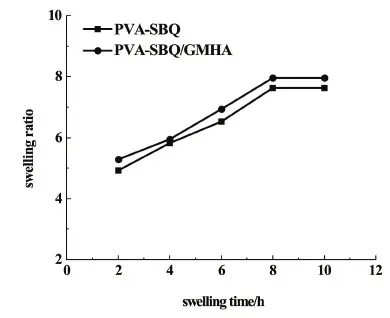
圖4 PVA-SBQ和PVA-SBQ/GMHA纖維膜溶脹曲線Fig.4 Swelling curve of PVA-SBQ and PVA-SBQ/GMHA
圖5是紫外光照不同時間下的PVA-SBQ/GMHA纖維膜的溶脹曲線。
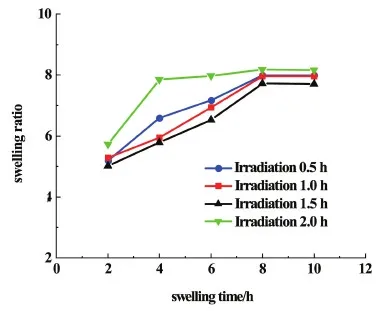
圖5 紫外光照不同時間下的PVA-SBQ/GMHA纖維膜的溶脹曲線Fig.5 Swelling curve of PVA-SBQ/GMHA fiber membrane under different illumination time
與圖4中PVA-SBQ/GMHA纖維膜溶脹曲線對比,發現浸水4.0 h時紫外光照時間為0.5 h時纖維膜的溶脹比略高于未光照的纖維膜,這是因為未光照時纖維內的GMHA分子溶于水,纖維膜的吸水能力下降,紫外光照射0.5 h時,纖維內的PVA-SBQ、GMHA發生交聯,纖維膜的溶解度下降;當紫外光照時間繼續增加,纖維膜的溶脹比隨光照時間的增長而降低,因為紫外光照時間越長,交聯程度越高,水分子進入膜內部的難度增加;然而光交聯的時間超過2.0 h后,纖維膜的溶脹比增加,這是因為紫外光照時間過長,透明質酸降解[25-28],交聯網絡破裂,水分子易與纖維膜中親水基團結合。圖6是紫外光照不同時間下的PVA-SBQ/GMHA纖維膜的溶失率曲線。
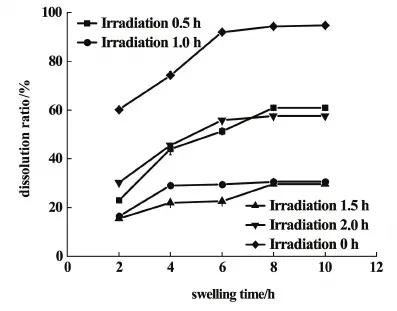
圖6 紫外光照不同時間下的PVA-SBQ/GMHA纖維膜的溶失率Fig.6 Dissolution ratio of PVA-SBQ/GMHA fiber membrane under different illumination time
圖6中曲線顯示,纖維膜的溶失率隨著紫外光照時間的增長而降低,當光照時長超過2.0 h時,溶失率上升,此規律與掃描電鏡的結果一致。
圖7a)是不同溫度下的PVA-SBQ/GMHA溶脹曲線,溫度越高纖維膜的溶脹比越低。當溫度較低時透明質酸峰分子鏈呈伸展結構,鏈上的親水基團與水分子形成氫鍵,溶脹度較高;當溫度升高時分子的布朗運動加快,氫鍵斷裂,溶脹度降低。圖7b)是不同pH值下的PVA-SBQ/GMHA纖維膜的溶脹曲線,當pH值為2.2時纖維膜的溶脹度比7.2時略小,當pH值較低時,溶液中的—NH2和—OH基團易發生質子化帶正電荷,被溶液中的H+和Cl-屏蔽,使纖維膜的溶脹度減小;當pH值為7.2時,溶液中Cl-的含量減少,屏蔽作用減弱,溶脹度增加[29]。
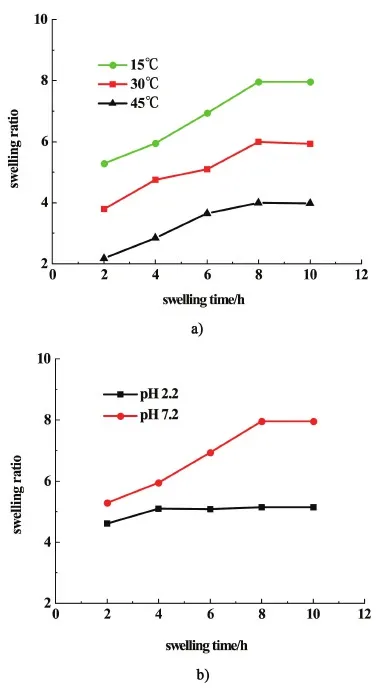
圖7 a)不同溫度下和b)不同pH值下的PVA-SBQ/GMHA溶脹曲線Fig.7 Swelling curves of PVA-SBQ under a)different temperatures and b)different pHs
2.4 PVA-SBQ/GMHA載藥纖維膜對5-FU的釋放研究
圖8是5-FU裸釋、載藥1.0%的PVA-SBQ/GMHA纖維膜光交聯前后載藥釋放曲線。
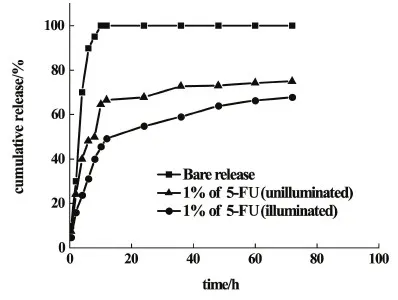
圖8 5-FU裸釋和光交聯前后PVA-SBQ/GMHA纖維膜載藥釋放曲線Fig.8 Drug release curves of 5-furacil bare release, unilluminated and illuminated PVA-SBQ/GMHA fiber membrane
當5-FU藥物裸釋時,藥物的累積釋放量在10 h內就超過了90%,藥物的釋放速率較快,易造成浪費,且對人體傷害較大;而未光交聯的1.0%載藥PVA-SBQ/GMHA纖維膜,在10 h內的累積釋放率在64%,之后釋放速率減緩,持續釋放至36 h,累積釋放量為72%;光交聯的1.0%載藥PVA-SBQ/GMHA纖維膜,在10 h內的累積釋放率在46%,緩慢釋放至72 h,累積釋放量為68%,由于纖維表面藥物的殘留和部分纖維的溶解與溶脹導致前10 h的釋放速度較快,之后藥物的釋放以纖維膜降解為主[28]。對比3條曲線,PVA-SBQ/GMHA纖維膜載藥釋放速率相較于裸釋有所減緩,而光交聯之后的纖維膜緩釋效果更為明顯。
圖9a)是PVA-SBQ/GMHA纖維膜在不同溫度下的藥物釋放曲線,隨著環境溫度的升高藥物的釋放速度與累積釋放率均有所下降。藥物的釋放過程受纖維溶脹和溶解的影響,圖9b)是PVA-SBQ/GMHA纖維膜在不同pH值下的藥物累積釋放曲線。
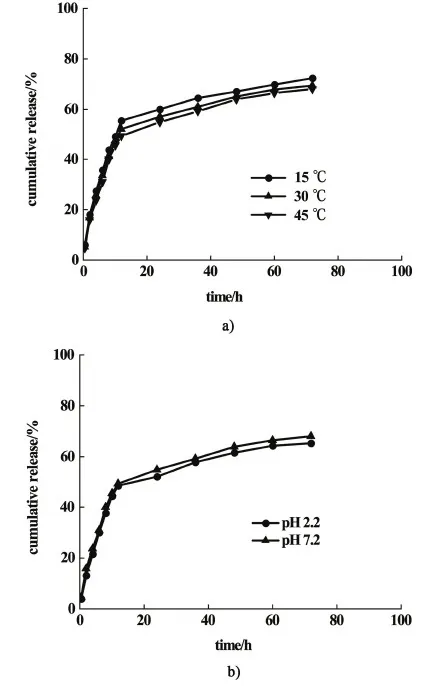
圖9 a)PVA-SBQ/GMHA纖維膜在不同溫度、b)不同pH值下的藥物釋放曲線Fig.9 Drug release curve of PVA-SBQ/GMHA fiber membrane under different a) temperatures and b) pH
由圖9a)可知,纖維膜的溶脹比隨溫度的升高而降低,因此藥物的釋放速度與累積釋放率降低。由圖9b)可知,在pH值為2.2時藥物的釋放速度與累積釋放率比pH值為7.2時略低,這是因為纖維膜在pH值為2.2時的溶脹比小于在pH值為7.2時的溶脹比[30]。
3 結論
采用靜電紡制備了PVA-SBQ/GMHA復合納米纖維,在紫外光照射下得到光交聯復合納米纖維膜。通過SEM研究了紫外光照不同時間下復合納米纖維溶脹前后的形貌,光照1.0 h效果最佳。PVA-SBQ/GMHA纖維膜的溶脹比隨著溫度增加而降低,pH值為2.2時溶脹度比pH值為7.2時小。相對于藥物裸釋和未交聯纖維膜,光交聯的載藥PVA-SBQ/GMHA纖維膜藥物釋放相對平緩,在10 h內的累積釋放率大約40%。累積釋放率隨著溫度升高而降低,pH值為2.2時小于pH值為7.2時的累積釋放率,這和PVA-SBQ/GMHA纖維膜溶脹比的變化規律相一致。

