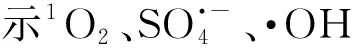Cu2(NO3)(OH)3催化過硫酸鹽降解苯酚
王祥名,吳松海*,王 琮,李 蕊,孫世瑋,孟子賀,韓 煦,2*
(1.天津大學化工學院,天津 300350; 2.天津大學環境科學與工程學院,天津 300350)
苯酚(phenol)是一種對生物有強烈毒性的有機污染物[1]。化學工業排放的廢水往往包括較高含量的酚類物質[2]。廢水中苯酚的自然降解速度非常緩慢,10 mg·L-1的苯酚廢水在pH值為 7.0和10 ℃條件下經自然降解5 d后僅能去除75%[3]。在中國,飲用水中苯酚的最高允許濃度為0.002 mg·L-1(GJ94-1999)。到目前為止,物理方法(萃取[4]、吸附[5-6]和液膜法[7])、生化方法(酶處理技術[8])、活性污泥法[9]和化學方法(電解[10]和氧化[1])已經被用于降解工業廢水中的苯酚污染物。
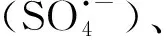
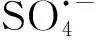
近年來,以過硫酸鹽為基礎的AOPs處理酚類廢水吸引了越來越多的研究興趣。Lin等[27]研究表明,在pH值為 3.0、7.0和11.0的條件下,通過UV活化過硫酸鹽能有效降解0.5 mmol L-1苯酚而且沒有二次污染,k值可達0.14~0.16 min-1。Lei等[28]合成了一種CuO-Fe3O4催化劑用于激活過硫酸鹽降解苯酚。在這個體系中,pH值為11.0時反應2 h可使9.4 mg·L-1苯酚完全礦化而不會產生二次污染。此外,他們還發現體系中的主要活性物種是被吸附在催化劑上的硫酸根自由基以及催化劑表面的Cu(Ⅱ)在活化過硫酸鹽后形成的Cu(Ⅲ)[28]。
Cu2(NO3)(OH)3(銅硝石)是一種存在于大自然中的含銅礦石,一般分為2種晶系(正交晶系和單斜晶系)[29]。先前已有研究將層狀的Cu2(NO3)(OH)3用于催化過氧化氫降解偶氮染料[30]。Zhan等[30]使用Cu2(NO3)(OH)3在pH值為 3.4~9.4條件下催化過氧化氫降解直接藍15,反應30 min后降解率可以達到80%左右。相比于H2O2和過一硫酸鹽,過硫酸鹽具有化學穩定性高,運輸、儲存方便,成本低等優點。同時,非均相催化活化過硫酸鹽的反應也更加經濟、環保。Cu2(NO3)(OH)3已被用于催化H2O2降解有機污染物,但對活化過硫酸鹽的研究尚未見報道。因此,本研究將主要探討過硫酸鹽和Cu2(NO3)(OH)3體系降解苯酚的效率和機理。
1 實驗部分
1.1 實驗試劑與儀器
實驗所用試劑詳見表1,所有試劑均為分析純,阿拉丁化學試劑有限公司生產。實驗所用儀器詳見表2。
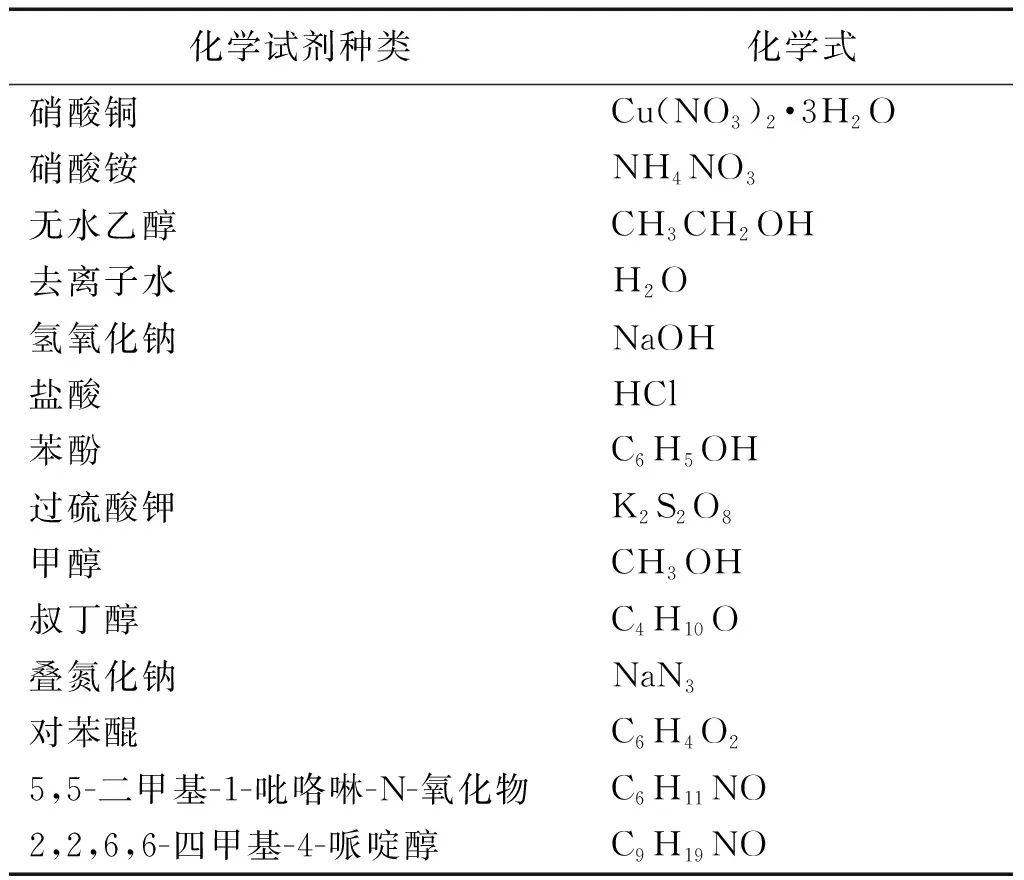
表1 實驗試劑一覽表Table 1 Chemical reagents used in the experiments
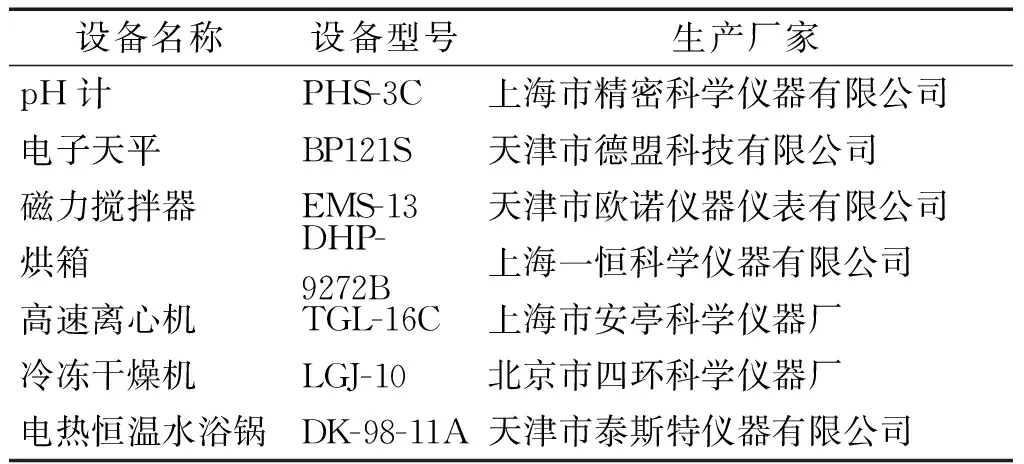
表2 實驗儀器一覽表Table 2 Apparatus used in the experiments
1.2 Cu2(NO3)(OH)3的制備
采用溶劑熱法合成催化劑Cu2(NO3)(OH)3[30]。將4.8 g三水合硝酸銅和0.8 g硝酸銨緩慢加入60 mL的無水乙醇中,攪拌30 min。然后將攪拌后的懸浮液轉移到1個100 mL水熱釜中,在150 ℃下反應48 h。反應后得到的產物分別用經氮氣除氧后的去離子水(3次)和無水乙醇(3次)洗滌,然后將產物收集放入真空烘箱中,保持在80 ℃下烘干8 h。制備好的樣品在經過研磨后儲存在厭氧手套箱中。
1.3 苯酚降解實驗
苯酚降解反應借助250 mL錐形瓶進行。將250 mg的Cu2(NO3)(OH)3和一定量的去離子水加入錐形瓶中,用1.0 mol·L-1NaOH或HCl溶液來調節pH值到反應需要的pH值。然后將一定體積具有相同pH值的過硫酸鹽溶液和苯酚溶液先后加入到錐形瓶內,攪拌均勻。錐形瓶被放置在1個設定溫度為25 ℃,避光的恒溫搖床中。搖床的轉速設定為150 r/min。苯酚溶液加入的時間被設定為反應的起點,定時取樣,取出的樣品以7 000 r/min的速度離心3 min后取上清液。檢測苯酚濃度及過硫酸鹽含量;同時按照相同的實驗條件,Cu2(NO3)(OH)3或過硫酸鹽單獨存在的對照組被用來明確體系對苯酚的氧化作用。所有反應均進行平行實驗。最適宜的反應條件通過測試不同pH值、過硫酸鹽用量和苯酚初始濃度來確定。
1.4 Cu2(NO3)(OH)3的表征及分析方法
2 結果與討論
2.1 催化劑的表征
采用XRD分析了所制備Cu2(NO3)(OH)3的晶體結構。從圖1上可以看出Cu2(NO3)(OH)3的主峰在2θ=5°~45°之間,與Cu2(NO3)(OH)3標準卡片(JCPDS, No.45-0594)一致,這說明我們成功合成了Cu2(NO3)(OH)3晶體。晶體的峰型較為尖銳,這表明合成的產物純度較高,結晶度較好(圖1)。其中,2θ=6.4°和12.8°這2個衍射角分別對應了Cu2(NO3)(OH)3晶格內的(001)和(002)晶面。SEM分析(圖2)進一步表明,合成的Cu2(NO3)(OH)3形貌主要有顆粒狀和片狀2種,顆狀形貌的直徑范圍主要是5~20 μm,片狀形貌的長度約為10 μm,與文獻報道的基本相同[30]。從樣品的FT-IR圖可以看出,催化劑在3 300~3 600 cm-1處表現出了較寬的吸收峰,這是明顯的羥基吸收峰(圖3),其中3 544 cm-1處的吸收峰為樣品結晶水中的羥基吸收峰;3 431 cm-1處的吸收峰為Cu2(NO3)(OH)3與羥基形成氫鍵后的特征峰(圖3)[32];880、775和674 cm-1為Cu—O—H鍵的特征峰;1 047、814和1 418 cm-1為NO3的特征吸收峰;2 342 cm-1處為CO2的特征峰(圖3)[33]。
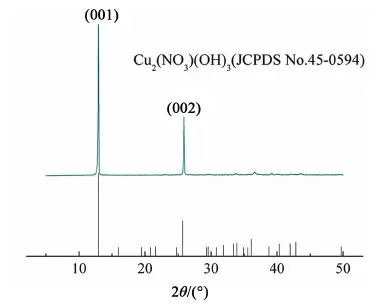
圖1 Cu2(NO3)(OH)3的XRD分析圖Fig.1 X-Ray powder diffraction patterns of Cu2(NO3)(OH)3

圖2 Cu2(NO3)(OH)3的掃描電子顯微鏡分析圖Fig.2 SEM analysis of the synthesized Cu2(NO3)(OH)3
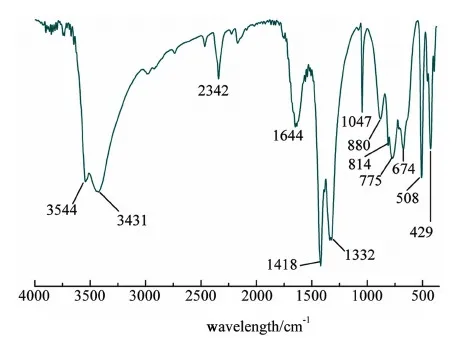
圖3 Cu2(NO3)(OH)3的傅里葉紅外光譜圖Fig.3 FT-IR spectra of Cu2(NO3)(OH)3
2.2 苯酚降解的動力學研究
為了確定Cu2(NO3)(OH)3/過硫酸鹽體系降解苯酚的動力學參數,利用式(1)對實驗數據進行了準一級動力學擬合。
ln(C/C0)=-kt
(1)
k代表苯酚氧化準一級動力學常數,min-1;C和C0各自代表苯酚在反應的t時刻和初始時的濃度,擬合后的準一級動力學常數見表3。并且對照試驗發現,只有在Cu2(NO3)(OH)3和過硫酸鹽共存時才會觀察到較高的苯酚降解效率,缺少其一都不會發現苯酚的降解或者被吸附(見圖4)。
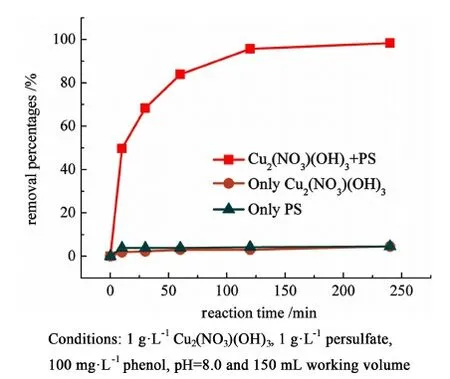
圖4 苯酚降解對照試驗Fig.4 Control experiment in the degradation of phenol
2.3 不同pH值對Cu2(NO3)(OH)3催化過硫酸鹽降解苯酚的影響
調整苯酚溶液的初始pH值從 2.0到12.0來研究pH值對降解速率的影響。反應的準一級動力學常數,列于表3中。
從圖5可以看出,在pH值為 8.0時, 苯酚降解效率最好,此時的反應速率常數為3.11×10-2min-1(表3)。然而,當pH值大于10.0或小于5.0時,反應速率均有明顯的下降。
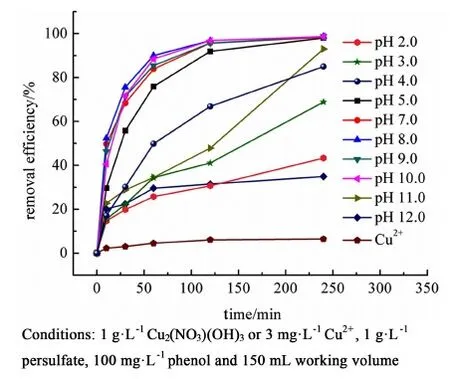
圖5 不同pH值條件下苯酚降解效率及pH 值為8.0時Cu2+活化過硫酸鹽降解苯酚Fig.5 The removal efficiency of phenol under different pHs and the activation of persulfate by Cu2+ at pH 8.0 on the removal efficiency of phenol
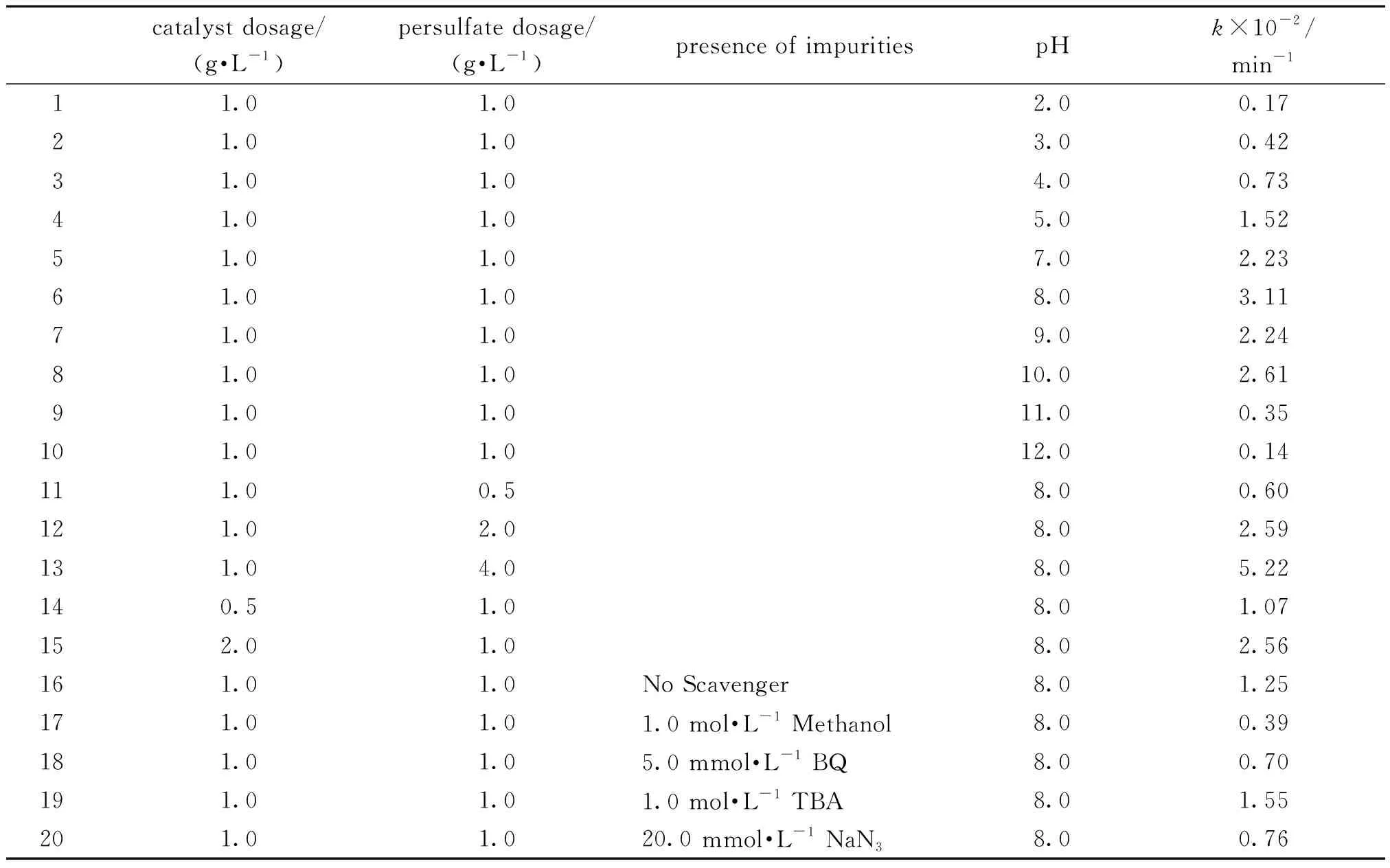
表3 過硫酸鹽和Cu2(NO3)(OH)3催化的苯酚氧化反應速率常數Table 3 Reaction rate constants in the phenol oxidation by persulfate and Cu2(NO3)(OH)3
2.4 不同過硫酸鹽用量對苯酚降解的影響
在pH 值為8.0條件下,調整過硫酸鹽用量從0.5~4.0 g·L-1來研究其對苯酚降解過程的影響(圖6,表3)。反應的準一級動力學常數列于表3中。
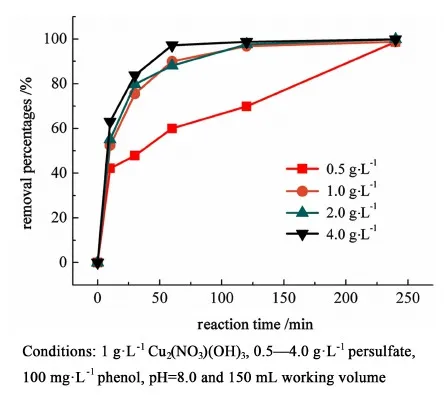
圖6 不同PS濃度條件下苯酚降解效率Fig.6 The removal efficiency of phenol at different concentrations of persulfate
從圖6可以看出,在過硫酸鹽濃度達到1.0 g·L-1時,反應進行徹底。繼續加大過硫酸鹽用量對于反應速率的提升不大。
2.5 不同催化劑用量對Cu2(NO3)(OH)3催化過硫酸鹽降解苯酚的影響
在pH值為 8.0, 過硫酸鹽用量為1.0 g·L-1條件下,本研究考察了Cu2(NO3)(OH)3用量對苯酚降解速率的影響。反應的準一級動力學常數列于表3中。
從圖7可以看出,當Cu2(NO3)(OH)3用量為1.0 g·L-1時,苯酚降解效率最佳。
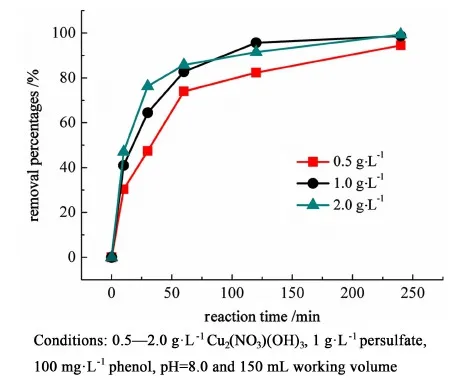
圖7 不同催化劑濃度條件下苯酚降解效率Fig.7 The removal efficiency of phenol at different dosage of Cu2(NO3)(OH)3
2.6 Cu2(NO3)(OH)3催化過硫酸鹽降解苯酚的穩定性實驗
非均相反應可以實現催化劑的回收利用以及減少二次污染。因此,我們通過多次使用Cu2(NO3)(OH)3進行降解苯酚的實驗對其進行了重復利用測試。在經過5次循環后,Cu2(NO3)(OH)3仍然保持了約90%的苯酚降解效率(圖8)。這表明催化劑有著良好的穩定性以及重復利用性能。我們也通過ICP-AES檢測反應后溶液中的Cu2+析出量。結果發現,在pH值為8.0下反應4 h后,溶液中的Cu2+析出量約為3.0 mg·L-1。并且,我們向同樣的過硫酸鹽/苯酚體系中同樣加入3.0 mg·L-1的Cu2+進行實驗,反應4 h后沒有發現明顯的苯酚氧化(圖5)。因此,可以證明Cu2(NO3)(OH)3具有良好的重復利用性以及析出的Cu2+對于過硫酸鹽的激活在本研究中沒有起明顯的作用。
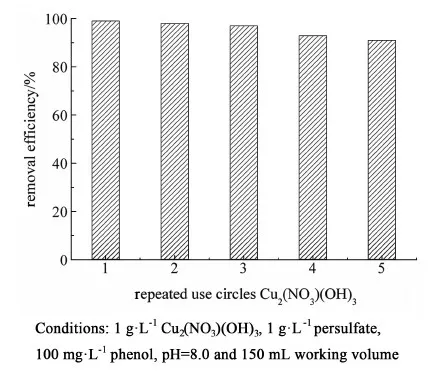
圖8 Cu2(NO3)(OH)3降解苯酚的循環實驗Fig.8 The repeated cycles of Cu2(NO3)(OH)3 in the degradation of phenol
2.7 Cu2(NO3)(OH)3催化過硫酸鹽降解苯酚過程中的TOC變化
我們通過測定溶液中TOC的變化來確定苯酚降解過程中是否產生二次污染。反應條件為:pH值為8.0,苯酚初始濃度為100 mg·L-1,1 g·L-1的Cu2(NO3)(OH)3和過硫酸鹽。反應開始前,苯酚溶液的TOC含量為79.3 mg·L-1。隨后我們在10、30、60、120以及240 min時分別取樣測定TOC變化。結果顯示,溶液的TOC含量逐漸下降,依次為45.1、23.9、11.6、3.9和2.2 mg·L-1。同時,我們根據HPLC法測得反應過程中的苯酚濃度依據式(2)計算此時溶液TOC值。m碳表示碳元素相對分子質量,m苯酚表示苯酚相對分子質量,C苯酚表示取樣時苯酚濃度(mg·L-1)。經過計算,TOC值分別為35.1、15.9、7.2、1.9和0.3 mg·L-1,該數值與儀器測得TOC值基本吻合,說明降解過程中苯酚完全轉化為CO2與H2O,沒有生成其它小分子造成二次污染。
(2)
2.8 Cu2(NO3)(OH)3催化過硫酸鹽降解苯酚過程中的自由基淬滅實驗
為了明確苯酚氧化降解過程中,不同活性物種的貢獻,我們在pH值為 8.0條件下進行了淬滅劑實驗(圖9)。
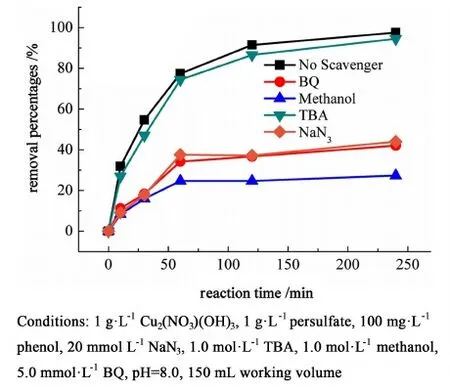
圖9 不同淬滅劑存在下苯酚降解效率Fig.9 The removal efficiency of phenol in the presence of various scavengers
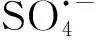
2.9 EPR表征
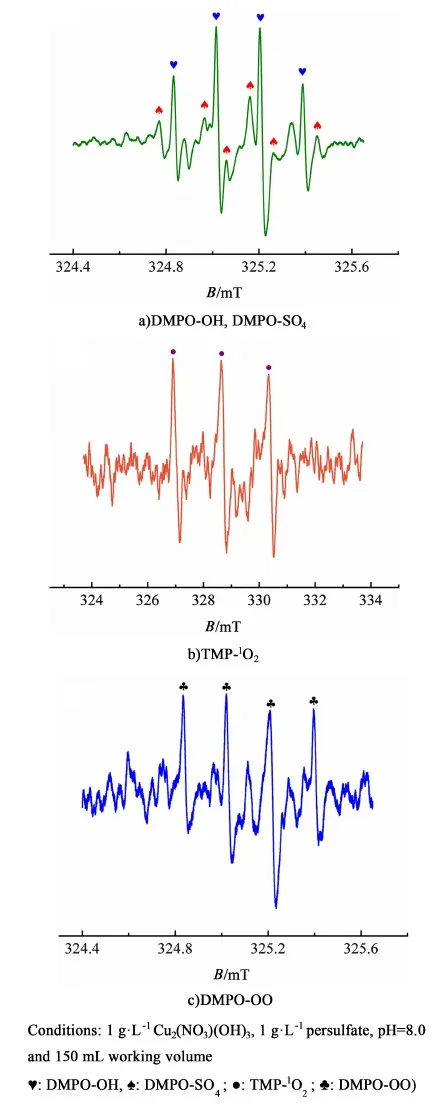
圖10 Cu2(NO3)(OH)3-過硫酸鹽體系的EPR譜, a)DMPO-OH, DMPO-SO4, b)TMP-1O2和 c)DMPO-OOFig.10 EPR spectra of a) DMPO-OH, DMPO-SO4, b)TMP-1O2 and c)DMPO-OO for Cu2(NO3)(OH)3-persulfate system in the presence of DMPO or TMP
2.10 機理分析
(3)
Cu3++OH-→·OH+Cu2+
(4)
(5)
(6)
(7)
(8)
(9)
3 結論