LRRK2、PPBP基因在非小細胞肺癌組織中的表達及其與預后的相關性分析
楊凱,楊明,蘇學會,溫輝,單娜,牛春密
(1.秦皇島市第二醫院呼吸科;2.秦皇島市第一醫院呼吸科,河北 秦皇島 066000)
原發性肺癌是全世界發病率和死亡率最高的惡性腫瘤之一,占癌癥相關死亡人數的18%,經相關文獻[1]預測,至2025年,我國每年肺癌發病率將超過100萬,成為世界第一肺癌大國。隨著各種綜合治療手段的持續更新,肺癌的臨床治療效果較以往有所提升,但總體預后仍欠佳,5年生存率僅10%左右[2]。非小細胞肺癌(non-small cell lung cancer,NSCLC)是肺癌最常見的病理形態,約占80%,其腫瘤標志物有糖類抗原125、鱗狀上皮細胞癌抗原、癌胚抗原等,但仍有99%的腫瘤標志物未得到完整的臨床驗證,并且目前還未有研究報道過任何一種敏感性和特異性均很高的肺癌腫瘤標志物[3]。進一步篩選出靈敏度和特異性高的新型標志物,可快速檢測出患者的病理狀態,為及早治療、治愈奠定基礎,提高患者的生存率和生存質量,以達到降低肺癌病死率的最終目標。本研究通過本院臨床病理資料的回顧性分析,以期找到1~2個NSCLC的新型預后標志物,為臨床上肺癌的診斷和治療提供較精準的依據。
1 資料與方法
1.1 一般資料
收集秦皇島市第二醫院100例NSCLC臨床樣本數據。納入標準:(1)參照NSCLC的相關診斷標準[4];(2)首次確診;(3)經X線、細胞學或組織病理學證實為NSCLC;(4)預計生存時間>3個月;(5)入院前未接受過相關治療;(6)無其他重要臟器功能障礙。排除標準:(1)合并腦轉移;(2)病灶無法測量者;(3)妊娠期或哺乳期女性;(4)先前有或繼發性惡性腫瘤;(5)曾接受過免疫治療或放化療;(6)有精神病史;(7)合并血液系統疾病。所有患者中,男性53例,女性47例;年齡31~75歲,平均(58.94±12.06)歲;病理類型:肺腺癌64例,肺鱗癌36例;腫瘤結轉移分類(tumor node metastasis classification,TNM分期):Ⅰ期12例,Ⅱ期15例,Ⅲ期42例,Ⅳ期31例;淋巴結轉移:無28例,有72例。本研究獲得病人及家屬知情同意,且符合《世界醫學協會赫爾辛基宣言》相關要求。
1.2 方法
1.2.1 標本采集及處理 獲取每例病人的正常癌旁組織及癌組織標本,經石蠟包埋、切片(厚度<5 mm,長度<10 mm)、固定、漂洗、脫水、透明、透蠟、包埋、整修、切片(厚度4 mm)。
1.2.2 固定化蛋白質印跡法 分別用RIPA組織裂解液裂解癌旁組織和癌組織,提取組織總蛋白,使用蛋白定量試劑盒檢測組織提取液的蛋白濃度,每例標本取50 μg蛋白進行電泳,經10%聚丙烯凝膠電泳分離后,電轉移至聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜上,封閉后,加一抗(兔抗人LRRK2多克隆抗體,英國Abcam公司;兔抗人PPBP多克隆抗體,臺灣abnova公司)二抗(辣根過氧化物酶結合羊抗兔多克隆抗體)進行雜交,ECL化學發光試劑盒(由上海貝博生物科技公司提供)檢測雜交信號,發光顯影于感光膠片上。
1.2.3 免疫組織化學法 待檢組織切片置于30 ℃恒溫箱中烤20 min或在室溫下放置1 h,二甲苯中浸泡10 min,更換1次二甲苯再浸泡10 min,磷酸鹽緩沖溶液(phosphate buffer salin,PBS)沖洗3次,5 min/次,3% H2O2(80%甲醇)滴在組織芯片(tissue microarray,TMA)上,室溫下靜置10 min,PBS沖洗3次,5 min/次,在水浴鍋中加入枸櫞酸鈉緩沖液(pH=6.0),加熱到95 ℃時放入切片,再加熱12 min左右,PBS沖洗3次,5 min/次,滴加山羊血清封閉液進行封閉,室溫靜置20 min后甩去多余液體;按檢測目的蛋白的不同,在不同切片分別滴加各類山羊抗兔一抗50 μL,室溫靜置1 h,或4 ℃過夜;加入PBS替代一抗作為陰性對照,陽性對照選取預實驗中的陽性切片;檢測時需在37 ℃復溫45 min;PBS沖洗3次,2 min/次;滴加抗山羊生物素標記二抗45~50 μL,室溫靜置1 h;二抗中加入0.05% tween-20以增加細胞通透性;PBS沖洗3次,5 min/次;在顯微鏡下操作,二氨基聯苯胺(3,3’-diaminobenzidine,DAB)顯色5~10 min;PBS或自來水流動沖洗10 min;蘇木精-伊紅染色法(hematoxylin-eosin staining,HE染色)復染2 min;鹽酸酒精分化、氨水反藍15 s;流動自來水沖洗10~15 min;脫水、透明后,中性樹膠封片待檢、保存;顯微鏡下觀察,拍照。
1.3 收集臨床資料及條帶測定
收集患者的年齡、性別、腫瘤直徑、TNM分期、病理類型、淋巴結轉移、分化程度、術后生存狀態等。條帶測定:應用SLICPS2000型裂隙燈圖像分析測定條帶吸光度(optical density,OD),以OD值表示LRRK2、PPBP蛋白的相對表達量,以此來反映兩個蛋白的表達差異。
1.4 統計學分析
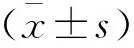
2 結果
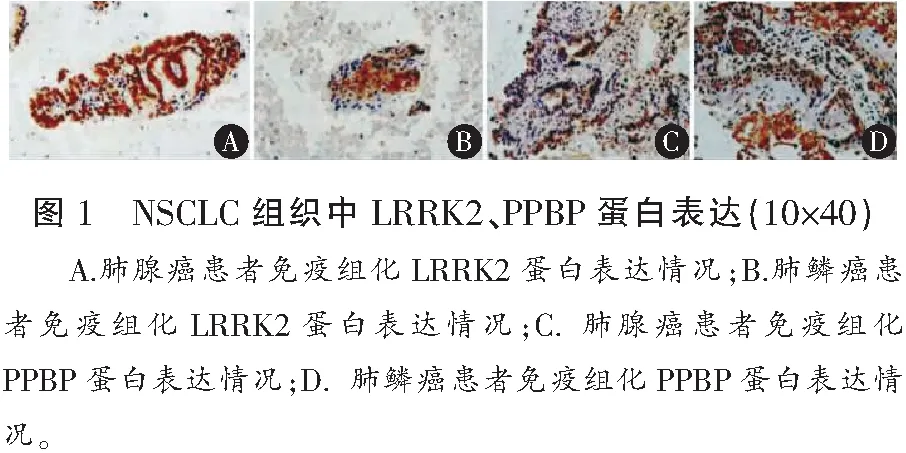
2.1 NSCLC組織與癌旁組織中LRRK2、PPBP蛋白的表達
NSCLC組織中LRRK2蛋白低于癌旁組織(P<0.05),PPBP蛋白的相對表達量均高于癌旁組織(P<0.05)。見表1、圖1。
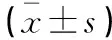
表1 NSCLC組織與癌旁組織中LRRK2、PPBP蛋白的表達差異
2.2 LRRK2蛋白表達與NSCLC患者臨床病理特征的關系
LRRK2蛋白在不同分化程度及不同TNM分期NSCLC癌組織中的相對表達量差異有統計學意義(P<0.05),而LRRK2蛋白在癌組織中的表達量與NSCLC患者腫瘤直徑、病理類型、淋巴結轉移無關(P>0.05)。見表2。
2.3 PPBP蛋白表達與NSCLC患者臨床病理特征的關系
PPBP蛋白在是否淋巴結轉移及不同TNM分期NSCLC患者癌組織中的相對表達量差異有統計學意義(P<0.05),而LRRK2蛋白在癌組織中的表達量與NSCLC患者腫瘤直徑、病理類型、分化程度無關(P>0.05)。見表3。
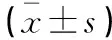
表2 LRRK2蛋白表達與NSCLC患者臨床病理特征的關系
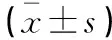
表3 PPBP蛋白表達與NSCLC患者臨床病理特征的關系
2.4 影響NSCLC患者預后的多因素Cox回歸分析
隨訪1年,1年生存率為84.00%(84/100),以患者預后為因變量,年齡、性別、腫瘤直徑、病理類型、淋巴結轉移、分化程度、TNM分期、LRRK2、PPBP蛋白為自變量,進行多因素Cox回歸分析。結果顯示,TNM分期(OR=2.855)、LRRK2(OR=0.217)、PPBP蛋白(OR=2.812)是影響NSCLC患者預后的獨立危險因素(P<0.05)。見表4。

表4 影響NSCLC患者預后的多因素Cox回歸分析
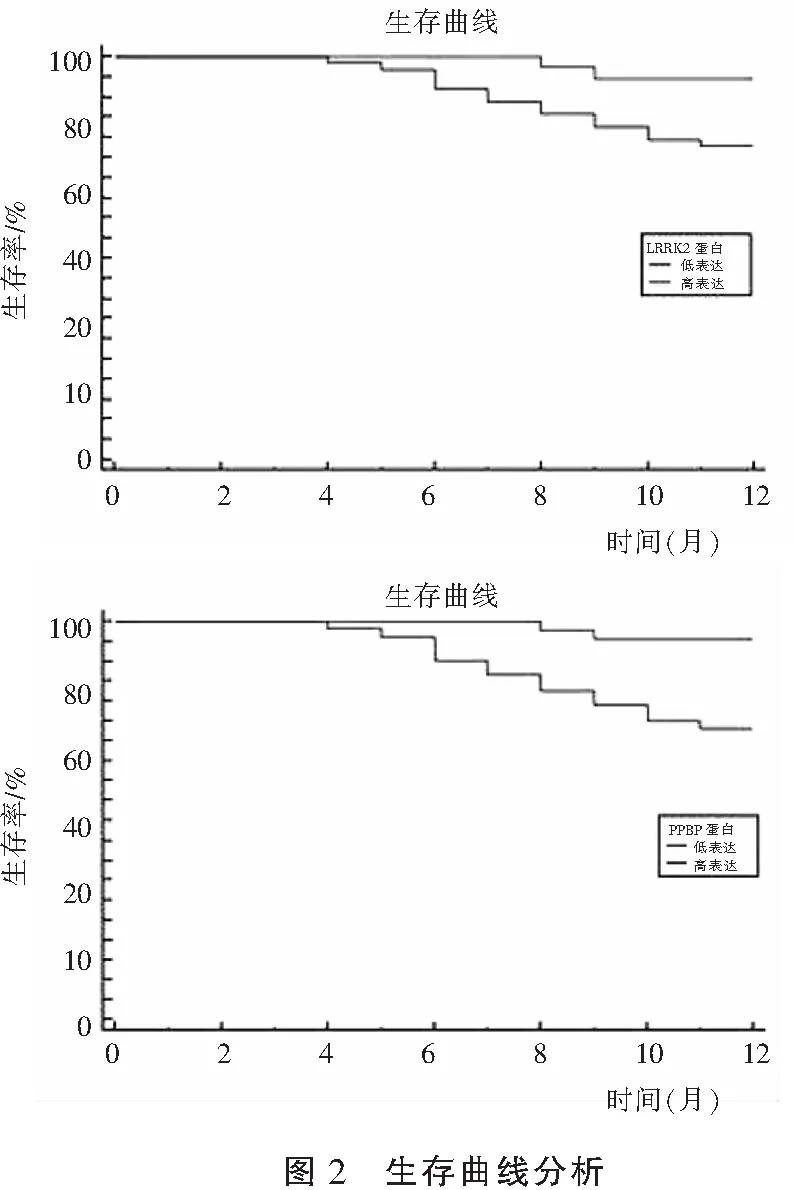
2.5 LRRK2、PPBP蛋白表達量與NSCLC患者1年生存率的關系
生存分析顯示,LRRK2低表達組1年的生存率高于LRRK2高表達組(χ2=4.848,P=0.028),PPBP高表達組1年的生存率高于PPBP低表達組(χ2=9.641,P=0.002)。見圖2。
3 討論
自人類全基因組計劃開始以來,利用基因技術尋找疾病發展中的生物標記物得到了快速發展和普及[5]。研究的生物數據主要包括基因組學數據、轉錄組學數據、蛋白組學數據、表觀基因組學數據、代謝組學數據[6]。這些數據為研究工作帶來了極大的便利,它們主要儲存于數據庫:癌癥基因組圖譜(the cancer genome atlas,TCGA)和人類腫瘤相關的基因表達匯編(gene expression omnibus,GEO)[7]。通過TCGA計劃,已經成功繪制了卵巢癌、結直腸癌、膠質母細胞瘤等癌癥的特定基因組變化圖譜[8-9]。本研究通過分析120例臨床樣本數據,發現肺癌病人癌旁組織與腫瘤組織中表達具有顯著差異的14個基因,分別為IL6、COL1A1、GNG11、LRRK2、TOP2A、CDH5、CXCR2、CAV1、PPBP、TIMP1、CD36、THBS2、CXCL2和MMP1。其中,NSCLC組織中LRRK2蛋白低于癌旁組織,而PPBP蛋白的相對表達量均高于癌旁組織,LRRK2蛋白在不同分化程度、PPBP蛋白在是否淋巴結轉移、及兩者在不同TNM分期NSCLC患者癌組織中的相對表達量、均具有統計學差異。故本研究著重探討LRRK2、PPBP兩個基因的差異表達對NSCLC患者預后的影響。
Lebovitz等[10]證實NSCLC肺癌中調節自噬的基因組和轉錄組改變的基因表達顯著減少,且一組肺癌細胞系中LRRK2蛋白的表達也減少或缺失,但LRRK2在癌癥中的的病理作用及其對自噬狀態和致瘤性的影響尚未深入研究[11]。LRRK2激酶結構域可以刺激帕金森病細胞系的自噬,并且眾多腫瘤是利用提高的自噬能力來維持代謝壓力和化療[12]。因此,探討肺癌中致病性LRRK2介導的自噬作用,可為使用自噬抑制劑治療肺癌的臨床策略提供一定的參考[13]。本研究顯示LRRK2蛋白低表達或缺失可能影響NSCLC患者預后。
PPBP屬于CXC趨化因子亞家族,能有效促進血管生成、腫瘤的發生和轉移。PPBP在多種癌癥細胞中表達增高,并且在癌組織中的表達較癌旁組織高,然其具體作用機制尚未清楚[14]。Paola等[15]指出,PPBP能提高對NSCLC患者DNA診斷的準確性,尤其對早期腫瘤的診斷。多數腫瘤可自分泌CXC趨化因子,CACL2、CACL3、CXCL9、CXCL10、CXCL11也已被證實可影響各種腫瘤的發生及發展,NSCLC患者體內多種CXC趨化因子高表達[16-17]。PPBP蛋白同屬于CXC趨化因子亞家族,其高表達可能也會導致NSCLC患者預后不良。
綜上,LRRK2、PPBP基因在非小細胞肺癌組織中明顯高表達,表達量與患者TNM分期、腫瘤分化程度、淋巴結轉移及患者預后有關,但其具體作用機制仍需作進一步的基礎研究。

