超高效液相色譜-串聯質譜法同時測定血漿與尿液中12種脂溶性貝類毒素
林 強, 楊 超, 李美麗, 王 佳, 侯瀚然, 邵 兵, 牛宇敏*
(1.北京市延慶區疾病預防控制中心,北京 102100;2.北京市疾病預防控制中心,北京 100013)
貝類毒素亦稱為藻毒素,由浮游植物自然產生,按照化合物性質主要分為脂溶性和水溶性兩大類[1]。脂溶性貝類毒素主要包括大田軟海綿酸毒素(OA)、鰭澡毒素(DTX)、扇貝類毒素(PTX)和原多甲藻毒素(AZAs)等毒素。相關研究表明,OA和DTX具有腹瀉毒性,PTX具有肝毒性,誤食脂溶性貝類毒素容易引起惡心、嘔吐、腹瀉等癥狀[2-5]。歐洲食品安全局(EFSA)對各類脂溶性貝類毒素及其亞型的食用安全計量、急性中毒劑量和限值都做了明確的規定[6,7],如AZAs、PTX2總最大殘留限量均為160.0 μg/kg,并根據新的毒理學數據將OA和DTXs的限量標準修訂為45 μg/kg。目前我國沒有相關限量標準。脂溶性貝類毒素中毒事件近幾年在我國頻繁出現,2010年9月~2019年5月,香港、澳門、珠海、寧波、福建、秦皇島、唐山等地陸續出現70余起貝類毒素中毒事件[8,9]。
根據相關文獻[10-14]報道,OA類毒素可長期蓄積于腸道等組織內,經組織吸收后主要以原型化合物的形式通過尿和糞便排出。針對生物樣品中毒素的篩查有利于快速準確判斷中毒原因。目前,我國關于脂溶性貝類毒素的檢測標準有GB 5009.212-2016《食品安全國家標準貝類中腹瀉性貝類毒素的測定》,該方法僅規定了貝類樣品中OA、DTX1、DTX2等3種化合物的檢測方法。針對生物樣品中脂溶性貝類毒素的檢測方法[11-14]較少,現有檢測方法主要存在以下兩方面問題:(1)生物樣品中脂溶性貝類毒素以OA、DTX1、DTX2等3種化合物為主,目標化合物種類較少;(2)多采用固相萃取方法處理生物樣品,前處理過程復雜,靈敏度低。為進一步完善突發公共衛生事件應急檢測技術體系,亟須建立生物樣品中脂溶性貝類毒素的檢測方法,為食物中毒等突發公共衛生事件的流行病學調查以及中毒者的臨床救治提供技術支持。
本方法以超高效液相色譜-三重四極桿質譜聯用儀為研究平臺,建立了簡單、準確檢測血漿、尿液中12種脂溶性貝類毒素的方法,可為食物中毒事件的處理提供技術支持。
1 實驗部分
1.1 儀器與試劑
QTRAP 6500+超高效液相色譜-串聯質譜儀(美國SCIEX公司);漩渦混合器(德國IKA公司);冷凍離心機(美國Eppdendorf公司);Milli-Q超純水器(美國Millipore公司)。
乙腈、甲醇(LC-MS級,美國Sigma Aldrich公司);氨水(優級純,美國Merck公司);12種脂溶性貝類毒素標準物質均為溶解于甲醇的單標準溶液(見表1),購買于加拿大國家海洋研究中心,-18 ℃避光保存。
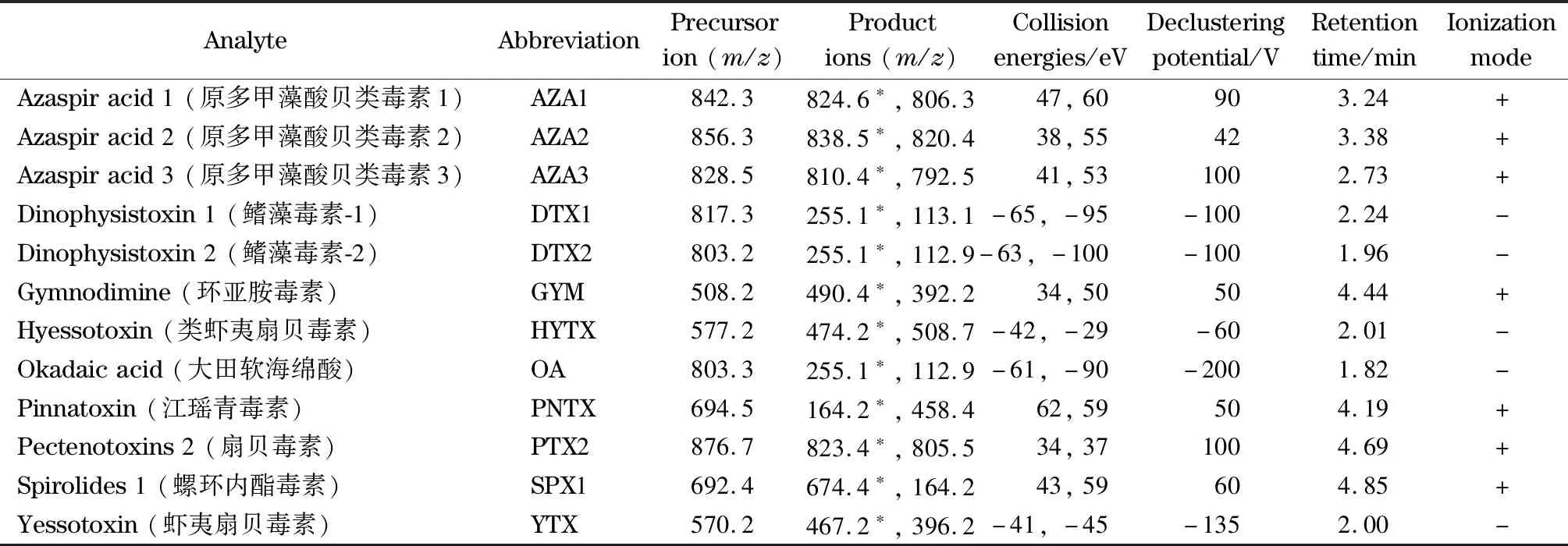
表1 12種脂溶性貝類毒素質譜參數及保留時間Table 1 Mass spectrometric parameters and retention time of the 12 lipophilic shellfish toxins
1.2 溶液的配制
標準儲備液:分別準確稱取1 mL不同濃度標準品,用甲醇稀釋20倍,配制成混合標準儲備液,于4 ℃保存。標準使用液:將混合標準貯備液用初始流動相逐級稀釋成標準使用液,濃度范圍見表2。
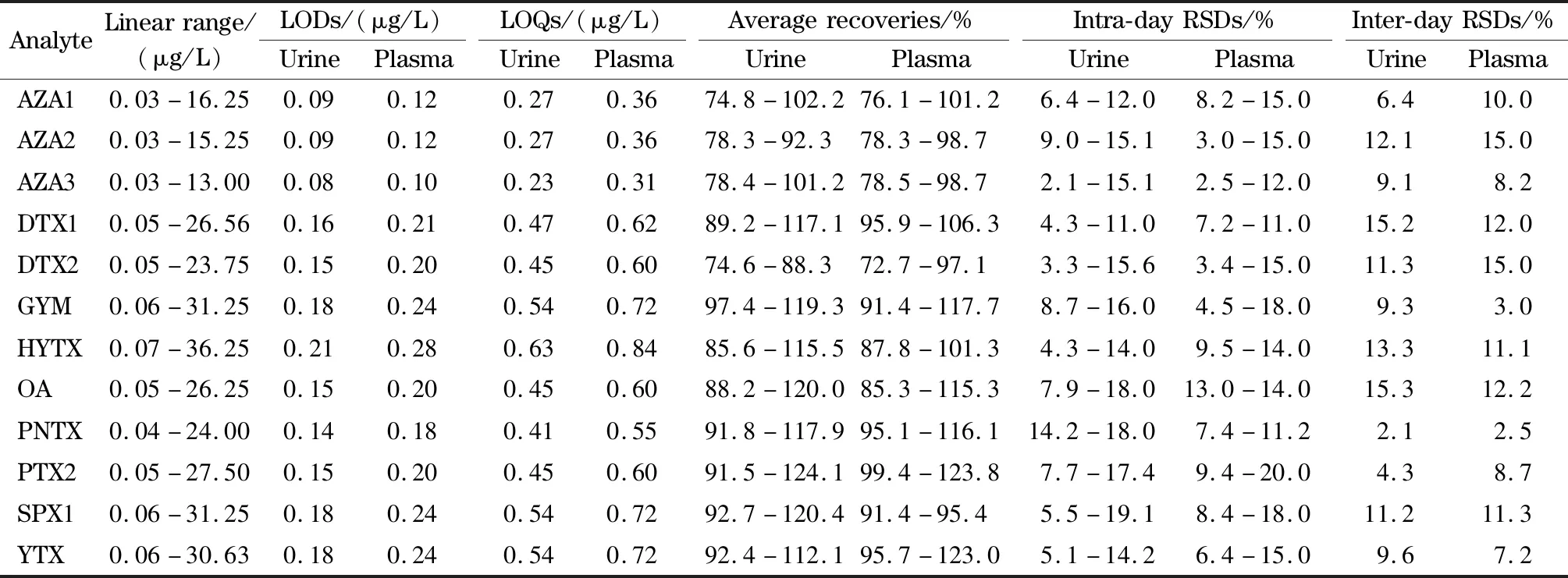
表2 12種脂溶性貝類毒素的檢出限、定量限、加標回收率和相對標準偏差(n=6)Table 2 LODs,LOQs,spiked recoveries,and RSDs of the 12 lipophilic shellfish toxins (n=6)
1.3 樣品的采集
采用便利抽樣招募捐贈者,所有受試者均了解此次研究的目的和意義,受試者簽署同意書。小鼠經腹腔注射12種貝類毒素后收集尿液和血液。尿液樣品使用棕色玻璃樣品瓶收集。血液樣品收集于含有肝素的5 mL采血管中,離心后取上層血漿。尿液和血漿放置于-20 ℃保存。
1.4 樣品前處理
1.4.1尿液樣品的制備
取0.3 mL尿液,加入0.9 mL乙腈后渦旋1 min,以9 000 r/min離心10 min,吸取0.4 mL上清液,加入0.4 mL超純水,渦旋30 s,過0.22 μm有機濾膜后上機檢測。
1.4.2血漿樣品制備
取0.2 mL血漿,加入0.6 mL乙腈后渦旋1 min,以9 000 r/min離心10 min,吸取0.4 mL上清液,加入0.4 mL超純水,渦旋30 s,過0.22 μm有機濾膜后上機檢測。
1.5 儀器條件
1.5.1色譜條件
色譜柱:Phenomenex Kinetex C18(50 mm×3 mm,2.6 μm);流動相:0.05%(v/v)氨水水溶液(A相)-含0.05%(v/v)氨水的90%(v/v)乙腈水溶液(B相)。梯度淋洗程序:0~0.50 min,70%A;0.50~4.00 min,10%A;4.00~5.50 min,10%A;5.50~5.60 min,70%A;5.60~6.10 min,70%A。流速:0.40 mL/min;柱溫:35 ℃;進樣量:5 μL。
1.5.2質譜條件
電噴霧離子源;正負離子掃描模式;多反應監測(MRM)模式采集。噴霧電壓:±4 500 V,離子源溫度:550 ℃,碰撞氣壓力:Medium;氣簾氣壓力:0.21 MPa(30 psi);霧化氣壓力GS1和輔助加熱器壓力GS2:0.38 MPa (55 psi)。其他質譜參數見表1。MRM圖譜見圖1。
2 結果與討論
2.1 UPLC-MS/MS條件的優化
目前檢測脂溶性貝類毒素的流動相體系主要有酸性體系和堿性體系兩種[2]。在酸性條件下(流動相A為0.1%(v/v)甲酸+2 mmoL/L甲酸銨溶液,流動相B為0.1%(v/v)甲酸乙腈溶液),YTX、HYTX的峰形出現拖尾,響應較低(見圖2a)。在堿性條件下(流動相A為0.1%(v/v)氨水,流動相B為90%(v/v)乙腈+0.1%(v/v)氨水),ESI-靈敏度提高,YTX、HYTX拖尾現象明顯改善,響應值提高4倍(見圖2b)。
進一步比較了流動相中氨水的體積分數(0.02%、0.05%、0.1%)對化合物響應值的影響。當流動相中含0.05%(v/v)氨水時,除PTX2外,其余化合物的響應值最大。最終,選擇流動相A為0.05%(v/v)氨水,流動相B為含0.05%(v/v)氨水的90%(v/v)乙腈水溶液。
2.2 樣品前處理條件的優化
對于生物樣本,乙腈是最常用的提取溶劑。本研究考察了不同體積(0.2、0.4、0.6、0.8、1.0 mL)的乙腈對血漿樣品中12種貝類毒素的提取效果,結果如圖3所示。0.2 mL和0.4 mL的乙腈提取效率較低,為30%~69%;當乙腈提取液的體積升高至0.6 mL時,提取效率為78%~121%;乙腈體積繼續升高,提取效率沒有進一步改善。因此,最終確定乙腈提取液的體積為0.6 mL。
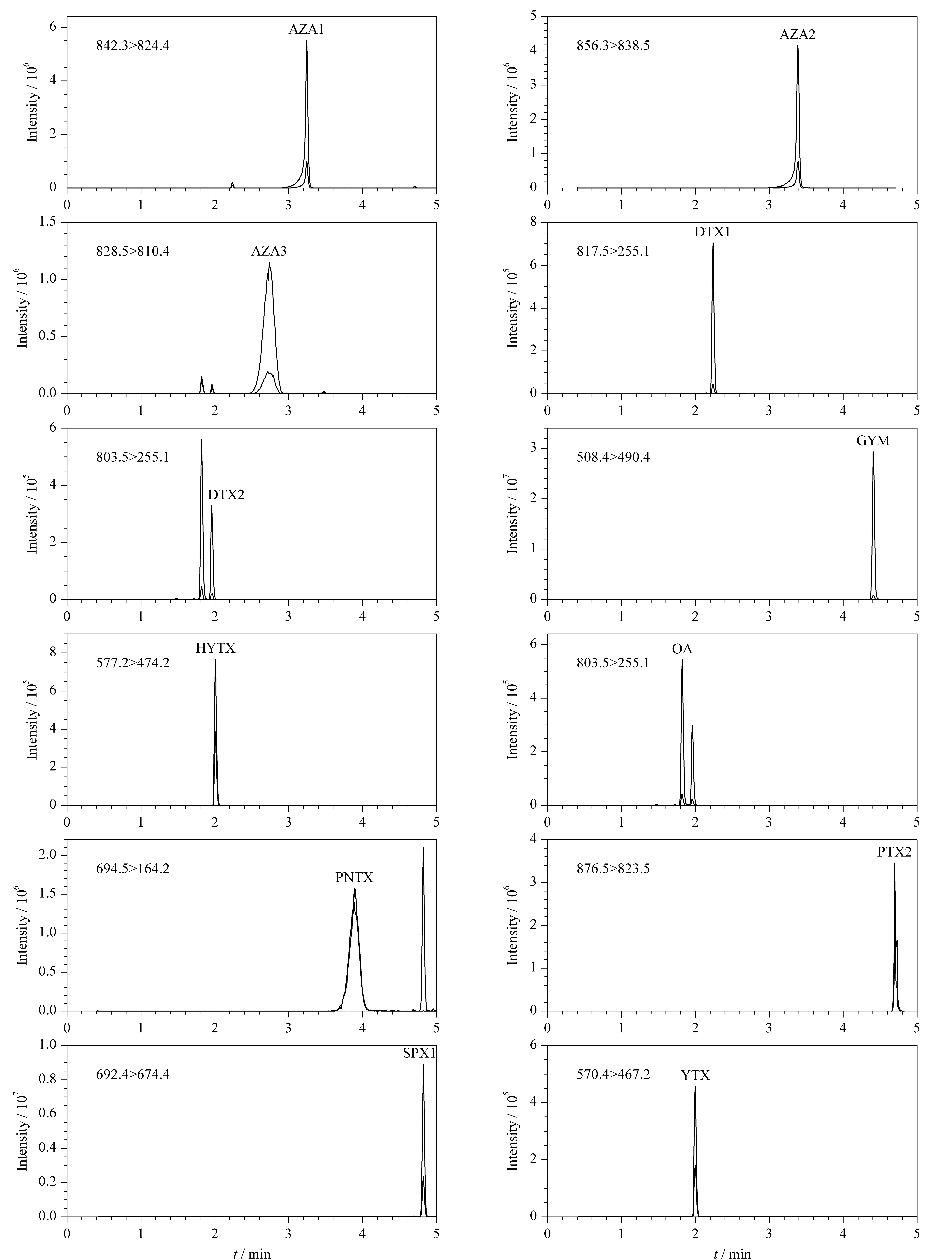
圖 1 血漿加標(1.0 μg/L)樣品中12種脂溶性貝類毒素的MRM譜圖Fig.1 MRM spectra of the 12 lipophilic shellfish toxins in spiked plasma samples (1.0 μg/L)
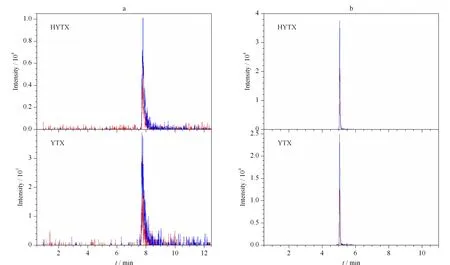
圖 2 不同流動相體系中YTX(0.23 μg/L)和HYTX(0.30 μg/L)的總離子流圖Fig.2 Total ion chromatograms of YTX (0.23 μg/L)and HYTX (0.30 μg/L) with different mobile phasesMobile phases:a.water with 0.1% (v/v) formic acid and 2 mmoL/L ammonium formate (A) and acetonitrile with 0.1% (v/v) formic acid (B);b.water with 0.1% (v/v) ammonia (A) and 90% (v/v) acetonitrile solution with 0.1% (v/v) ammonia (B).
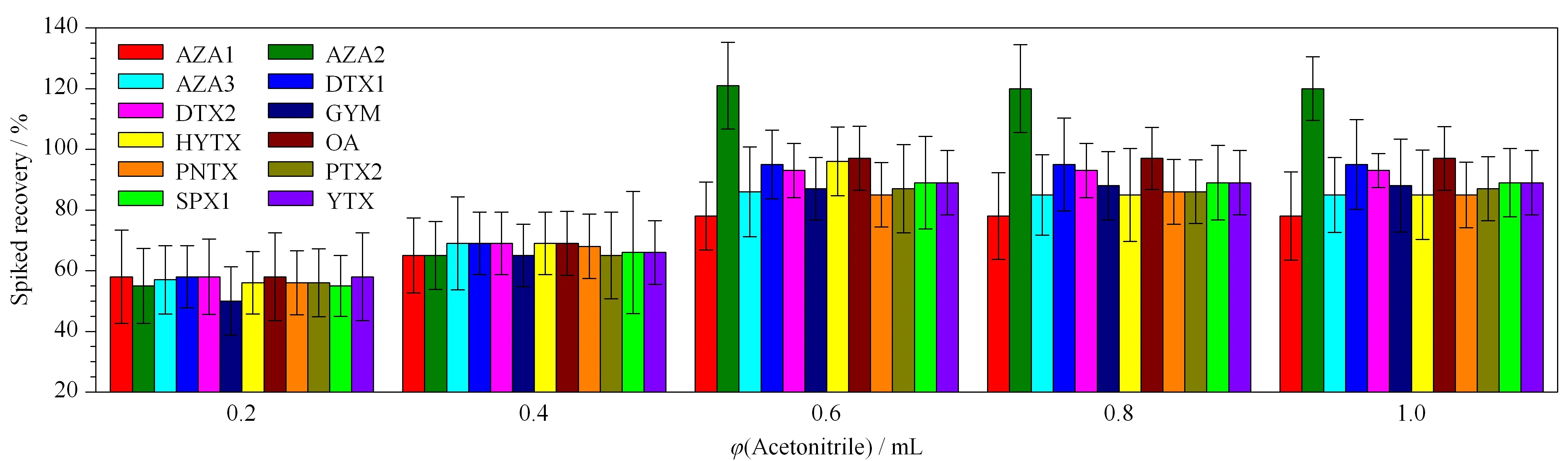
圖 3 不同體積的提取試劑對血漿中12種脂溶性貝類毒素加標回收率的影響(n=4)Fig.3 Effect of the extraction reagent volume on the spiked recoveries of the 12 lipophilic shellfish toxins in plasma (n=4)
2.3 方法學驗證
2.3.1基質效應
基質中存在的干擾成分會產生基質增強或基質抑制效應,進而影響目標化合物的定量[15-18]。為評估基質效應,分別采用空白尿液基質提取液、空白血漿基質提取液配制12種化合物的基質校準曲線,兩種曲線方程的斜率與溶劑標準曲線方程的比值均在0.8~1.1之間,表明該前處理方法的基質干擾低,采用溶劑標準曲線可對化合物進行準確定量。
2.3.2標準工作曲線和靈敏度
將混合標準溶液按照上述色譜、質譜條件進行檢測,結果表明,12種化合物在0.03~36.25 μg/L范圍內線性關系良好,相關系數(r2)均大于0.995。
以檢出限(LOD)和定量限(LOQ)評估方法的靈敏度。在尿液和血漿中添加目標化合物,信噪比(S/N)為3∶1時確定方法的LOD為0.09~0.28 μg/L,當S/N為10∶1時確定方法的LOQ為0.23~0.84 μg/L(見表2)。
2.3.3方法的精密度和準確度
空白尿液和空白血漿中分別加入LOQ、2倍LOQ、10倍LOQ等3個水平的目標化合物,每個水平進行6次平行試驗,加標回收率的相對標準偏差(RSD)作為日內精密度。2倍LOQ的加標水平進行5 d日間精密度測定。方法的回收率為72.7%~124.1%,日內精密度為2.1%~20.0%,日間精密度為2.1%~15.3%(見表2)。
2.4 樣品的測定
利用本方法檢測了10份健康人尿液樣本和10份健康人血漿樣本,以及經腹腔注射12種脂溶性貝類毒素的小鼠尿液和血漿樣品。10份人尿液樣本和10份血漿樣本均未檢出12種脂溶性貝類毒素。在10份小鼠尿液樣本中,均檢測出12種貝類毒素,含量在1.14~2.35 μg/L之間;在10份小鼠血漿樣品中,同樣檢測出12種貝類毒素,含量在1.01~1.17 μg/L之間。
3 結論
本研究分別建立了尿液和血漿中12中脂溶性貝類毒素的檢測方法,取樣量少,操作簡單快速,靈敏度高,適合尿液和血漿中脂溶性貝類毒素的檢測。

