芹菜素對妊娠期糖尿病大鼠內質網應激CHOP信號通路的影響
陳雪寧 黃 河 蔡志善 符大天 楊樹博 張 蕾?
(1.海口市婦幼保健院,海口 570102;2.海南省婦女兒童醫學中心,海口 570100;3.海南醫學院第一附屬醫院,海口 570102)
妊娠糖尿病(gestational diabetes mellitus,GDM)是妊娠期間發現的以血糖升高為主要表現的代謝異常性疾病,其發病機制復雜,可導致胚胎發育不良、異常甚至死亡等不良妊娠結局[1-2]。內質網應激(endoplasmic reticulum stress,ERS)信號通路增強子結合(C/EBP)同源蛋白(CHOP)表達與GDM 患者胰島細胞凋亡及胰腺組織損傷等病理過程密切相關[3-4]。芹菜素(apigenin,AP)是從蔬菜和水果中提取的天然黃酮類化合物,其具有抗氧化、抗炎和抗腫瘤等功效及毒性較低、無致癌致突變性等特點[5-7]。近年來研究發現,AP 可降低肝組織ERS 信號通路激活及肝組織損傷[8],但AP 對GDM 大鼠胰腺組織ERS 信號通路CHOP 蛋白表達的影響未見報導。本研究建立GDM 大鼠模型,對此進行探討,以期為臨床合理用藥提供參考。
1 材料和方法
1.1 實驗動物
清潔級SD 雌性大鼠80 只,雄性大鼠40 只,體重200~220 g,6~7 周齡,由廣東省醫學實驗動物中心提供[SCXK(粵)2018-0002]。所有大鼠于海南省藥物安全性評價研究中心動物實驗室飼養[SYXK(瓊)2017-0013],飼養條件:自然光照,自由飲食、飲水,溫度25℃,相對濕度50%,噪音低于80分貝,保持動物室環境及鼠籠清潔、透氣。本研究經海口市婦幼保健院動物倫理委員會批準(IACUC-2019031903)。實驗符合3R 原則。
1.2 主要試劑與儀器
胰島素(美國 MP Biomedicals 公司,批號0215504401);AP(純度98%,北京凱瑞基生物科技有限公司,批號CY12140,規格20 mg);鏈脲佐菌素(STZ)注射液(美國Sigma 公司,批號S0130,每瓶規格1 g);HE 染色試劑盒(碧云天生物技術研究所,批號E677218-0200);TUNEL 試劑盒(北京百奧萊博科技有限公司,批號10462);空腹血糖(FBG)酶聯免疫吸附試驗(ELISA)試劑盒(上海邦景實業有限公司,批號BL3802);空腹胰島素ELISA 試劑盒(武漢益普生物科技有限公司,批號MM0690R1);葡萄糖調節蛋白78(Glucose-regulated protein78,GRP78) 抗體、半胱氨酸天冬氨酸蛋白酶12(caspase-12)抗體(美國Abcam 公司,批號ab21685、ab8118);CHOP 抗體、β-actin 抗體、HRP 羊抗兔二抗(上海冠導生物工程有限公司,批號 GDA077207、GD-A05223、GD-L0479);BCA 蛋白定量試劑盒、胰蛋白酶(美國Pierce 公司,批號分別為P0768、P0231)。RM2125RTS 型手動輪轉式切片機(德國Leica 公司);SMZ745 型光學顯微鏡(日本尼康公司);1659001 型蛋白電泳儀、Trans-Blot SD 型半干轉膜儀(美國Bio-Rad 公司);GIS-500 型凝膠成像儀(杭州米歐儀器有限公司)等。
1.3 實驗方法
1.3.1 大鼠GDM 模型建立及分組給藥
參照文獻[9]構建大鼠GDM 模型,具體操作方法為:取SD 雌雄大鼠,禁食禁水12 h 后測尾靜脈FBG 值,挑選出FBG≤6.1 mmoL/L 的雌性大鼠80只、雄性大鼠40 只,并按雌:雄=2 ∶1比例合籠過夜,第2 天早晨對雌性大鼠行陰道涂片檢查,挑選70 只受孕大鼠(鏡檢有精子),并隨機取10 只大鼠腹腔注射檸檬酸緩沖液后,用正常飼料喂養作為正常妊娠組(Normal 組);將剩余60 只受孕大鼠腹腔注射45 mg/mL STZ 溶液后,用高脂高糖飼料喂養,復制GDM 模型,建模后第3 天,每只大鼠測FBG 值,若FBG≥16.7 mmoL/L 則造模成功,共造模成功50 只大鼠,隨機分為模型組(GDM 組)、AP 低(0.23 g/kg)、中(0.46 g/kg)、高(0.92 g/kg)劑量組、陽性組(胰島素20 U/kg),每組10 只。各組大鼠于妊娠第5 天開始給藥,AP 用生理鹽水配制成濃度為低(0.85 mol/L)、中(1.70 mol/L)、高(3.40 mol/L)的混懸液,AP[8]各處理組按10 mL/kg 的劑量灌胃給藥,陽性組[9]經皮下注射相應劑量胰島素,Control組與GDM 組灌胃給予等劑量生理鹽水,每天1 次,各組連續給藥2 周。
1.3.2 血液標本采集及檢測
各組大鼠末次給藥禁食禁水12 h 后,取尾靜脈血3 mL,以3000 r/min、10 min 的條件離心后,取上清液,按FBG 和空腹胰島素ELISA 試劑盒說明書檢測FBG、空腹胰島素含量,并根據公式胰島素抵抗指數(HOMA-IR)=FBG × FINS/22.5,計算HOMA-IR。
1.3.3 胰腺組織標本采集及組織病理學染色
各組大鼠在采取完靜脈血后,麻醉處死大鼠,快速摘取胰腺組織,剪取0.5 g 組織,于-80℃冰箱保存備用,剩余部分迅速置于4%中性多聚甲醛中固定24 h 后,進行常規透明、浸蠟、包埋、切片(厚度為5 μm)后。分別按HE 染色試劑盒及TUNEL 試劑盒說明書進行染色后,置于光鏡下觀察胰腺組織形態變化并隨機選取5 個視野,計算胰島細胞凋亡率(胰島細胞凋亡率=凋亡細胞數目/總細胞數目×100%)。
1.3.4 Western blot 法檢測胰腺組織GRP78、caspase-12、CHOP 蛋白相對表達水平
取1.3.3 中-80℃保存的胰腺組織,于4℃冰箱中解凍后,勻漿離心分離,取上清液,按蛋白提取試劑盒及BCA 試劑盒提取、檢測蛋白總濃度后,取50 μg 蛋白上樣,進行電泳、轉膜反應及TBST 清洗后,加入5%脫脂牛奶室溫封閉2 h,TBST 再次清洗后,加入一抗(GRP78、caspase-12、CHOP、β-actin 抗體,稀釋倍數分別為1 ∶1000,1 ∶1000,1 ∶1000,1 ∶2000)后,4℃室溫孵育過夜、TBST 振洗后加入HRP 羊抗兔二抗(稀釋倍數1 ∶2000),經37℃室溫孵育1 h、TBST 清洗后,采用增強化學發光法顯色,以凝膠成像儀觀察條帶并拍照,并以Image-J 軟件分析各組蛋白相對表達。
1.4 統計學方法
以SPSS 22.0 軟件對實驗數據進行統計分析,計量資料以平均數±標準差()表示,多組間比較進行單因素方差分析,進一步兩組間比較行SNKq檢驗,P<0.05,表示差異有統計學意義。
2 結果
2.1 AP 對各組大鼠FBG 含量及HOMA-IR 的影響
與Normal 組相比,GDM 組大鼠FBG 含量、HOMA-IR 均升高(P<0.05);與GDM 組相比,AP低、中、高劑量組及陽性組FBG 含量、HOMA-IR 均降低(P<0.05),且AP 各劑量組上述指標呈劑量依賴性降低;與AP 高劑量組相比,陽性組上述指標無顯著差異(P>0.05)。見表1。
2.2 AP 對各組大鼠胰腺組織病理損傷的影響
Normal 組大鼠胰島細胞排列整齊,胰腺組織未見明顯損傷。與Normal 組相比,GDM 組大鼠可見胰島細胞萎縮、減少、空泡變性、排列紊亂及炎性細胞浸潤等病理損傷嚴重。與GDM 組相比,AP 低、中、高劑量組及陽性組大鼠胰島細胞萎縮、減少、變性及炎性細胞浸潤等病理損傷現象均有不同程度的改善。見圖1。
2.3 AP 對各組大鼠胰島細胞凋亡的影響
與Normal 組相比,GDM 組大鼠胰島細胞凋亡率升高(P<0.05);與GDM 組相比,AP 低、中、高劑量組及陽性組大鼠胰島細胞凋亡率降低(P<0.05),且AP 各劑量組上述指標呈劑量依賴性降低;與AP高劑量組相比,陽性組上述指標無明顯差異(P>0.05)。見圖2、圖3。
2.4 AP 對各組大鼠胰腺組織GRP78、caspase-12、CHOP 蛋白表達的影響
與Normal 組相比,GDM 組大鼠胰腺組織GRP78、caspase-12、CHOP 蛋白表達升高(P<0.05);與GDM 組相比,AP 低、中、高劑量組及陽性組大鼠GRP78、caspase-12、CHOP 蛋白表達降低(P<0.05),且AP 各劑量組上述指標呈劑量依賴性降低;與AP高劑量組相比,陽性組上述指標無明顯差異(P>0.05),見圖4、圖5。
表1 各組大鼠FBG 值及HOMA-IR 比較(,n=10)Table 1 Comparison of FBG content and HOMA-IR in each group
表1 各組大鼠FBG 值及HOMA-IR 比較(,n=10)Table 1 Comparison of FBG content and HOMA-IR in each group
注:與Normal 組相比,aP<0.05;與GDM 組相比,bP<0.05;與AP 低劑量組相比,cP<0.05;與AP 中劑量組相比,dP<0.05。Note.Compared with Normal group,aP <0.05.Compared with GDM group,bP<0.05.Compared with the low dose AP group,cP<0.05.Compared with the mid dose group of AP,dP<0.05.

圖2 各組大鼠胰島細胞凋亡率比較Note.Compared with Normal group,aP<0.05.Compared with GDM group,bP<0.05.Compared with the low dose AP group,cP<0.05.Compared with the middle dose AP group,dP<0.05.Figure 2 Comparison of apoptosis rate of islet cells in each group
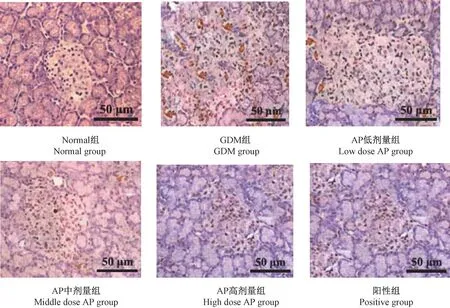
圖3 各組大鼠胰腺組織TUNEL 染色結果Figure 3 TUNEL staining results of pancreatic tissue of rats in each group
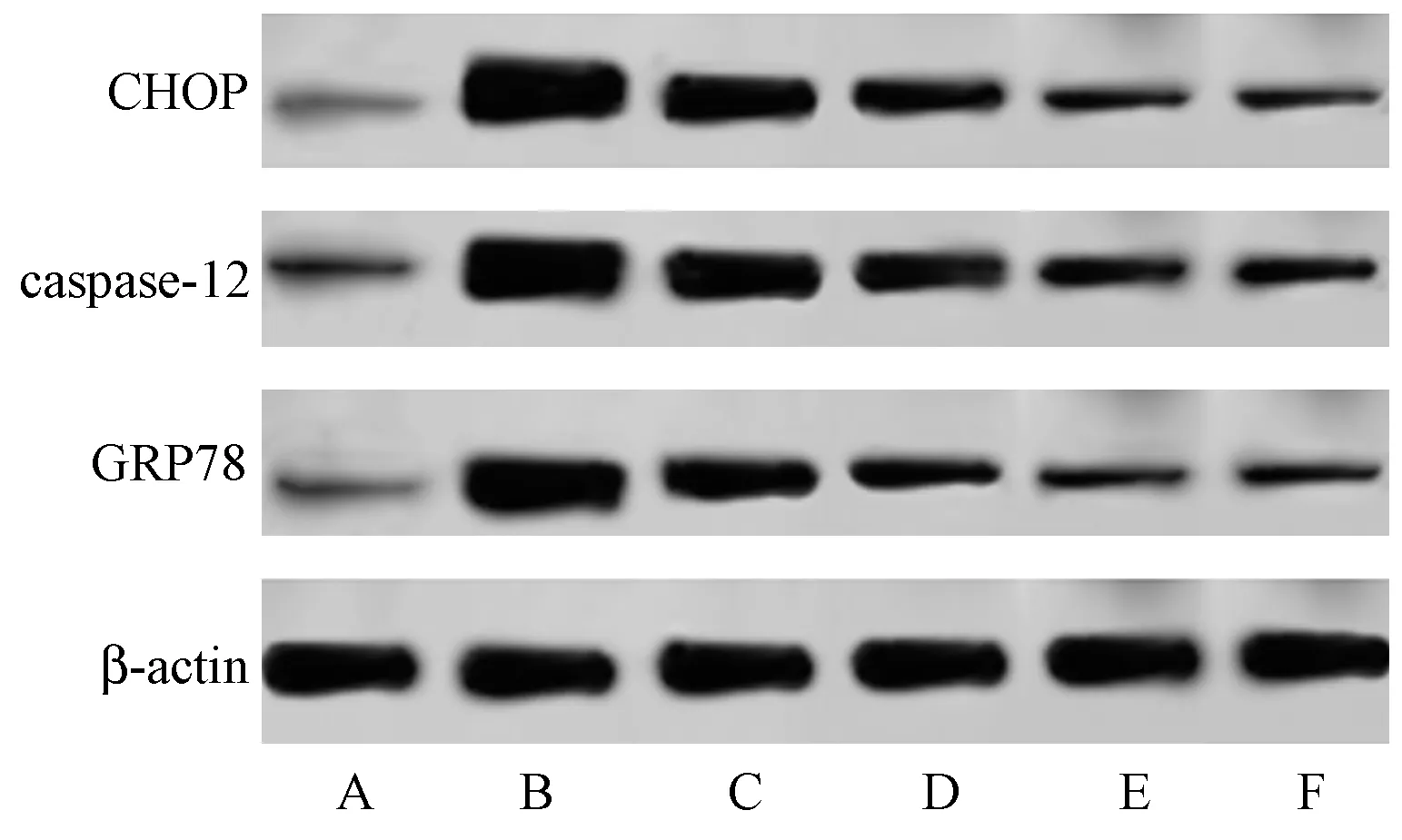
圖4 各組大鼠胰腺組織GRP78、caspase-12、CHOP 蛋白表達免疫印跡圖Note.A,Normal group.B,GDM group.C,Low dose AP group.D,Middle dose AP group.E,High dose AP group.F,Positive group.Figure 4 Western blot of GRP78,caspase-12 and CHOP protein expression in pancreas of rats in each group
3 討論
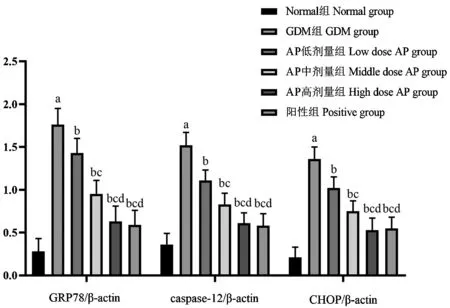
圖5 各組大鼠胰腺組織GRP78、caspase-12、CHOP 蛋白表達比較(,n=10)Note.Compared with Normal group,aP<0.05.Compared with GDM group,bP<0.05.Compared with the AP low dose group,cP<0.05.Compared with the AP medium dose group,dP<0.05.Figure 5 Comparison of GRP78,caspase-12 and CHOP protein expression in pancreas of rats in each group
GDM 屬于妊娠期間發生的糖尿病,其患病率、確診率呈逐年升高的趨勢,對孕婦及胎兒的危害極大,越來越受到臨床研究的重視[10-11]。AP 是從蔬菜和水果中提取的一種安全、低毒的黃酮類化合物,近年來研究發現,其對糖尿病具有較好的治療作用。劉俊法[12]發現AP 可降低糖尿病大鼠血糖、血脂水平,緩解多種糖尿病并發癥引起其的損傷;候丹等[13]發現AP 可抑制2 型糖尿病合并非酒精性脂肪肝小鼠體重增加,并改善2 型糖尿病合并非酒精性脂肪肝小鼠糖、脂代謝紊亂及胰島素抵抗等癥狀。故本研究推測AP 也可能降低GDM 患者血糖升高及胰島素抵抗引起的胰腺組織損傷,并建立GDM 大鼠模型對此進行驗證,結果發現與Normal組相比,GDM 組大鼠FBG 含量及HOMA-IR 均升高,胰腺組織可見胰島細胞排列紊亂、萎縮及炎性浸潤等病理損傷,胰島細胞凋亡率增加,提示GDM大鼠出現血糖升高、胰島素抵抗、胰島細胞凋亡及胰腺組織損傷等癥狀,表明造模成功。而與GDM組相比,AP 低、中、高劑量組及陽性組大鼠胰島組織病理癥狀減輕,FBG 含量、HOMA-IR、胰島細胞凋亡率顯著下降,且AP 各劑量組上述指標呈劑量依賴性降低,表明AP 可降低GDM 大鼠血糖及胰島素抵抗,抑制胰島細胞凋亡,減輕胰腺組織損傷,對GDM 有一定的治療作用。
胰島細胞凋亡、胰島功能缺陷和胰腺組織損傷是GDM 的主要病理過程[14-15],Pepin 等[16]發現胰島細胞凋亡和胰腺功能受損是GDM 發生率較高的主要原因。研究發現,ERS 會引起胰島細胞凋亡和胰腺組織損傷[17-18],郎麗翔等[19]亦發現ERS 參與GDM 過程,GDM 大鼠胰腺組織GRP78、caspase-12蛋白表達升高,ERS 及胰島細胞凋亡、胰腺組織損傷均加重。魏倩等[8]發現AP 可通過抑制GRP78/CHOP/caspase-12 信號通路表達,緩解丙烯腈所致的大鼠肝組織ERS 和損傷;Feng 等[20]發現AP 可降低心肌組織中CHOP 蛋白表達,降低心肌缺血灌注再損傷大鼠ERS 介導的細胞凋亡和炎性損傷。以上研究提示,AP 可抑制機體內質網應激及組織細胞凋亡和損傷,本研究推測AP 也可能通過抑制胰腺組織ERS 相關信號通路,實現抑制GDM 大鼠胰島細胞凋亡及胰腺組織損傷的目的。故本研究對GDM 模型大鼠胰腺組織ERS 相關通路蛋白GRP78/CHOP/caspase-12 進行檢測,發現,與Normal 組相比,GDM 組大鼠胰腺組織GRP78、CHOP、caspase-12 蛋白表達均增高,表明GDM 組大鼠胰腺組織中GRP78/CHOP/caspase-12 通路處于激活狀態,提示胰腺組織ERS 參與GDM 的發生發展。而與GDM 組比較,AP 低、中、高劑量組及陽性組大鼠胰腺組織GRP78、CHOP、caspase-12 蛋白表達均降低,且AP 各劑量組上述指標呈劑量依賴性降低,表明AP 可抑制GDM 大鼠胰腺組織CHOP 通路相關蛋白表達,降低ERS,推測這可能為AP 抑制GDM 大鼠胰島細胞凋亡及胰腺組織損傷的作用機制。
綜上所述,AP 可能通過抑制胰腺組織CHOP通路相關蛋白表達,降低胰腺組織ERS,進而緩解GDM 大鼠胰腺組織損傷和胰島細胞凋亡,為臨床治療GDM 提供一定參考。GDM 病理過程極其復雜,本研究未設置通路抑制劑進行驗證,AP 還可能通過其他途徑緩解GDM 胰腺組織ERS 及胰島細胞凋亡、損傷等病理癥狀,這有待后續繼續深入研究。

