Musca domestica cecropin協同頭孢曲松鈉抗鼠傷寒沙門氏菌及生物被膜作用研究
曾佳利,桂水清,盧雪梅
沙門氏菌是具有重要意義的人獸共患病原菌之一。對于人類,沙門氏菌的主要污染源是受污染的食物和水源,沙門氏菌可寄生在人類和動物的胃腸道中,其中受威脅最大的是兒童、老年人及免疫缺陷個體[1]。在我國,每年由沙門氏菌引起的食物中毒事件占所有食源性中毒事件的比例高達40%~60%,其中鼠傷寒沙門氏菌 (Salmonellatyphimurium) 是引起急性胃腸炎的主要病原菌之一,該菌宿主范圍廣泛,包括人類和動物[2-3]。
抗菌肽(Antimicrobial peptides,AMP)是一類具有廣譜抗菌活性的小分子多肽,對病毒、真菌、原蟲和癌細胞等均有殺滅作用,且對革蘭陰性及陽性細菌有著高效廣譜的殺傷力。抗菌肽主要作用機制大致可分為兩類:膜結構破壞型與非膜結構破壞型[4-9],并且它們大多數具有凈正電荷,這種凈電荷與相當比例 (高達30%) 的疏水殘基結合,是其抗菌活性的基礎[10-12]。抗菌肽由于其特殊的抗菌機制使菌株不易產生耐藥性,將是一種新型的抗菌藥物。本課題組前期實驗從家蠅幼蟲脂肪體cDNA文庫中克隆出一種家蠅抗菌肽(Muscadomesticacecropin, MDC),發現家蠅抗菌肽MDC能夠在體外殺死多種革蘭陰性菌和革蘭陽性菌[13-14],同時對多重耐藥大腸桿菌臨床分離株的作用顯著,溶血毒性低[15]。頭孢曲松鈉是第三代頭孢菌素類抗生素,主要抗菌機制為影響細菌細胞壁的生物合成,抗菌譜廣,是臨床上抗菌治療應用最廣泛的抗生素類藥物之一[16-17]。但根據研究表明,頭孢曲松鈉過度使用可導致鼠沙門氏菌產生耐藥性[18],所以聯合用藥不失為一種新選擇。
本研究擬通過體外實驗分別觀察MDC、頭孢曲松鈉及聯合用藥對鼠傷寒沙門氏菌的抑菌作用,同時檢測MDC與頭孢曲松鈉聯合用藥對生物膜活性影響,并初步探討它們之間的協同抗菌機制,評估2種藥聯用治療鼠傷寒沙門氏菌感染的潛在應用價值。
1 材料與方法
1.1材料與儀器
1.1.1實驗菌株及藥物 鼠傷寒沙門氏菌CMCC5011購自廣東省微生物菌種保藏中心;頭孢曲松鈉1.0 g/瓶購自廣東三才醫藥集團有限公司;抗菌肽MDC純度97.15%;分子量:4 301.59 Da北京中科亞光生物科技有限公司合成。
1.1.2主要試劑 甲醇、二甲基亞砜購自廣州化學試劑廠;無水乙醇、二甲苯購自天津市大貿化學試劑廠;戊二醛25%溶液購自天津市科密歐化學試劑有限公司;MRS培養基購自廣東環凱微生物科技有限公司;胰蛋白胨購自廣東環凱微生物科技有限公司;TSBg培養基購自廣東環凱微生物科技有限公司;0.5%無菌TTC溶液購自廣東環凱微生物科技有限公司。
1.1.3儀器 MD 2500熒光倒置顯微鏡、DMI 2500顯微鏡,德國Leica公司;Model 680酶標儀,美國Bio-Rad公司,721分光光度計,上海菁華科技有限公司;流式細胞儀,美國BD公司;冷場發射掃描電子顯微鏡JSM-6330F、JEM1400透射電鏡,日本電子株式會社。
1.2方 法
1.2.1MIC和MBC測定 采用微量肉湯二倍稀釋法分別測定MDC及頭孢曲松鈉對鼠傷寒沙門氏菌的最小抑菌濃度(minimal inhibit concentration, MIC)和最小殺菌濃度(minimum bactericidal concentration, MBC)。將100 μL濃度為1×106CFU/mL的鼠傷寒沙門氏菌菌液加入96孔板,然后加入100 μL稀釋好的MDC(2 mg/mL~4 μg/mL)及頭孢曲松鈉(0.25~128)μg/mL,于37 ℃恒溫培養細菌18 h后將96孔板取出,以無細菌生長的最小藥物濃度為MIC值。無菌操作下,吸取0.1 mL MIC值對應孔及大于MIC值的4個孔中的菌液,在LB固體培養基上均勻涂布,在37 ℃培養24 h,無菌落出現的最大稀釋度對應的藥物濃度值為最低殺菌濃度(MBC)值[20]。每組重復3次,取平均值。
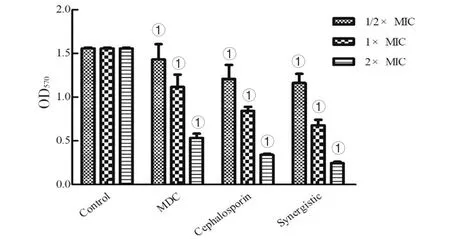
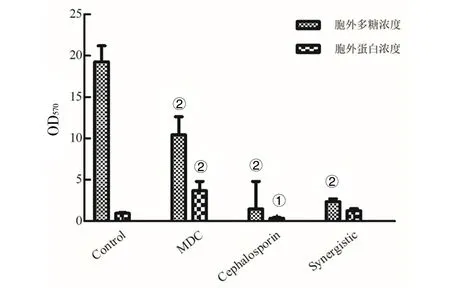
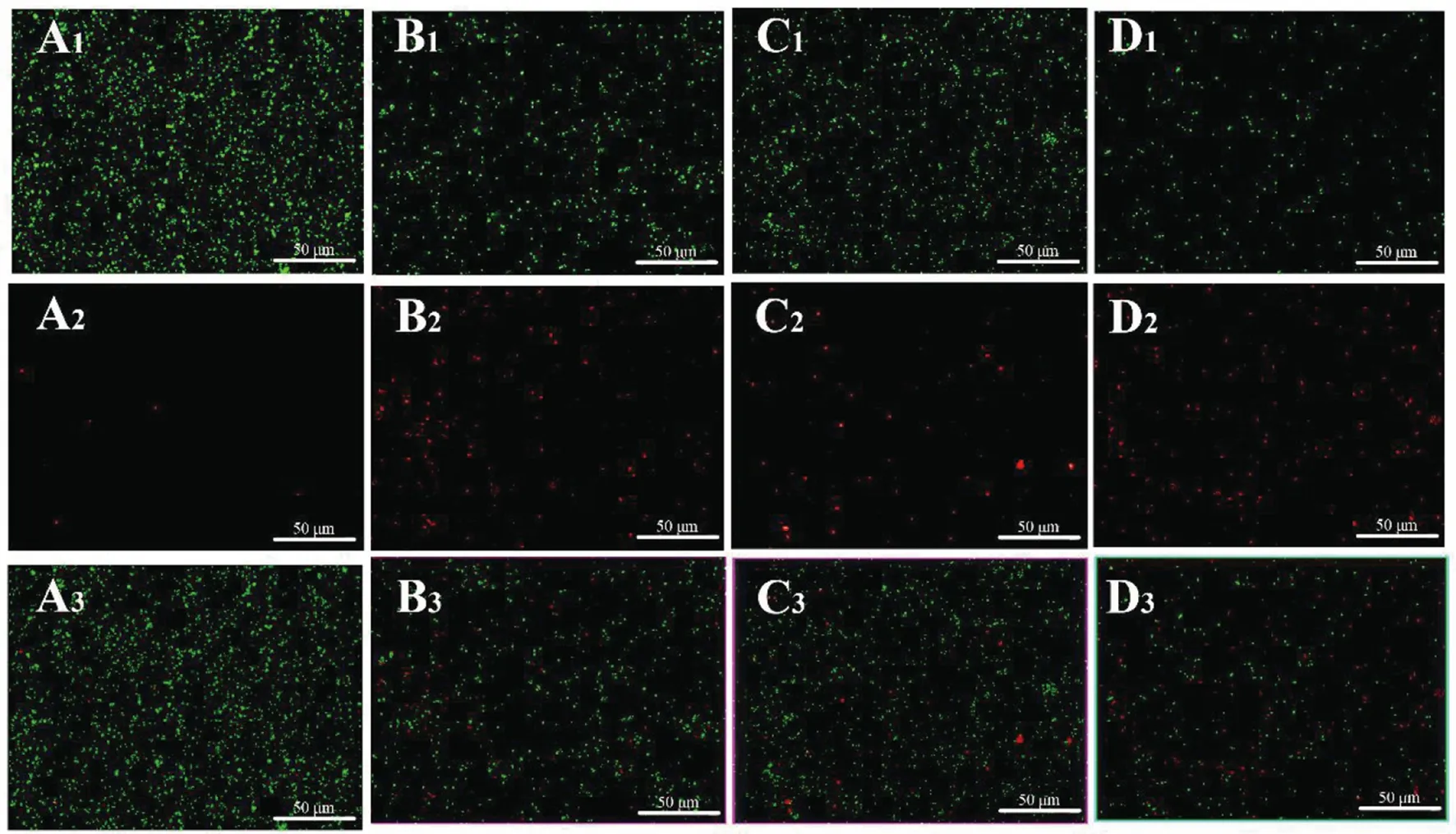
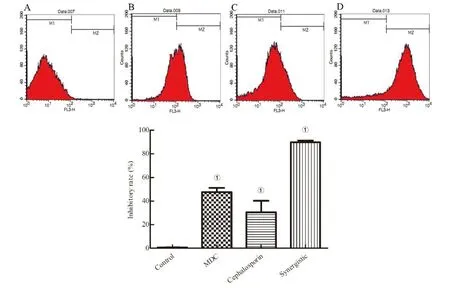
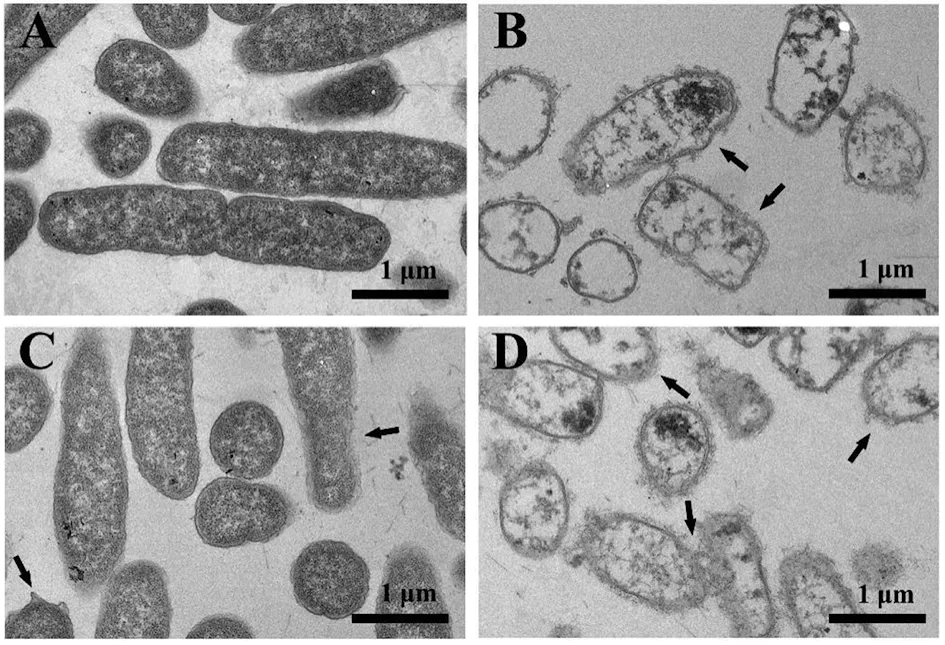
1.2.2FIC測定 根據頭孢曲松鈉(甲)、MDC(乙)對鼠傷寒沙門氏菌的MIC值和MBC值,將甲乙2種藥依次稀釋至濃度為2×MIC、1×MIC、1/2×MIC、1/4×MIC、1/8×MIC、1/16×MIC、1/32×MIC、1/64×MIC,共8個藥物濃度梯度并做好標記。加入100 μL的菌液然后按梯度濃度依次加入甲50 μL于對應的孔中,隨后再按梯度濃度差異順序在垂直方向加入同體積的乙,標記后37℃恒溫培養箱中培養18 h。第2天取出96孔板,觀察各孔菌液的渾濁程度。棋盤法則計算聯合指數 (fractional inhibitory concentration,FIC),根據FIC指數=MIC(聯合用藥組)/MIC(甲組單用)+MIC(聯合用藥)/MIC(乙組單用)。其中FIC值≤0.5時,表示甲與乙之間為協同抑菌作用;當FIC值處于0.5 1.2.3MDC和頭孢曲松鈉對生物被膜的作用 結晶紫染色實驗中MDC組濃度為2×MIC,1×MIC,0.5×MIC;頭孢曲松鈉組濃度為2×MIC,1×MIC,0.5×MIC;聯合用藥組包括MDC與頭孢曲松鈉,2種藥物的終濃度均達到1×MIC,培養基為空白對照組,純菌液為陰性對照組。無菌6孔板每孔放入1張蓋玻片作為生物被膜的載體,加入500 μL菌液,按照分組依次加入藥液37 ℃恒溫培養18 h后棄上清,無菌NS清洗3次,99%甲醇溶液固定,2%的結晶紫溶液染色5 min,洗去非特異吸附結晶紫后封片,于顯微鏡下觀察拍攝。 對生物被膜初始附著的影響,蓋玻片放入96孔板中,每孔加100 μL的菌液,給藥組加入100 μL藥液,TSBg培養基組為空白組,不加藥組為陰性組,37 ℃培養箱培養2 h;無菌NS清洗3次,99%甲醇溶液固定,2%的結晶紫溶液染色5 min,每孔加入33%冰乙酸溶液160 μL,然后置于搖床振搖10 min;結晶紫完全溶解后,酶標儀(570 nm)測定OD值,每組重復3次。 采用96孔板測定MDC和頭孢曲松鈉對已形成的鼠傷寒沙門氏菌生物被膜的破壞作用。使用無菌96孔板接種濃度為1×106CFU/mL的菌液,每孔各100 μL;37 ℃培養24 h;棄去孔中的溶液,用NS清洗3次;按照分組依次加入藥液100 μL (每個濃度3個復孔) ,37 ℃繼續培養24 h;棄去孔中溶液后按照上述步驟操作酶標儀檢測,每組重復3次。 1.2.4對胞外物質含量測定 搖菌管內加入5 mL稀釋好的菌液,同時加入終濃度為128 μg/mL 的MDC和終濃度為1 μg/mL的頭孢曲松鈉,生理鹽水作為對照組,每組重復6次。37 ℃培養箱培養8 h,EP管中加入1.8 mL菌液,離心20 min后,將沉淀加入蒸餾水重溶,然后加入37%的甲醛,4 ℃放置3 h后轉移至室溫,再加入1 mol/L的NaOH溶液在4 ℃放置3 h,離心后留取沉淀待查。采用苯酚-硫酸法測定胞外多糖的含量,BCA試劑盒法測定胞外蛋白的含量。 1.2.5熒光染色與流式細胞術 (Flow cytometry,FCM) 采用PI染液和SYTO 9染液對生物被膜進行熒光染色。將活化的鼠傷寒沙門氏菌菌液濃度稀釋為5×108CFU/mL,以蓋玻片為載體加入菌液培養18 h;加入藥物后37 ℃ 靜置處理1 h;取NS 1 mL,加入SYTO 9 (5 mmol/L) 0.5 μL、PI (7.5 mmol/L) 3.7 μL,混合均勻后加入6孔板中,室溫避光染色15 min,用NS洗去未結合的熒光染液,熒光防淬滅劑封片,熒光顯微鏡下拍攝。 FCM的基本處理同上,避光染色15 min,將樣品轉移至流式管,流式上樣處理。 1.2.6掃描電子顯微鏡 (Scanning electron microscope,SEM) 與透射電子顯微鏡 (Transmission electron microscope,TEM) 將生長至對數期的鼠傷寒沙門氏菌用PBS洗3次,調整濃度至1.5×108CFU/mL;將菌液加入Eppendorf 管中,再分別加入MDC和頭孢曲松鈉以及MDC和頭孢曲松混合組 (使各管中藥物終濃度為MIC),對照組加入等量的PBS;給藥60 min后,離心收集菌體,在2.5%戊二醛中避光固定,PBS洗3次后制成菌懸液;依次用30%、50%、5%和95%乙醇脫水,每次10 min,無水乙醇重復脫水2次,每次10 min;將樣品放入二氧化碳臨界點干燥器內,干燥后的標本放入高真空蒸發器內,噴金鍍膜,掃描電子顯微鏡下進行觀察拍攝。 細菌培養和樣本制備同SEM,藥物作用60 min后,用2.5%戊二醛-1.5%多聚甲醛-0.1 M PBS (pH 7.2) 在4℃固定2 d;0.1 M PBS (pH 7.2) 漂洗3次,1%鋨酸-1.5%亞鐵氰化鉀4℃固定1.5 h,0.1 mol/L PBS (pH 7.2) 漂洗3次,將樣品脫水,制樣后切片采用乙酸鈾-檸檬酸進行染色。保存樣品,于TEM下拍攝。 1.2.7數據分析 實驗數據使用 Graphpad Prism 5 軟件進行分析繪圖,采用方差分析(ANOVA),檢驗水準α=0.05。 2.1MDC和頭孢曲松鈉抗菌結果與FIC值 MDC對鼠傷寒沙門氏菌的MIC為128 μg/mL,MBC為256 μg/mL;頭孢曲松鈉對鼠傷寒沙門氏菌的MIC為1 μg/mL,MBC為4 μg/mL,表1為實驗結果。MDC和頭孢曲松鈉聯用后FIC指數為0.218,FIC<0.5說明MDC與頭孢曲松鈉有較強的協同作用,這與預期結果相一致。其中,聯合用藥時MDC的MIC值是自身單用的1/4,頭孢曲松的MIC值是其單用時的1/32。 2.2MDC和頭孢曲松鈉對生物被膜作用 藥物對生物被膜的形成影響實驗結果如圖1所示:MDC組和頭孢曲松鈉組梯度MIC倍數的藥物濃度對其生物被膜形成能力的影響力也呈相應梯度,且相較于空白對照組也具有一定的抑制作用。在同MIC倍數濃度中,MDC和頭孢曲松鈉聯合用藥組對生物被膜形成能力的抑制作用最強,結果顯示MDC和頭孢曲松鈉能協同抑制鼠傷寒沙門氏菌所形成的生物被膜。 表1 對鼠傷寒沙門氏菌MIC、MBC和FIC的測定 A為空白對照組;B為1/2×MIC組;C為1×MIC組;D為2×MIC組。1為MDC組;2為頭孢曲松鈉組;3為聯合用藥組。 如圖2所示,可知MDC和頭孢曲松鈉在所有濃度下均能一定程度上抑制初始生物被膜的附著,且抑制效果與藥物濃度成正相關。在同比MIC倍數下,頭孢曲松鈉組效果更好。MDC和頭孢曲松鈉聯合用藥組對生物被膜附著的抑制作用最強。對成熟生物被膜的破壞作用結果如圖3所示,MDC和頭孢曲松鈉在低濃度劑量(0.5×MIC)下對成熟生物被膜的破壞作用微弱,當藥物濃度升高后具有一定的破壞作用,高劑量(2×MIC)下效果明顯增強,聯合用藥組的效果優于單獨用藥組。 注:①與空白對照組相比,P<0.001 2.3生物被膜胞外物質含量測定 胞外物質含量如圖4所示,MDC組、頭孢曲松鈉組和聯合用藥組胞外多糖濃度均小于對照組,說明3組均對胞外多糖的產生具有一定抑制作用。MDC組蛋白含量過高,可能與細胞膜的破壞導致胞內蛋白外泄有關,頭孢曲松鈉組蛋白含量相較于對照組有明顯的減少,聯合用藥組雖然蛋白含量高于空白對照組,但總體低于MDC。 注:①與空白對照組相比,P<0.05; ②與空白對照組相比,P<0.001 2.4熒光染色和流式細胞術 圖5為鼠傷寒沙門氏菌熒光染色,SYTO 9能與細菌內的DNA結合發出綠色熒光,PI具有更強的與DNA結合能力,但PI不能對結構完整的細菌染色,只有細菌死亡后才能被染成紅色。被SYTO 9染色的活菌呈綠色熒光,紅色熒光為被PI染色的死菌,SYTO 9和PI標記熒光可以反映細菌的死亡率和細菌的存活狀態。圖中陰性對照組呈均勻綠色熒光,而MDC組和頭孢曲松鈉組細菌有不同程度死亡,聯合用藥組死亡的細菌數目遠大于單獨用藥組,這進一步證明MDC和頭孢曲松鈉在抑菌殺菌過程中存在一定協同作用。流式結果如圖6所示,用PI染色后M2區域表示細胞膜破壞數量,MDC組和頭孢曲松鈉組均有一部分細胞膜被破壞,兩藥同濃度下MDC對細胞膜破壞率達47%,頭孢曲松鈉為30%對細胞膜破壞作用低于MDC,兩藥聯合后細胞膜破壞率達89%,死亡細菌的數量顯著上升。 2.5SEM觀察細胞表面結構變化 掃描電鏡結果如圖7所示,對照組細菌整體結構完整。MDC組整體結構明顯破壞,細胞膜出現一定的損傷,有部分內容物溢出形成絮狀。頭孢曲松鈉組出現菌體斷裂,個別菌株嚴重變形,出現縊痕,具有凹陷結構。聯用組不僅出現細胞內容物外泄,同時損壞程度相較于單獨用藥組明顯增強。 2.6TEM觀察細胞超微結構變化 圖8中可看出對照組中的鼠傷寒沙門氏菌細胞膜與細胞壁結構完整,細胞質均勻。MDC組中的細菌發生菌體變形,大部分的胞內物質外泄,細胞質出現空腔。頭孢曲松鈉組中出現菌體變形嚴重,表面粗糙,界限模糊,具有凹陷結構。聯用組不僅出現細胞壁與細胞膜間隙增寬,同時胞內物質降解,呈現亂絮狀,只剩下細胞壁的空腔,且細胞壁疏松,外層模糊,損壞程度也明顯強于MDC與頭孢曲松鈉組。 A為對照組,B為 MDC組,C為頭孢曲松鈉組,D為聯用組,1為SYTO 9染色,2為PI染色,3為 merge A為空白對照組,B為MDC組,C為頭孢曲松鈉組,D為聯用組 A為空白對照組,B為MDC組,C為頭孢曲松鈉組,D為聯用組 A為空白對照組,B為MDC組,C為頭孢曲松鈉組,D為聯用組 沙門菌病是危害嚴重的人獸共患病之一,在抗生素類藥物濫用的大環境下,頭孢曲松鈉單獨使用容易導致沙門氏菌耐藥株的產生。家蠅抗菌肽(MDC)屬于抗菌肽的一種,擁有特殊的抗菌機制,不易誘導耐藥菌株的產生,使其具有良好的應用前景。從機制上看,頭孢曲松鈉其主要抗菌機制為影響細菌細胞壁的合成,MDC則主要作用于細胞膜,二者聯用具有可行性,這為聯合用藥抗鼠傷寒沙門氏菌開辟一條新途徑。 細菌生物被膜是粘附于非生物或生物表面的微生物細胞菌落, 并由細胞外多聚基質包裹[22]。有學者認為細菌對抗生素的耐藥性除了與耐藥菌株的大量產生有關,亦同細菌在體內形成的生物被膜相關,生物被膜被公認是造成包括抗生素治療在內的多種疾病治療手段失敗的重要原因[23]。同時研究發現生物被膜能對抗機體的免疫防御機制,不利于抗感染治療[24],以抗菌肽為代表的肽類抗菌物質是治療生物被膜的重要途徑,能治療野生型和多藥抗性生物被膜并防止致命的銅綠假單胞菌感染。在銅綠假單胞菌生物被膜感染的無脊髓生物模型中,抗菌肽與抗生素聯合應用明顯增強了殺菌效果[25]。生物被膜的附著是細菌形成生物被膜的第一個步驟,同樣也是生物被膜形成最關鍵的一步。給藥后,結晶紫染色結果顯示兩種藥單獨用藥都能對生物被膜的初始附著與形成產生抑制作用,并且能破壞成熟生物被膜,兩藥聯用后以上效果更為顯著,能有效降低細菌的耐藥性。生物被膜胞外物質含量的檢測結果中發現,頭孢曲松鈉組中鼠沙門氏菌的胞外多糖含量最低,這或許與頭孢曲松鈉的抗菌機制有關,頭孢曲松鈉對細菌胞外多糖分泌的抑制作用需要進一步研究。有報道稱抗菌肽能在細胞膜上形成環孔,致使胞內容物大量外泄[26]。掃描電鏡和透射電鏡結果顯示MDC能損傷菌體細胞膜和結構,使細菌內容物溢出,出現空腔;而頭孢曲松鈉會破壞菌體細胞壁,使其變形斷裂。兩藥聯用后則會更大程度的破壞細胞結構,導致細菌死亡。 綜上所述,家蠅抗菌肽MDC和頭孢曲松鈉能協同抑制鼠傷寒沙門氏菌及初始生物膜,破壞成熟生物膜。MDC主要作用于細胞膜致使內容物泄露,頭孢曲松鈉破壞細胞壁使細菌菌體斷裂,兩藥聯用時具有協同作用,增強抗菌和抗生物膜活性,二者機制形成互補,相輔相成。 利益沖突:無2 結 果



3 討 論

