科技通往“永生”之路?
瞻云

2008年1月,伊麗莎白·布萊克本(中)在實驗室做研究
同源性的器官再造,更能大大降低免疫排斥的風險,甚至根除病灶。
無論古今中外,長生不老一直是人類的終極渴望。它是神話傳說的核心,也是科幻小說中最熱門的元素之一。那么,未來的人類,真的有實現永生的可能性嗎?
回答這個問題之前,我們還需要解答一個問題:人類的壽命為什么會有限?
19世紀60年代以前,人們一直相信脊椎動物的細胞擁有無限分裂的能力。直到1961年,美國微生物學家萊昂納多·海弗里克的發現,打破了人們的幻想。通過實驗觀察,海弗里克發現,正常細胞在體外的分裂次數存在一個40~60次的上限。這個上限,又被稱為海弗里克極限。
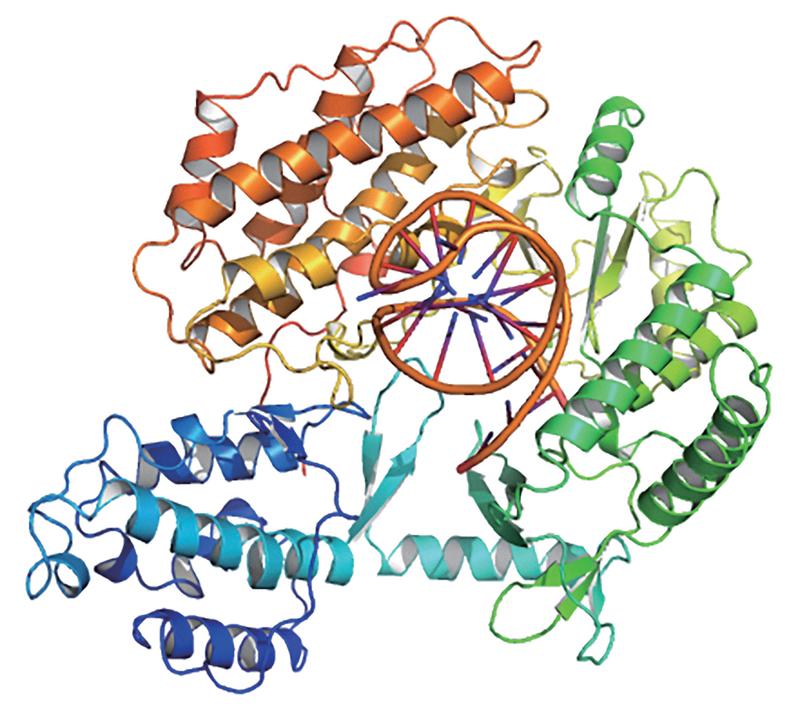
20世紀70年代,科學家伊麗莎白·布萊克本等人,發現了位于染色體末端的端粒結構。端粒可以保護染色體,并保證基因復制時的穩定性,但端粒在每次復制的時候會丟失一部分。當丟失的端粒達到極限,細胞也就不再分裂。端粒的發現,完美地解釋了海弗里克極限。
端粒酶實現細胞無限分裂?
伊麗莎白·布萊克本等人發現了能修復端粒的端粒酶。不同細胞的海弗里克極限,受限于細胞端粒的長度,以及修復能力。胰島細胞的海弗里克極限只有十余次,而造血干細胞的海弗里克極限可達到100多次。
進入21世紀之后,端粒的研究,已經成了生物學的熱門領域。2009年,伊麗莎白·布萊克本等人被授予諾貝爾生理學或醫學獎。利用端粒酶修復端粒,是否就能打破海弗里克極限呢?
2016年5月23日,俄羅斯一家人體冷凍公司用假人進行冷凍實驗
答案是確定的。胚胎干細胞和生殖細胞之所以能無限分裂,便在于端粒酶對端粒的修復。但在正常細胞中,如果端粒酶過于活躍,便會導致癌癥的發生。而癌細胞之所以能無限分裂,同樣在于端粒酶對端粒的無限修復。
/ 納米技術修復大腦后,必然影響意識的連續性。 /
可否既突破海弗里克極限,又不提高癌癥的得病率呢?這是可行的。2000年前后,研究者引入外源端粒酶對細胞染色體端粒進行修復(異位表達),打造出了沒有癌化的永生細胞系。端粒酶的異位表達擁有廣闊的運用前景,甚至有可能為人類未來的永生技術提供堅實的基礎。
端粒酶分子結構
在遙遠的將來,利用端粒酶的異位表達來實現永生,并非沒有可能性。無脊椎動物中,不少動物都擁有無限的理論壽命,例如擁有無限修復端粒的能力的龍蝦。
冰晶挑戰人體冷凍
無論傳說還是科幻故事中,總有活了幾個世紀的人物。在《人猿星球》《異形》之類的科幻電影中,也總是會出現宇航員通過冬眠或冷凍技術跨越超長時空的故事。
比起僅僅存在于未來或科幻電影的冬眠技術,距離我們更近的反而是人體冷凍。人體冷凍是近幾年來被熱議且充滿爭議的話題。但實際冷凍技術的開端源于19世紀50年代,英國科學家詹姆斯·洛夫洛克對嚙齒動物的冷凍實驗。
1955年,有老鼠在被短期冷凍后復蘇,但其在4~7天后死去。在實驗過程中,人們也發現了冷凍技術有著諸多的障礙。在這些障礙中,細胞內冰晶的破壞力尤為致命。
1963年,美國橡樹嶺國家實驗室經過研究發現,在進行冷凍時,如果把溫度降低的速度控制得足夠慢,便可以讓細胞排除充分的水分,從而避免細胞內的結冰。
1967年1月12日,第一例人體冷凍實驗開始了。20世紀70年代,人類發展出了控速慢凍技術。科學家添加冷凍保護劑的同時,把溫度降低的速率控制在了1°C/min,在細胞層面達到了完好的冷凍效果,令冷凍技術真正發展到了實用階段。

3D打印大腦
控速慢凍技術被廣泛用于冷凍卵母細胞、皮膚、血制品、胚胎、精子、干細胞,以及相關前沿領域。但此時,冷凍技術尚且停留在細胞層面。
20世紀80年代,玻璃化技術開始被引入冷凍保存。1999年,玻璃化開始用于卵母細胞的保存。進入21世紀之后,一家醫學公司成功對兔子腎臟進行了玻璃化保存,并在復溫后完成了無損移植。
玻璃化技術比起控速慢凍技術更為先進,可以令細胞組織在冷凍時的受損降到最低。器官層面的玻璃化冷凍技術已經逐漸成熟,距離臨床運用已越來越近。
玻璃化技術也早已被用在了人體冷凍上面,2015年,《三體》編審之一的杜虹女士因胰腺癌去世。她托付美國科研機構阿爾科對其頭部進行了冷凍保存。因此她成為了中國人體冰凍第一人。
阿爾科保存杜虹女士頭部所用的技術,便是玻璃化技術保存。50年后,杜虹女士是否有復活的可能性呢?答案可能并不樂觀。
當前的人體冷凍案例,無一例外,全部都是在臨床死亡之后進行的人體冷凍。要使喚醒的可能性更高,除非進行活體冷凍。但即便突破道德和法律的限制,活體冷凍復活的可能性也依舊面臨極大的挑戰。
在人體冷凍之前,所有的血液都會置換成冷凍保護劑,雖然冷凍保護劑有利于玻璃化技術的實現,但同時也對細胞具有毒性,長期保存會對細胞造成不可逆的損傷。
除此之外,宇宙中還存在各種各樣的輻射。這些輻射會對DNA造成破壞,哪怕再完美的冷凍保存技術,復活的時間上限也不能超過1000年。而且,玻璃化冷凍的人,在解凍時,難以完全避免冰晶的形成,這會對細胞造成進一步的破壞。
除了在冷凍技術上著手外,當未來的納米科技發展到一定地步,理論上是可以使用納米機器人修復大腦的。
但納米技術修復大腦后,必然影響意識的連續性。當一顆大腦損傷10%,未來通過納米技術修復后,保留90%的原來意識,我們還勉強能稱之為原來的那個人。但如果損傷了90%,修復后只保留了10%,他(她)還是原來那個人嗎?
克隆人已在敲門?
如果說人體冷凍復活技術距離落地還有一段路要走,那么器官再造對于人類來說,便是觸手可及的。
相較于捐獻器官,再造器官技術能真正解決人類器官移植緊缺的問題。同源性的器官再造,更能大大降低免疫排斥的風險,甚至根除病灶。
當前最熱門、且前景最亮眼的器官再造技術之一,當屬治療性克隆。2013年,已經有研究團隊掌握了克隆人類胚胎分離干細胞的技術。2018年,中國研究者成功克隆出靈長類動物—兩只食蟹獼猴。
隨著打破技術壁壘的時間越來越近,未來限制人體克隆的將只有法律和道德風險。到時候克隆人的難度,可能會比單獨培養器官更加容易。一系列的社會問題,也可能隨之發生。
除了克隆技術外,還可以通過誘導多能干細胞培育器官。2006年,日本京都大學的研究團隊通過對老鼠體細胞進行誘導,將之轉化成了多能干細胞,標志著該技術真正可行。
但比起直接克隆來說,誘導多能干細胞往往更加漫長且低效。小鼠細胞的誘導需要1~2周,而人體細胞則需要3~4周,效率僅有0.01%~0.1%。除此之外,在對供體進行多能干細胞誘導時,還會導致較高的患癌風險。
/ 3D打印器官技術的難度主要在于器官血管的建造。 /
直到2008年,相關技術獲突破之后,誘導多能干細胞的研究才有了更多的突破希望。當前,誘導多能干細胞技術正在往器官再生方向積極探索,例如日本有研究團隊,嘗試通過誘導多能干細胞技術,在豬的身上培植人體器官。
雖然日本在這方面的研究前沿而且大膽,但距離臨床運用依舊十分遙遠。
在所有再造器官技術中,距離臨床運用最近的,可能是3D器官打印。3D器官打印是以生物相容性塑料作為支架,打印相應的干細胞,然后轉移到孵化室培育成相應的器官。
雖然3D打印技術在1984年就已被發明,但直到1990年以后,隨著納米技術的運用,以及生物活性材料技術的發展,該技術才開始走入醫學領域,并有了“3D器官打印”的概念。
雖然該技術已經在心臟模型、血管網絡、皮膚上進行過諸多嘗試,但迄今為止,唯一成功移植的3D打印器官只有膀胱。3D打印器官技術的難度主要在于器官血管的建造。
血管的主要功能是運輸營養、氧氣以及廢物,對維持器官正常的新陳代謝有著至關重要的作用。而血管尤其是毛細血管的建造,有著極高的難度,這涉及極其復雜的幾何學難題。
除了血管構建難度之外,3D器官打印的干細胞來源也是一個問題。并不是所有病人器官的干細胞都能被使用。當然,在不久的將來,治療性克隆技術以及誘導多能干細胞技術足夠成熟,也可以為3D器官打印提供足夠的干細胞源。
屆時,器官再生技術,將進入技術全面爆發的時代。

