T淋巴細胞在骨關節炎中作用的研究進展
陳龑,薛艷,蔣鼎,沈雪,李名,趙福濤,曹月龍
(1.上海中醫藥大學附屬曙光醫院骨傷研究所,上海 201203; 2.上海交通大學醫學院附屬第九人民醫院風濕免疫科,上海 201999)
骨關節炎是最常見的關節疾病[1],其病理特征包括軟骨退化、骨贅形成、軟骨下骨改變以及滑膜炎癥等[2-3]。20世紀中期以來,骨關節炎的患病率一直居高不下[4],在世界范圍內約10%的男性和18%的女性受累,而每年新增的骨關節炎患者也呈上升趨勢[5]。骨關節炎疾病負擔較重,若患者得不到有效的診治,則可能嚴重影響患者的生活質量,甚至導致殘疾或需要進行關節置換[6]。傳統研究認為,骨關節炎與個體和關節層面的因素有關,如性別、年齡、肥胖、遺傳、種族、民族以及關節損傷、關節錯位、關節負荷異常等[7],但另有研究表明,骨關節炎不僅與以上因素相關,還與免疫因素相關[8]。目前已在骨關節炎患者的關節中發現了各種免疫應答細胞,如巨噬細胞、肥大細胞、自然殺傷細胞、B淋巴細胞和T淋巴細胞等。T淋巴細胞在機體適應性免疫環節中發揮重要作用。在疾病微環境狀態改變下,被激活的T淋巴細胞產生大量細胞因子和炎癥介質,T淋巴細胞與骨關節炎的發生、發展及轉歸密切相關[9-10]。因此,了解T淋巴細胞在疾病狀態下的激活機制和干預過程,有助于找到調控T淋巴細胞的作用靶點,從而達到控制疾病進展和治療的目的。現就T淋巴細胞在骨關節炎中的作用予以綜述。
1 T淋巴細胞的作用機制
1.1T淋巴細胞與滑膜 在骨關節炎發病初期軟骨碎片落入關節中,免疫細胞被激活并募集到滑膜組織產生炎癥介質,如白細胞介素(interleukin,IL)-1β和腫瘤壞死因子(tumor necrosis factor,TNF)等,因此,骨關節炎患者的滑膜組織中存在炎癥因子浸潤,且滑膜炎的嚴重程度與骨關節炎癥狀及疾病進展密切相關[11]。早在20世紀80年代,Lindblad和Hedfors[12]就在骨關節炎患者的軟骨與滑膜交界附近區域發現了T淋巴細胞灶,而表達激活抗原的T細胞亞群也在后續的研究中逐漸被發現[13-14]。Sakkas等[15]通過免疫組織化學分析以及聚合酶鏈反應證實,65%的骨關節炎患者滑膜組織中有淋巴樣細胞聚集,滑膜組織中可見處于各分期的T淋巴細胞,早期活化的T淋巴細胞表達CD69,中間期活化的T淋巴細胞表達CD25和CD3,晚期活化的T淋巴細胞表達CD45RO和人類白細胞抗原Ⅱ類抗原。Hsieh等[16]通過CD8+T淋巴細胞基因敲除(CD8-/-)小鼠和前十字韌帶橫切術(anterior cruciate ligament transaction,ACLT)手術模型發現,與ACLT組小鼠相比,第90天CD8-/-/ACLT組小鼠滑膜組織增生、肥大以及肉芽組織的增殖病變均減輕。提示滑膜組織中的T淋巴細胞與骨關節炎進展具有相關性,但具體機制目前尚不明確。有研究顯示,T淋巴細胞的募集可能與酶促過程相關,學者利用酶聯免疫吸附法檢測培養T淋巴細胞缺失的滑膜細胞上清液發現,T淋巴細胞缺失導致基質金屬蛋白酶(matrix metalloproteinase,MMP)-1、MMP-3和MMP-9水平均降低[17]。表明滑膜中激活的T淋巴細胞可誘導MMP釋放、加速軟骨破壞過程。
1.2T淋巴細胞與軟骨 關節軟骨主要由軟骨細胞和細胞外基質組成,軟骨基質降解是骨關節炎疾病發展的重要標志。軟骨基質降解的主要過程由酶促過程介導,這一酶促過程由MMP和血小板反應蛋白解整合素金屬肽酶驅動,MMP和血小板反應蛋白解整合素金屬肽酶能降解軟骨的主要成分(如膠原蛋白和聚集蛋白聚糖)[18-19]。Nakamura等[20]通過研究共培養人骨關節炎軟骨細胞與自體T淋巴細胞發現,培養基內MMP-1、MMP-3和MMP-13水平均升高。另有研究從骨關節炎患者外周血中分離出了耐受性樹突狀細胞,在脂多糖刺激下,耐受性樹突狀細胞可以誘導T淋巴細胞分化,且耐受性樹突狀細胞和分化的T淋巴細胞可以協同抑制軟骨細胞分泌MMP-1和MMP-13[21]。軟骨細胞表面具有抗原呈遞特性,可共享人類白細胞抗原、血管細胞黏附分子-1和細胞間黏附分子-1[22-23],因此可以黏附于T淋巴細胞等其他細胞。由此推測,MMP的增加可能與軟骨細胞、T淋巴細胞表面的CD和人類白細胞抗原分子介導的黏附反應相關,但目前尚缺乏進一步的體內試驗驗證這一觀點。Shen等[24]通過研究ACLT的骨關節炎模型,發現CD4+T細胞激活可以誘導巨噬細胞炎癥蛋白-1γ和核因子κB的表達,這一結論在后續敲除CD4+T淋巴細胞的B6小鼠模型中也得到了證實。由此推測,CD4+T淋巴細胞在骨關節炎發病早期被激活,并通過誘導巨噬細胞炎癥蛋白-1γ表達使骨關節炎進一步發展。另外,T淋巴細胞還可通過金屬蛋白酶組織抑制劑-1的持續表達調節血管生成和軟骨破壞。如Hsieh等[16]通過研究敲除CD8+T淋巴細胞的骨關節炎小鼠模型發現,與野生型小鼠相比,CD8-/-骨關節炎模型小鼠軟骨變性程度發展緩慢;造模第90天時檢測發現,CD8-/-的骨關節炎模型小鼠關節中血管內皮生長因子、金屬蛋白酶組織抑制物-1和MMP-13水平均升高。由此可見,T淋巴細胞激活后與軟骨細胞發生黏附反應,并誘導相關炎癥蛋白產生,導致軟骨基質降解、破壞。
1.3T淋巴細胞與軟骨下骨 軟骨下骨由軟骨下骨板和軟骨下骨小梁組成。骨關節炎初期,應力導致軟骨下骨小梁微骨折,這些微骨折啟動了骨重塑,即成骨細胞與破骨細胞之間的動態平衡被打破,可進一步導致骨關節炎的發生、發展。T淋巴細胞在軟骨下骨聚集,可能打亂骨重塑的動態偶聯平衡狀態。Shen等[24]研究表明,在ACLT的骨關節炎小鼠模型中,造模1個月后即發現CD4+T淋巴細胞不僅滲入滑膜,還出現在軟骨下骨中。Chen等[25]通過檢測50例骨關節炎患者的軟骨下骨發現了肥大細胞和CD8+T淋巴細胞聚集。核因子κB受體活化因子配體(receptor activator for nuclear factor-κB ligand,RANKL)作為骨轉換和炎癥密切相關的轉錄因子,可影響成骨細胞功能,而活化的T淋巴細胞可過表達RANKL,高水平的RANKL侵入軟骨下骨可直接影響骨吸收,導致軟骨下骨代謝障礙[26]。在機械負荷異常的情況下,軟骨下骨可能會發生骨髓水腫,而骨髓水腫是骨關節炎患者磁共振成像早期診斷特征,與骨關節炎患者疼痛的嚴重程度密切相關[27]。Zhu等[28]利用維生素D在骨關節炎中的效應研究數據對192例骨關節炎患者的炎癥細胞因子進行分析,結果發現,IL-6、IL-17和IL-23等水平升高與患者骨髓水腫面積相關。Kuttapitiya等[29]利用微陣列分析對72例行關節置換的晚期骨關節炎患者的關節組織進行檢測,結果發現,骨關節炎患者骨髓病變區域細胞與健康人群組織轉錄組的表達存在差異,骨關節炎轉錄組多處于細胞因子信號轉導通路和T淋巴細胞活化過程。可見,T淋巴細胞參與軟骨下骨病變過程,可能通過釋放相關炎癥因子以及核因子κB受體活化因子(receptor activator for nuclear factor-κB,RANK)/RANKL通路激活破骨細胞,影響軟骨下骨的骨吸收和骨代謝功能。
2 T淋巴細胞與骨關節炎
2.1輔助性T細胞(helper T cell,Th)1/Th2比例失衡 Th1/Th2細胞是一組互相作用的效應性T細胞,其比例失衡是骨關節炎發展的因素之一。Th1細胞主要產生TNF-β、γ干擾素(interferon-γ,IFN-γ)和IL-2等細胞因子,而Th2細胞主要產生IL-4,IL-4可抑制Th1細胞的功能[30]。Rosshirt等[31]分析55例終末期膝骨關節炎患者的滑膜、滑液和外周血樣品發現,與外周血相比,滑液中的免疫調節細胞因子(如IFN-γ、IL-2和IL-10)水平均顯著升高,但IL-4水平降低,大量T淋巴細胞被極化為CD3+、CD4+和CD8+T細胞亞群,其中Th1細胞增加最為顯著。Lùrati等[32]運用流式細胞術檢測注射透明質酸患者外周血中Th1細胞水平,結果發現,活化的Th1細胞水平顯著高于健康對照者。可見,Th1細胞在骨關節炎患者病灶中富集,且可能通過RANKL/RANK信號通路激活軟骨下骨破骨細胞而加速炎癥反應。Monasterio等[33]研究證實,Th1/Th2細胞比例失衡后產生的系列細胞因子通過干擾RANKL/RANK信號通路,并誘導破骨細胞形成而加速炎癥反應,導致骨關節炎患者的病情進一步加重。Th1細胞分泌的IL-2和TNF-α對破骨細胞均有激活作用,其中TNF-α可延緩破骨細胞的存活,加重軟骨下骨骨質破壞,骨質發生重建,進而導致新的骨贅形成[34-35]。Castrogiovanni等[36]對ACLT模型大鼠進行體育鍛煉治療,通過檢測滑膜分析發現,與骨關節炎模型大鼠相比,ACLT模型大鼠的IL-4和IL-10水平均顯著升高,而TNF-α和MMP-13水平降低。He等[37]發現,IL-4基因敲除的小鼠MMP-13水平降低。以上研究表明,Th1/Th2細胞比例失衡可激活破骨細胞、加速炎癥反應,并導致軟骨基質降解,破壞軟骨細胞外穩態。
2.2Th17/調節性T細胞(regulatory T cell,Treg細胞)比例失衡 Th17細胞和Treg細胞是一對作用相反的T細胞亞群,Th17/Treg細胞比例失衡與骨關節炎的病情進展相關。Zhu等[38]收集了30例骨關節炎患者的外周血,運用流式細胞儀建立譜系亞群和單克隆抗體標記,結果顯示,美國西部Ontario與McMaster大學骨關節炎指數疼痛評分與CD3+CD4+CXCR5-PD-1+T細胞和Th17細胞均呈正相關。Poursamimi等[39]研究顯示,與安慰劑組(空白對照)相比,用藏紅花治療的骨關節炎患者外周血中Th17細胞的水平顯著降低,但Treg細胞水平則升高。Ponchel等[40]對114例骨關節炎患者與121例健康對照者的血液進行分析發現,調整患者年齡差異后,骨關節炎患者的Treg細胞水平較健康對照者顯著降低。而在骨關節炎患者的滑膜中同樣發現了CD+T細胞向Th17細胞分化的現象[41]。上述研究說明,骨關節炎患者體內存在Th17/Treg細胞比例失衡,Th17細胞在骨關節炎患者中聚集可能影響骨關節炎的進展。Th17細胞主要分泌IL-17,而IL-17是炎癥早期啟動因子之一,具有強大的促炎效應。有研究通過檢測骨關節炎患者的滑膜組織發現IL-17信使RNA高表達,且與健康者相比,骨關節炎患者滑液中的IL-17水平高于檢測閾值[42]。在動物研究中,與骨關節炎模型小鼠相比,IL-17基因缺乏的小鼠軟骨損傷程度更低[43]。IL-17的作用主要是促進軟骨降解和破壞,其通過誘導軟骨細胞趨化因子釋放導致軟骨變形,而IL-17與TNF-α協同作用可促進軟骨破壞,進一步增加MMP釋放,促進軟骨基質降解;IL-17還可通過核因子κB通路致使破骨細胞活化,導致骨形成與骨破壞失衡[44-45]。而Treg細胞則可抑制Th17細胞分化,調節成骨細胞活化[46];同時,Treg細胞還可分泌轉化生長因子-β和IL-10細胞因子,抑制自身反應性淋巴細胞的功能,發揮免疫抑制作用[47]。
2.3其他T細胞亞群與骨關節炎
2.3.1Th9細胞與骨關節炎 Th9細胞是近年發現的一種新型效應CD+T淋巴細胞亞群,主要以分泌細胞因子IL-9為特征。Kundu-Raychaudhuri等[48]研究發現,在骨關節炎患者的外周血和滑液中檢測到高水平的IL-9,但其水平低于類風濕關節炎患者。另有研究發現,與健康人群相比,骨關節炎患者的Th9細胞數量與血清IL-9水平均顯著升高,且差異有統計學意義[40];IL-9水平和Th9細胞數量與西安大略麥克馬斯特大學骨關節炎指數評分呈正相關[42]。以上研究提示,骨關節炎患者的病情程度、關節功能情況與IL-9水平相關。IL-9在維持和增加炎癥微環境中起作用,有吸引炎癥細胞遷移的功能;且IL-9還可誘導T淋巴細胞、樹突狀細胞、肥大細胞和自然殺傷細胞增殖[49]。但目前的研究尚局限于觀察水平,缺乏動物實驗的驗證,無法揭示Th9細胞與骨關節炎的直接關系,且Th9細胞與T細胞亞群的相互聯系和特定作用也尚不清楚,仍需進一步研究。
2.3.2濾泡輔助性T細胞(follicular helper T cell,Tfh細胞)與骨關節炎 Tfh細胞是一種獨立的CD4+T效應細胞亞群,通過協助B淋巴細胞的分化在體液免疫應答過程中起作用。Zhu等[38]的臨床研究證實,隨著骨關節炎病情的加重,西安大略麥克馬斯特大學骨關節炎指數評分與Tfh細胞的表達呈正相關。Tfh細胞表面表達B細胞淋巴瘤/白血病-6,B細胞淋巴瘤/白血病-6可抑制軟骨細胞周期轉錄功能,進而導致細胞凋亡[50]。Tfh細胞分泌的IL-21可以與干細胞因子協同刺激人類自然殺傷細胞的成熟和活化,并誘導IFN-γ及Th1細胞相關轉錄因子T-bet基因表達,激活記憶T細胞,增加IFN-γ的產生和細胞毒性,促進炎癥因子釋放,導致骨關節炎加重或促進軟骨基質降解、刺激軟骨細胞壞死凋亡和滑膜炎的產生[51-52]。Askari等[53]通過檢測骨關節炎患者的血清發現,骨關節炎患者血清中的IL-21、IL-17和IFN-γ水平均顯著高于健康對照者,間接說明了Tfh細胞與Th1細胞之間存在協同作用,但目前缺乏動物實驗探討Tfh細胞與Th1細胞相互作用的具體機制。
總之,T淋巴細胞在維持軟骨、滑膜和軟骨下骨組織穩態方面發揮重要作用,并影響骨關節炎的進展,具體的作用靶點和通路見圖1[54]。
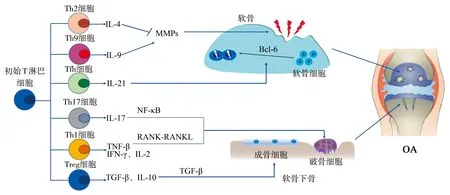
Th細胞:輔助性T細胞;Tfh細胞:濾泡輔助性T細胞;Treg細胞:調節性T細胞;IL:白細胞介素;TNF-β:腫瘤壞死因子-β;IFN-γ:γ干擾素;TGF-β:轉化生長因子-β;MMPs:基質金屬蛋白酶;NF-κB:核因子κB;RANK-RANKL:核因子κB受體活化因子-核因子κB受體活化因子配體;Bcl-6:B細胞淋巴瘤/白血病-6;OA:骨關節炎
3 小 結
骨關節炎的發生、發展是一個復雜的病理過程,不僅是簡單的關節磨損,還是一種異質性關節疾病。T淋巴細胞的活化與亞群失衡貫穿骨關節炎整個病理機制,可加快軟骨退化損傷,啟動軟骨下骨骨重塑、滑膜炎癥惡化以及骨贅形成。目前尚無抑制疾病進展的治療方法和策略,現有的治療手段僅限于治療疾病發作和控制進展期的癥狀。鑒于T淋巴細胞在骨關節炎發生、發展中的重要作用,未來應著重開展T淋巴細胞與骨關節炎方面的機制研究,以有助于進一步開發新型調節T淋巴細胞免疫藥物,逆轉骨關節炎病程惡化。關于免疫相關性骨關節炎的研究將為骨關節炎的早期治療提供新思路,明確病變過程中的關鍵靶點和信號分子通路是未來研究的關鍵。

