農桿菌介導禾本科牧草遺傳轉化的研究進展
張月 李瑩 戴紹軍
摘 ?要: 建立禾本科牧草的遺傳轉化體系對于種質資源利用具有重要意義.近年來,假儉草(Eremochloa ophiuroides)、黑麥草(Lolium perenne)、結縷草(Zoysia japonica)、柳枝稷(Panicum virgatum)、高羊茅(Festuca elata)、二穗短柄草(Brachypodium distachyum)、匍匐剪股穎(Agrostis stolonifera)、朝鮮堿茅(Puccinellia chinampoensis)、羊草(Leymus chinensis)、金發草(Pogonatherum paniceum)、雙花草(Dichanthium annulatum)等多種禾本科牧草遺傳轉化的轉化方法不斷得到優化與完善.該文總結了近年來禾本科牧草在遺傳轉化體系優化的研究進展,探討了植物受體材料、轉化條件、共培養時間、乙酰丁香酮濃度、抑菌劑濃度、篩選劑選擇壓等因素對轉化效率的影響.
關鍵詞: 禾本科牧草; 遺傳轉化; 影響因素
中圖分類號: Q 939.9 ???文獻標志碼: A ???文章編號: 1000-5137(2021)01-0021-07
Abstract: The establishment of a genetic transformation system for gramineous forages is of great significance to the utilization of germplasm resources.In recent years,the genetic transformation methods of various gramineous forages such as Eremochloa ophiuroides,Lolium perenne,Zoysia japonica,Panicum virgatum,Festuca elata,Brachypodium distachyum,Agrostis stolonifera,Puccinellia chinampoensis,Leymus chinensis,Pogonatherum paniceum and Dichanthium annulatum have been continuously optimized.This article summarized the recent research progress in the optimization of the genetic transformation systems of gramineous forages,and discussed the effects of plant receptor material,transformation condition,co-cultivation time,acetosyringone concentration,bacteriostatic agent concentration,selection pressure of screening agents and other factors on the transformation efficiency.
Key words: gramineous forage; genetic transformation; effect factors
0 ?引 言
利用植物轉基因技術將目的基因導入植物基因組是改良植物性狀的重要方法之一.建立穩定高效的植物遺傳轉化體系是獲得轉基因植株的前提.ZAMBRYSKI等[1]以根癌農桿菌Ti質粒為轉化載體,將T-DNA上的基因轉入煙草細胞,成功獲得了第一株轉基因煙草(Nicotiana tabacum L.),此后植物遺傳轉化技術得到迅速發展.植物遺傳轉化的方法主要包括農桿菌轉化法、基因槍法、花粉管通道法、細胞融合劑介導(PEG)法、電轉化法等.與其他方法相比,農桿菌轉化法具有易操作、費用低、轉化效率高、基因拷貝數低、可轉移較大的DNA片段(50 kb)等優點,逐漸成為植物遺傳轉化最常用的方法.農桿菌介導的轉化系統是一種天然的基因轉化系統[2],農桿菌Ti質粒上的T-DNA可通過植物材料上的傷口進入植物體內并整合到基因組上,經植物有性生殖過程穩定遺傳給后代.
由于包括禾本科植物在內的單子葉植物不是農桿菌的天然宿主,利用農桿菌介導法對其進行遺傳轉化的研究受到限制[3].HIEI等[4]構建了VlrG和VxB高效表達的超雙元載體,通過借助酚類化合物乙酰丁香酮誘導成功建立了水稻(Oryza sativa)遺傳轉化體系,推動了農桿菌介導單子葉遺傳轉化的研究進程.通過對轉化機理的深入探索,以及對轉化方法的不斷改進、優化與完善,農桿菌轉化法已成為介導禾本科作物的常用手段.近年來,利用農桿菌轉化法建立了禾本科重要糧食作物水稻[5]、玉米(Zea mays)[6]、小麥(Triticum spp.)[7]、大麥(Hordeum vulgare)[8]、高粱(Sorghum bicolor)[9],以及主要糖類作物甘蔗(Saccharum officinarum)[10]等的遺傳轉化系統,并獲得了具有各種優良性狀的轉基因植物.禾本科植物遺傳轉化體系的建立為研究植物基因功能、植物發育與逆境應答分子調控機制,以及開展分子設計育種提供了理論依據和技術支撐.
禾本科牧草具有耐踐踏、再生能力強的特點,可作為生物燃料、能源作物,以及牲畜的能量飼料和綠化植物.此外,禾本科牧草在草原生態系統中具有水土保持、防風固沙的作用.近年來,隨著生物技術的不斷發展,國內外轉基因牧草研究也取得了明顯進展.利用農桿菌介導法建立了禾本科牧草黑麥草[11]、結縷草[12]、柳枝稷[13]、高羊茅[14]、二穗短柄草[15]、匍匐剪股穎[16]等遺傳轉化體系,獲得了具有優良性狀的轉基因牧草,在牧草改良方面得到了廣泛應用.
植物受體材料、轉化條件、共培養時間、乙酰丁香酮濃度、抑菌劑濃度、篩選劑選擇壓等因素對農桿菌介導遺傳轉化都有一定影響.本文作者將系統介紹各因素對農桿菌介導的禾本科植物遺傳轉化體系的影響.
1 ?植物受體的選擇
植物受體的選擇是影響農桿菌轉化的一個重要因素.分裂時期細胞具有分生能力強、生長旺盛的特點,選擇分裂時期的組織器官或細胞作為轉化受體可獲得較高的轉化效率,轉化后植株的再生能力較強.農桿菌轉化過程中,常用的受體材料包括胚性愈傷組織、幼胚、成熟胚、胚芽、莖尖、葉片等.對于不同植物,隨最適外植體的選擇不同,轉化效率也存在明顯差異.在假儉草遺傳轉化體系中,以種質“E126”的側芽誘導的胚性愈傷組織作為受體材料,經農桿菌轉化后獲得了3.6%的轉化率[17];農桿菌介導的黑麥草遺傳轉化過程中,將成熟胚誘導的胚性愈傷組織作為受體材料,獲得了4.8%的轉化效率[18];柳枝稷遺傳轉化過程中,利用Alamo品種成熟種子誘導的胚性愈傷組織作為受體材料,轉化效率為6%[19];利用匍匐剪股穎種子誘導的胚性愈傷組織作為受體材料,轉化效率高達40%,這暗示著利用胚性愈傷組織作為受體材料的遺傳轉化轉化效率最高[16].此外,莖段具有直接生成不定芽的能力,選擇結縷草直接莖段作為受體材料可以獲得6.8%的轉化效率[20].由此可見,對于禾本科植物而言,選擇分裂能力旺盛、細胞活性高、DNA合成能力強的胚性細胞作為受體材料,更有利于農桿菌與T-DNA整合,從而提高轉化效率.
2 ?轉化條件及共培養時間
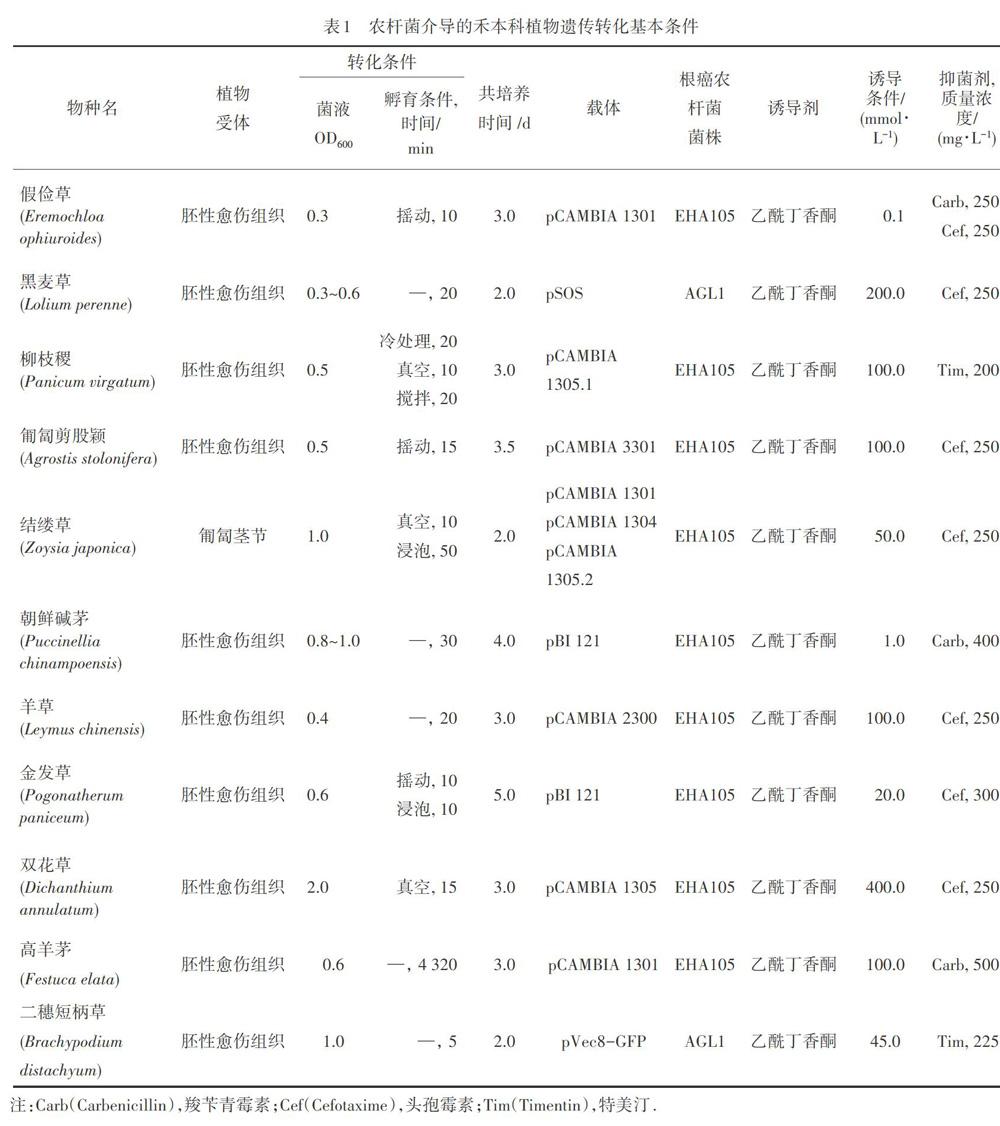
農桿菌介導的遺傳轉化體系中受體材料的轉化條件與共培養時間對轉化效率有明顯影響.侵染方法不恰當會使農桿菌轉化效率降低,侵染時間過短會使農桿菌不能充分依附到受體材料上,導致T-DNA整合效率低,侵染時間過長則容易導致農桿菌過度繁殖,抑菌難度增加,甚至導致受體材料會因農桿菌毒害而死亡.共培養時間影響農桿菌吸附和T-DNA轉移[21].農桿菌必須附著在創傷部位16 h以上才能完成轉移過程[22].不同作物的最優轉化條件與共培養時間存在差異,同一作物不同受體材料的最優轉化條件與共培養時間也不同.摸索合適的轉化條件與共培養時間是建立高效轉化系統所必須的(表1).
可利用冷處理、攪拌孵育和真空處理等手段提高轉化效率.在朝鮮堿茅遺傳轉化體系建立過程中,使用含有二元載體pBI 121的根癌農桿菌菌株EHA105進行轉化,當菌液在600 nm波長處的吸光度值(OD600)達到0.8~1.0時,對成熟種子誘導的胚性愈傷組織浸泡孵育30 min可以達到最佳轉化效果[23];對柳枝稷胚性愈傷組織進行遺傳轉化時,使用含二元載體pCAMBIA 1305.1的根癌農桿菌菌株EHA105,將冷處理20 min后的胚性愈傷組織浸入OD600值為0.5的農桿菌菌液中,經過真空孵育10 min,攪拌孵育20 min,共培養3 d后,其轉化效率最高為72.8%[24].這表明:在農桿菌轉化前對愈傷組織進行冷處理,可大幅度減少農桿菌侵染后愈傷組織的褐變[25];而轉化過程中對愈傷組織進行真空和攪拌孵育對提高轉化效率有促進作用,主要因為真空處理可增加愈傷組織表面創傷,使農桿菌更容易進入到愈傷組織內并整合到植物基因組上,攪拌處理則是通過增大愈傷組織與農桿菌的接觸面積提高轉化效率.
在農桿菌轉化前對愈傷組織進行預培養,可改善愈傷組織的生長狀態,有利于獲得最佳轉化效率.在建立羊草遺傳轉化體系時,使用攜帶Ib2-Cys prx基因的載體pCAMBIA 2300轉化根癌農桿菌菌株EHA105,活化菌液至OD600值為0.4,將預培養7 d后的胚性愈傷組織浸入農桿菌菌液孵育20 min,最優轉化條件為共培養3 d,獲得8.97%的轉化效率[26].這表明:生長狀態良好、分化力強的愈傷組織具有活躍的基因整合能力,明顯有利于提高轉化效率.
在農桿菌介導的轉化過程中,不同受體材料的最適轉化條件存在差異.在黑麥草遺傳轉化體系中,使用農桿菌AGL1轉化攜帶SOS1,SOS2,SOS3,CBL10和BAR基因的耐鹽多基因植物表達載體pSOS,將成熟種子誘導的胚性愈傷組織浸泡在OD600值為0.3~0.6的農桿菌菌液中孵育20 min,經2 d共培養后得到22.8%的最高轉化效率[27];而在農桿菌介導結縷草匍匐莖節進行遺傳轉化過程中,將二元載體pCAMBIA 1301,pCAMBIA 1304和pCAMBIA 1305.2導入根癌農桿菌菌株EHA105用于轉化,將莖節浸泡在OD600值為1.0的農桿菌菌液中真空孵育10 min,然后浸泡孵育50 min,共培養2 d后,其轉化效率最高為10.5%~13.7%[20].
3 ?乙酰丁香酮濃度
在農桿菌轉化植物材料的過程中需要酚類化合物誘導完成,僅靠植物材料自身分泌是遠遠不夠的,需要人為添加.乙酰丁香酮是農桿菌轉化單子葉植物過程中常用的酚類化合物.乙酰丁香酮通過誘導農桿菌Vir區VirA基因自身磷酸化,并激活VirG基因產物,從而激活其他Vir基因轉錄,增強T-DNA加工與轉移,使農桿菌T-DNA更容易進入植物基因組并與其整合[28-29].共培養階段是T-DNA轉移和整合的關鍵時期.
不同植物的遺傳轉化體系中的乙酰丁香酮濃度存在差異.建立金發草遺傳轉化體系時,選擇物質的量濃度為20 μmol?L-1的乙酰丁香酮加入共培養基中作為最優轉化條件[30];結縷草遺傳轉化體系建立的過程中,在共培養的培養基中添加50 μmol?L-1的乙酰丁香酮達到最大轉化率[31].農桿菌介導的黑麥草遺傳轉化過程中,通過在共培養基中添加200 μmol?L-1的乙酰丁香酮誘導以提高轉化效率[11].在農桿菌轉化雙花草時則選擇在共培養的培養基中添加400 μmol?L-1的乙酰丁香酮[32].在柳枝稷、高羊茅和匍匐剪股穎的遺傳轉化過程中,都選擇了100 μmol?L-1作為乙酰丁香酮的最適合物質的量濃度[33-34,16].
4 ?抑菌劑濃度
共培養后的一個重要環節就是抑菌處理.共培養后受體材料表面及淺層組織中共生有大量農桿菌.為了殺死和抑制農桿菌的生長必須進行脫菌處理,以免影響外植體再生.抑菌劑濃度是遺傳轉化系統中的一個重要因素.抑菌劑濃度過高會抑制外植體生長甚至造成外植體死亡,濃度過低則起不到抑菌作用.常用的抑菌劑包括特美汀(Tim)、頭孢霉素(Cef)和羧芐青霉素(Carb)等.與Cef和Carb相比,Tim對植物材料影響較小,在胚性愈傷組織再生系統中能達到很好的抑菌和再生效果,是組培實驗中的首選抑菌劑.在組培過程中,可以根據植物材料受體的特點選擇抑菌劑并摸索抑菌劑濃度.二穗短柄草遺傳轉化過程中,在培養基中添加質量濃度為225 mg?L-1的Tim進行抑菌處理[35];黑麥草遺傳轉化過程中選擇200 mg·L-1的Cef作為最適抑菌劑[11];結縷草遺傳轉化在抑菌階段選擇250 mg?L-1的Cef進行抑菌處理[36];假儉草愈傷組織的抑菌處理則選擇250 mg·L-1的Carb和250 mg?L-1的Cef結合,以達到最好的抑菌效果[37].
5 ?篩選劑及篩選壓選擇
在農桿菌介導的遺傳轉化過程中,只有少數植物細胞能夠吸收外源DNA并將其整合到植物基因組中,大多數細胞仍是未被轉化的.可以利用質粒載體上帶有的特定選擇性標記,通過相應的篩選劑篩選被轉化的細胞.篩選劑的作用是抑制非轉化細胞生長,而對轉化細胞無抑制作用,從而保證快速、有效地從大量轉化群體中篩選到含有外源目的基因的轉化體.不同植物在農桿菌介導過程中所用的質粒載體不同,所以其適用的篩選劑有所差異.不同受體材料對篩選劑的敏感程度和毒害忍耐程度差異較大,并且受體材料在光/暗培養條件下其篩選壓也不同.因此,在建立農桿菌介導的植物遺傳轉化體系中,確定適合的篩選壓是基因轉化成敗的關鍵[38].在選擇篩選壓時,要保證在不損傷受體材料的前提下篩選出抗性受體.選擇培養過程中,篩選劑會降低受體組織的再生能力,增加褐化率或白化率.所選擇的篩選壓應該既能有效抑制非抗性細胞的生長,使之緩慢死亡,又不抑制抗性細胞的生長.目前廣泛使用的篩選劑包括潮霉素(Hyg)、卡那霉素(Kana)、草酊磷(PPT)等.
在假儉草遺傳轉化體系中,用帶有hpt選擇標記基因的pCAMBIA 1301質粒載體進行轉化,篩選時愈傷組織的篩選壓為質量濃度為100 mg?L-1的Hyg B,陽性芽的篩選壓為50 mg?L-1的Hyg B,生根時則不添加Hyg B[37].在農桿菌介導的羊草遺傳轉化過程中,選擇攜帶npt II抗性基因的pCAMBIA 2300質粒載體進行轉化,愈傷組織篩選和再生苗的篩選均選擇150 mg?L-1的Kana作為最適篩選壓[26].在匍匐剪股穎的遺傳轉化體系中使用帶有bar選擇標記基因的pCAMBIA 3301質粒載體進行農桿菌轉化,篩選過程中以5 mg?L-1的PPT作為抗性芽的篩選壓,10 mg?L-1的PPT作為生根的篩選壓[39].
6 ?結 語
禾本科牧草作為牲畜飼料、綠化植物、生物燃料和能源作物,具有巨大的經濟價值和生態功能.利用轉基因技術可將禾本科牧草自身不具有的優良外源基因導入植物基因組,實現僅靠傳統育種無法實現的遺傳重組,定向改造植物遺傳性狀.農桿菌介導法構建植物遺傳轉化體系的影響因子很多,不同植物材料的遺傳轉化條件差異較大.基于基本的農桿菌介導轉化機理,不斷改進轉化方法,提高轉化效率,不斷建立新物種的轉化方法,對于研究禾本科牧草發育與逆境應答機制具有重要意義,也是開展基因編輯分子設計育種的基礎.
參考文獻:
[1] ZAMBRYSKI P,JOOS H,GENETELLO C,et al.Ti plasmid vector for the introduction of DNA into plant cells without alteration of their normal regeneration capacity [J].The EMBO Journal,1983, 2(12):2143-2150.
[2] 張紅霞,鄧啟云,吳俊.農桿菌介導水稻轉基因技術的原理與應用研究進展 [J].湖南農業科學,2010,11(6):3-6.
ZHANG H X,DENG Q Y,WU J.The Principles and the application advances of Agrobacterium mediated rice transgenic techniques [J].Hunan Agricultural Sciences,2010,11(6):3-6.
[3] SINGH R K,PRASAD M.Advances in Agrobacterium tumefaciens-mediated genetic transformation of graminaceous crops [J].Protoplasma,2016,253(3):691-707.
[4] HIEI Y,OHTA S,KOMARI T,et al.Efficient transformation of rice(Oryza sativa L.) mediated by Agrobacterium and sequence analysis of the boundaries of the T-DNA [J].The Plant Journal,1994,6(2):271-282.
[5] TOUCHKANIN J,KAWEE S,SITTICHAI U.Application of sonication and vacuum infiltration-assisted Agrobacterium-mediated transformation of rice embryo(Oryza sativa L.) [J].ScienceAsia,2020,46:412-419.
[6] SOYZA R A V D,MEIRE C A,CARNEIRO N P,et al.Agrobacterium-mediated genetic transformation of a tropical elite maize line [J].Crop Breeding and Applied Biotechnology,2016,17(2):133-140.
[7] WANG K,GONG Q,YE X.Recent developments and applications of genetic transformation and genome editing technologies in wheat [J].Theoretical and Applied Genetics,2020,133(2):1603-1622.
[8] NATALIYA K,WEI J,OMID E,et al.Optimization of TaDREB3 gene expression in transgenic barley using cold-inducible promoters [J].Plant Biotechnology Journal,2013,11(6):659-670.
[9] WU E,LENDERTS B,GLASSMAN K,et al.Optimized Agrobacterium-mediated sorghum transformation protocol and molecular data of transgenic sorghum plants [J].Vitro Cellular and Developmental Biology Plant,2014,50:9-18.
[10] 李曉梅,王閔霞,秦廷豪,等.根癌農桿菌介導甘蔗遺傳轉化Bt(cry1Ab)基因 [J].生物技術通報,2013(2):100-105.
LI X M,WANG M X,QIN T H,et al.Genetic Transformation of Bt(cyr1Ab) Gene into sugarcane(Saccharum officinarum L.) mediated by Agrobacterium tumefacines [J].Biotechnology Bulletin,2013(2):100-105.
[11] ESMAEILI S,SALEHI H,KHOSH-KHUI M,et al.Isopentenyl transferase(IPT) gene transfer to perennial ryegrass through sonication-assisted Agrobacterium-mediated transformation(SAAT),vacuum and heat treatment [J].Molecular Biotechnology,2019,61(5):332-344.
[12] 王凱,汪毅,曲愛愛,等.溝葉結縷草遺傳轉化體系的建立 [J].熱帶作物學報,2020,41(8):1566-1573.
WANG K,WANG Y,QU A A,et al.Establishment of genetic transformation system for Zoysia matrella [J].Chinese Journal of Tropical Crops,2020,41(8):1566-1573.
[13] 劉燕蓉,岑慧芳,嚴建萍,等.農桿菌介導的柳枝稷遺傳轉化體系的優化 [J].中國農業科學,2016,49(1):80-89.
LIU Y R,CEN H F,YAN J P,et al.Optimizing of Agrobacterium-mediated transformation of switchgrass cultivars [J]. Scientia Agricultura Sinica,2016,49(1):80-89.
[14] TAKAMIZO T,SATO H.Protocol for Agrobacterium-mediated transformation of tall fescue and future perspective on the application of genome editing [J].Plant Biotechnology,2020,37(2):157-161.
[15] ALVES S C,WORLAND B,THOLE V,et al.A protocol for Agrobacterium-mediated transformation of Brachypodium distachyon community standard line Bd21 [J].Nature Protocols,2009,4(5):638-649.
[16] KIM S J,LEE J Y,KIM Y M,et al.Agrobacterium-mediated high-efficiency transformation of creeping bentgrass with herbicide resistance [J].Journal of Plant Biology,2007,50(5):577-585.
[17] 張芳,王舟,宗俊勤,等.農桿菌介導的假儉草遺傳轉化體系的建立 [J].草業學報,2011,20(2):184-192.
ZHANG F,WANG Z,ZONG J Q,et al.Establishment of Agrobacterium mediated genetic transformation system of Eremochloa ophiuroides [J].Acta Prataculturae Sinica,2011,20(2):184-192.
[18] GE Y X,CHENG X F,ANDREW H,et al.Generation of transgenic Lolium temulentum plants by Agrobacterium tumefaciens-mediated transformation [J].Plant Cell Reports,2007,26(6):783-789.
[19] RENGASAMY R,PRAKASH P K.A simplified protocol for genetic transformation of switchgrass(Panicum virgatum L.) [J].Plant Cell Reports,2012,31(10):1923-1931.
[20] GE Y X,NORTON T,WANG Z Y.Transgenic zoysiagrass(Zoysia japonica) plants obtained by Agrobacterium-mediated transformation [J].Plant Cell Reports,2006,25(8):792-798.
[21] 張瑜,鄢家俊,白史且,等.農桿菌介導禾本科植物遺傳轉化的研究進展 [J].草業與畜牧,2016(4):4-9.
ZHANG Y,YAN J J,BAI S Q,et al.Progress of Agrobacterium-mediated genetic transformation in Gramineae [J].Journal of Grassland and Forage Science,2016(4):4-9.
[22] 李小紅,湯浩茹.草莓的遺傳轉化研究進展 [J].西華師范大學學報,2006,27(2):134-138.
LI X H,TANG H R.Advances on transformation of strawberries [J].Journal of China West Normal University(Natural Sciences),2006,27(2):134-138.
[23] WANG T,HAN X,ZHAO M Q,et al.Studies on construction of regeneration system and genetic transformation of Puccinellia chinampoensis [J].Bioscience Methods,2011.DOI:10.5376/bm.2011.02.0005.
[24] LIU Y R,CEN H F,YAN J P,et al.Inside out:high-efficiency plant regeneration and Agrobacterium-mediated transformation of upland and lowland switchgrass cultivars [J].Plant Cell Reports,2015,34(7):1099-1108.
[25] ZHANG W J,RALPH E D,WENDY B,et al.Enhanced Agrobacterium-mediated transformation efficiencies in monocot cells is associated with attenuated defense responses [J].Plant Molecular Biology,2013,81(3):273-286.
[26] SUN Y L,HONG S K.Agrobacterium tumefaciens-mediated transformation of the halophyte Leymus chinensis(Trin.) [J].Plant Molecular Biology Reporter,2012,30(5):1253-1263.
[27] 麻冬梅,郭林娜,金鳳霞,等.多年生黑麥草多基因遺傳轉化體系的建立與優化 [J].中國草地學報,2014,36(1):13-17.
MA D M,GUO L N,JIN F X,et al.Establishment and optimization of multi-genetic transformation system of perennial ryegrass [J].Chinese Journal of Grassland,2014,36(1):13-17.
[28] XI J,MINESH P,DONG S J,et al.Acetosyringone treatment duration affects large T-DNA molecule transfer to rice callus [J].BMC Biotechnology,2018,18(1):48.
[29] MANFROI E,YAMAZAKI E,GRANDO M F,et al.Acetosyringone,pH and temperature effects on transient genetic transformation of immature embryos of Brazilian wheat genotypes by Agrobacterium tumefaciens [J].Genetics and Molecular Biology,2015,38(4):470-476.
[30] 李美玉,李銳,于敏,等.根癌農桿菌介導的金發草遺傳轉化條件的優化 [J].中國生物工程雜志,2013,33(1):41-46.
LI M Y,LI R,YU M,et al.Optimization of genetic transformation conditions in Pogonatherum paniceum mediated by Agrobacterium tumefaciens [J].China Biotechnology,2013,33(1):41-46.
[31] TOYAMA K,BAE C H,KANG J G,et al.Production of herbicide-tolerant zoysiagrass by Agrobacterium-mediated transformation [J].Molecules and Cells,2003,16(1):19-27.
[32] KUMAR J,SHUKLA S M,BHAT V,et al.In vitro plant regeneration and genetic transformation of Dichanthium annulatum [J].DNA and Cell Biology,2005,24(11):670-679.
[33] LI R Y,QU R D.High throughput Agrobacterium-mediated switchgrass transformation [J].Biomass and Bioenergy,2011,35(3):1046-1054.
[34] QIAN H F,ALI S,LIANG H,et al.Establishment of genetic transformation system via Agrobacterium in tall fescue cultivar [J].Journal of Forestry Research,2006,17(3):238-242.
[35] PHILIPPE V,BARBARA W,VERA T,et al.Agrobacterium-mediated transformation of the temperate grass Brachypodium distachyon(genotype Bd21) for T-DNA insertional mutagenesis [J].Plant Biotechnology Journal,2008,6(3):236-245.
[36] KANG J N,PARK M Y,KIM W N,et al.Resistance of transgenic zoysiagrass overexpressing the zoysiagrass class II chitinase gene Zjchi2 against Rhizoctonia solani AG2-2(IV) [J].Plant Biotechnology Reports,2017,11(4):229-238.
[37] LIU M X,LU S Y,LIU L,et al.Agrobacterium-mediated transformation of centipedegrass(Eremochloa ophiuroides [Munro] Hack.) [J].Plant Cell,Tissue and Organ Culture,2012,109(3):557-563.
[38] 王芳,姜靜.不同抗生素對紫雨樺離體葉片愈傷組織誘導的影響 [J].西南林業大學學報,2014,34(3):27-31.
WANG F,JIANG J.Effects of different antibiotics on induction of Callus from the leaves of Betula pendual ‘Purple Rain [J].Journal of Southwest Forestry University(Natural Sciences),2014,34(3):27-31.
[39] HAN Y J,KIM Y M,LEE J Y,et al.Production of purple-colored creeping bentgrass using maize transcription factor genes Pl and Lc through Agrobacterium-mediated transformation [J].Plant Cell Reports,2009,28(3):397-406.
(責任編輯:顧浩然)

