超聲造影引導肺周圍性病變活檢的價值
劉 群,房秀霞
(內蒙古醫科大學附屬醫院超聲科,內蒙古 呼和浩特 010050)
肺癌是最常見的惡性腫瘤,其發病率不斷上升[1]。常規超聲可對肺部局灶性病變進行定位診斷,但難以確定其病理性質。超聲引導經皮肺穿刺活檢獲取病理組織的方法越來越受臨床歡迎及認可,特別是在危重病人中,超聲檢查可在急診室或病人床旁進行[2]。但是二維及彩色超聲有時不能顯示病變內的詳細結構,易造成假陰性,而超聲造影技術(contrast enhanced ultrasound,CEUS) 可顯示組織的微循環灌注,更清楚顯示病灶內部回聲及血流信息[3],因此本文研究超聲造影在肺周圍病變活檢的應用價值。
1 對象與方法
1.1 研究對象
所有入選病人在進行CEUS 和活檢之前均已簽署知情同意書。本研究共納入76 例病人,76 例病人均與胸膜相鄰,均有明顯的肺周圍部病變。選自2018-01~2020-06 在我院進行肺部病變活檢的病人。所有病人在活檢前均行常規超聲檢查,其中40例(男性22 例、女性18 例)活檢前行造影檢查為造影組,年齡在34~78歲之間;36例(男性20例、女性16 例)作為對照組,年齡在36~80 歲。如果病人患有嚴重心肺疾病,懷孕或哺乳,對造影劑過敏者或無法配合穿刺活檢者,則排除。
1.2 研究方法
1.2.1 儀器與試劑設備是LogiqE8(GE 公司,美國),頻率為3.5~5 MHz。造影劑是聲諾維(由意大利Bracco公司生產),主要成分為六氟化硫。
1.2.2 常規超聲與CEUS 檢查方法二維超聲顯示病灶大小、回聲和邊界,彩色多普勒顯示其血流分布,制定準確又安全的穿刺路線。造影組在常規超聲檢查后固定感興趣區再切換至超聲造影模式,用5 mL0.9%氯化鈉溶液溶解59mg聲諾維充分搖勻劑成懸液備用。將1.2mL的微泡混懸液團注入肘正中靜脈,然后用5 mL 0.9%氯化鈉溶液沖洗。連續至少3min觀察病變和鄰近組織(例如內臟胸膜或正常肺)的增強模式、擴清過程,記錄動態圖像資料并存儲。
1.2.3 穿刺活檢方法對照組在低回聲實性區且彩色多普勒顯示有血流的部位取材2 針,在懷疑有壞死區或無血流顯示區1針。造影組應通過病灶內超聲造影增強區域取材2 針,非增強區域1 針。CEUS和穿刺活檢是由至少有14 年經驗的同一位超聲科醫生進行。常規消毒、鋪巾及局麻后,在實時超聲引導下將穿刺針逐層刺入胸壁,接近胸膜時囑病人屏氣并快速取材,長度為15~22mm,每位病人取3條實性組織,分別將組織條均置于10%的福爾馬林固定液中標記并送檢。活檢后0.5h 對病人進行密切監測,無不適反應,安返病房。
1.2.4 圖像分析對每個病變區進行定量分析,并由兩名超聲科醫師繪制時間-強度曲線(TIC),他們都擁有至少3 年的CEUS 經驗。兩位醫生分析了所有CEUS 圖像,與鄰近的肺組織或胸膜相比,病變的增強程度(EE)分為高增強、等增強、低增強、無增強。增強模式(PE)分為均質增強、不均質增強。當腫物表現不均質增強時,具有最高增強的區域用于確定EE。始增時間(TE)定義為:病變同時增強或在鄰近肺、胸膜增強的2s內為早期,如果病變在鄰近肺、胸膜增強的2s 后觀察到,則為延遲增強。記錄了TIC 的以下參數:TE、達峰時間(TP)、峰值強度(EP)、下降至峰值一半的時間(MMT)、曲線下面積(AUC)和斜率。觀察病變之間增強模式的差異并分析每個參數鑒別良惡性病變的功效。
1.3 統計學方法
2 結果
造影組及對照組病灶平均直徑分別是(5.4 ±1.9)cm 和(5.1 ±1.9)cm,差異無統計學意義(P>0.05)。在直徑<3cm 的病變中,造影組和對照組的活檢陽性率差異無統計學意義(P>0.05);在直徑3~5cm 的病變中,造影組活檢陽性率略高于對照組,但差異無統計學意義(P>0.05);在>5cm 的病變中,造影組活檢陽性率顯著高于對照組,差異有統計學意義(P<0.05)。兩組均未出現嚴重并發癥,對照組有1例輕微咳血,未經特殊治療而自行好轉(見表1)。
根據病理結果,造影組惡性病灶30 例,良性10例;對照組惡性病灶25 例,良性11 例;造影組活檢陽性率為90%(36/40),對照組活檢陽性率為72.2%(26/36),差異有統計學意義(P<0.05)。造影組病灶壞死顯示率為47.5%(19/40),高于對照組5.6%(2/36),差異有統計學意義(P<0.05)(見表 2)。
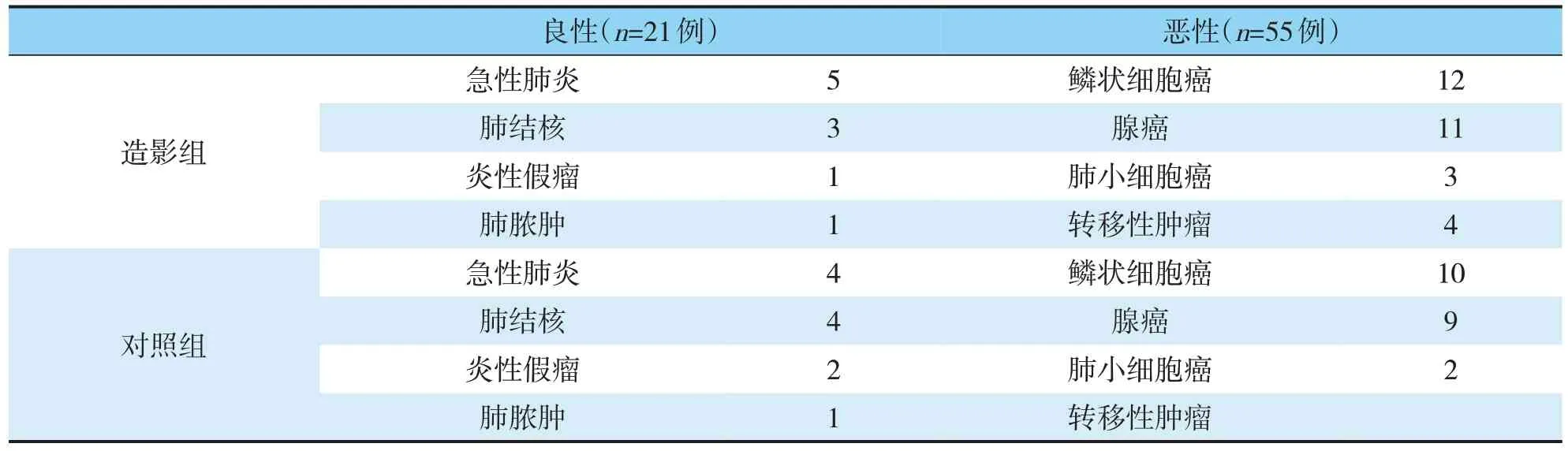
表1 對照組及造影組患者病理結果構成Tab.1 The constitution of pathological results in the control group and the contrast group
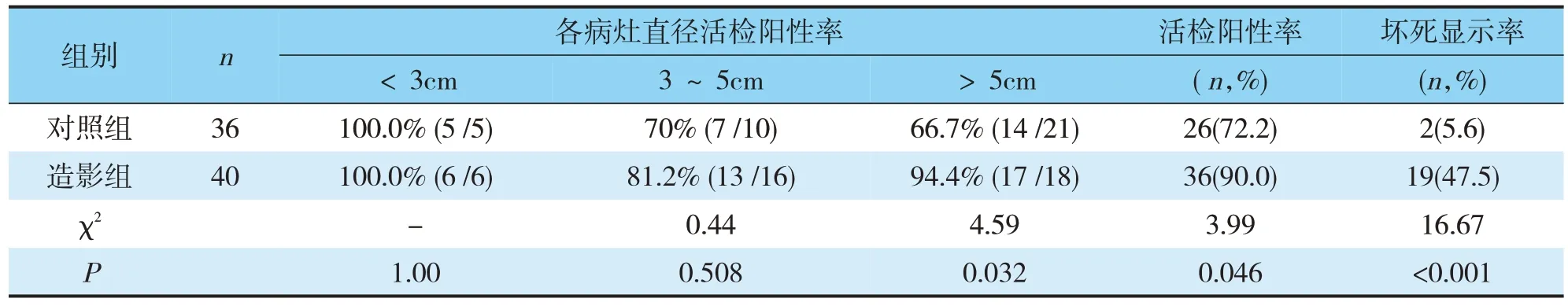
表2 造影組與對照組活檢陽性率比較Tab.2 The positive rate of biopsy was compared between contrast group and control group
造影組病灶的CEUS 特點:TIC 參數中急性肺炎的TE 為9.6s,而其他類型病變(包括惡性和慢性炎性病變)為14.5s,兩者差異顯著(P=0.03)(見表3),但惡性病變和慢性炎性病變之間的差異不顯著(P=0.37),余下參數之間都沒有顯著差異。
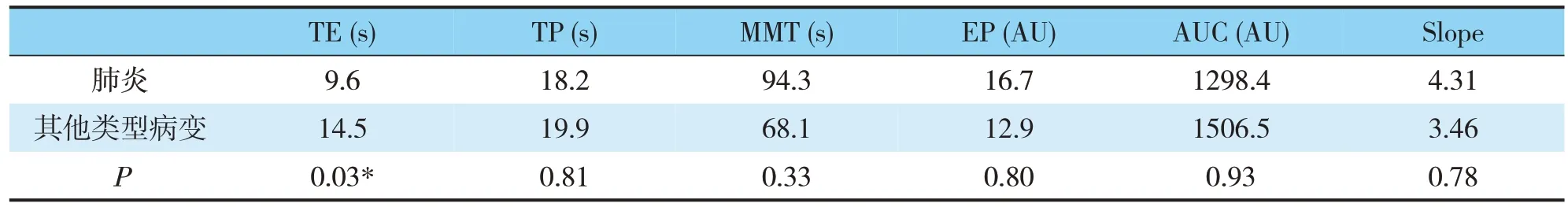
表3 造影組TIC曲線中的參數對比Tab.3 Comparison of parameters in tic curve of contrast group
3 討論
目前,增強CT 被認為是診斷肺胸膜疾病的有效方法[4]。然而,增強CT 會導致高輻射暴露,且所使用的碘油造影劑與肝、腎毒性有關[5]。與增強CT相比,超聲不僅被證明對引導經皮肺穿刺活檢具有很高的準確性,還具有其他許多優勢:首先,增強CT只能在動脈期的某個時刻評估肺部病變的良惡性;但是,實時CEUS 可以在注射造影劑后的一段時間內提供肺部病變的信息[6]。其次,超聲方便快捷、價格低廉、可重復性高,它可用于監測疾病的進展,并可用于檢測肺部疾病的并發癥,例如肺膿腫,肺炎旁積液,膿胸和胸膜纖維化[7,8]。另一個優點是造影劑沒有與碘油造影劑相似的副作用,超聲造影劑是血池試劑,微泡不會通過血管內皮擴散到間質中,因此,可以更可靠地描述腫瘤血管的形成[9]。
與肝臟類似,肺具有雙重血液供應:支氣管動脈系統(為支氣管、肺血管、肺泡、間質組織和胸膜提供營養)以及肺動脈系統(負責氣體交換)[10]。先前的研究表明,在健康個體中,注射造影劑后1~5s之間(表明肺動脈血管的時間窗口)在右心出現增強,而左心在8~11s 之間出現增強[11]。因此,病變中<6s的早期始增時間提示肺動脈供血,而>6s的延遲始增時間則提示支氣管動脈供血。可以利用這種差異來區分鄰近胸膜的良惡性肺病變[12]。前者由肺動脈系統供血,因此會顯示出早期增強。相反,惡性病變從支氣管動脈獲取血供,因此顯示晚期增強[13]。在本研究中使用了TIC 曲線分析,這種方法最大程度地減少了觀察者之間差異的風險,并且由兩名超聲科醫師對每個病變進行分析。結果表明,良性和惡性病變之間的對比增強模式(即TE,EE和PE)沒有顯著差異。 這些可能會受到各種類型肺部腫瘤的新血管形成以及其他肺部疾病(例如慢性阻塞性肺疾病,肺纖維化,塵肺病等)的共存影響。本研究中,良性和惡性病變的TE 平均值無顯著差異。然而,肺炎病變中的始增時間明顯短于其他類型的病變(例如惡性腫瘤或慢性炎癥性病變)。惡性病變與慢性炎癥性病變之間無顯著差異。如上所述,肺具有雙重血液供應;在CEUS 期間,肺動脈系統首先增強,然后是支氣管動脈系統。在肺炎病變中,肺動脈血供和對感染的充血反應會導致短暫的始增時間。相反,惡性病變是從支氣管循環中獲取血供,因此出現延遲增強[14]。慢性炎癥的病理過程包括壞死區的形成和慢性進行性病變中的吞噬作用,在這些情況下,源自肺動脈的血管大多受到破壞和阻塞,而血液供應僅來自支氣管動脈[15],因此,曲線類似于惡性病變。
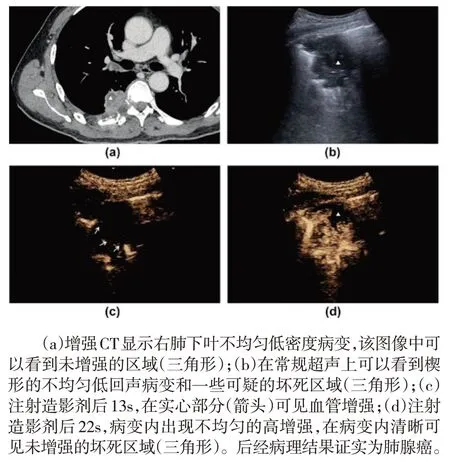
CEUS 可顯示肺部病變內的壞死部位并引導經皮肺穿刺活檢。在這項研究中,造影組病灶>5cm者行CEUS 檢查時可以明顯觀察到非增強區域,隨后避開此區域,而對增強區域進行穿刺活檢,活檢陽性率明顯提高(P<0.05)。直徑<3cm 的小病灶,造影組和對照組均未出現假陰性,與小病灶出現壞死情況少有關。直徑為3~5cm 的病灶,兩組間的差異沒有統計學意義,但造影組活檢陽性率較高。本研究中大多數肺部周圍的病變較小,并且隨著呼吸和心臟搏動而移動,這使得彩色多普勒超聲檢查很難獲得血流信號,在CEUS上,病變內的壞死區域顯示為非增強區域;這在引導活檢時很有用,可以避免從這些區域取樣。在這項研究中,CEUS 對壞死區域的顯示率為47.5%,顯著高于常規超聲(5.6%);CEUS 引導活檢的成功率為90%(36/40),高于常規超聲引導活檢的成功率(72.2%,26/36)。CEUS 可以清楚地顯示壞死區域,因此可以提高活檢的準確性。CEUS 還可以幫助顯示較大的血管,并且可以避免穿刺較大的血管,從而降低出血率。本研究中只有一名病人在活檢后出現了輕微咯血,這種癥狀無需臨床干預即可消退,且沒有嚴重并發癥,證明CEUS 引導的活檢是一種較為安全的方法。
這項研究有幾個局限性。(1)樣本量相對較小,特別是只有11.8%的病變是急性病變(9/76);(2)病變的新血管形成可能導致不同的增強模式,這在合并其他肺部疾病(例如慢性阻塞性肺病或肺纖維化)的情況下會發生。分析期間未考慮到這一點,在未來的研究中須納入具有不同病理類型病變和不同肺合并疾病的病人,以闡明這些因素的作用;(3)心臟因素也可能影響增強模式。
總之,本研究的結果表明CEUS 上的始增時間可用于區分急性肺炎病變和其他類型的肺病變。CEUS可以識別病變內的壞死區域,從而在引導活檢穿刺中發揮有效的作用。CEUS 可能是診斷肺部病變的有用附加技術,可用于肺腫瘤的治療后隨訪。

