不同正畸力對大鼠牙周組織壓力側輔助性T細胞17相關因子表達變化的影響
王璐瑤 汪波 叢蓓蓓 崔濤 杜雨晴 宋宇
1.青島大學口腔醫學院,青島266003;2.安徽醫科大學第二附屬醫院,合肥230601;3.青島大學附屬青島市口腔醫院中心實驗室,青島266001;4.青島大學附屬青島市口腔醫院正畸科,青島266001
“骨免疫學”中認為,骨改建細胞與免疫細胞間存在復雜的相互作用,通過許多共有調節分子如細胞因子、轉錄因子、信號分子和膜受體等密切相關[1]。在正畸牙移動過程中,牙周組織在機械力作用下介導的免疫反應可能會誘導T 細胞活化,從而產生一種刺激性反應引起骨吸收[2]。其中,T細胞中最具破骨作用的是輔助性T 細胞17(T helper cell 17,Th17)[3],能釋放多種分子形成適于組織吸收的微環境,參與牙周組織改建。
目前對于Th17 細胞在口腔領域的研究大多集中于牙周病、自身免疫性黏膜病、根尖周病等,對于其在正畸牙移動中的研究甚少,在不同正畸力不同時間作用下的含量變化規律,目前鮮有報道。本文通過在大鼠正畸牙上施加不同的力,觀察不同時間下壓力側牙周組織中Th17 細胞特征性轉錄因子維甲酸相關孤兒受體γt(retinoid related orphan receptor γt,RORγt)及其相關細胞因子白細胞介素(interleukin,IL)-17的表達量,以及骨保護素(osteoprotegerin,OPG)表達量、破骨細胞(osteoclast,OC)數量的變化規律,從分子、基因水平上初步探究不同正畸力作用下Th17 細胞對牙槽骨改建的影響,為以Th17 細胞免疫介導的正畸加力后牙周組織改建機制提供理論依據。
1 材料和方法
1.1 材料
1.1.1 實驗動物的選擇及分組 SPF 級8~10 周齡(220±10)g 雄性大鼠108 只,由濟南朋悅實驗動物繁育有限公司提供,許可證號SCXK(魯)2014 0007。本研究已經青島大學附屬醫院動物倫理委員會審批通過,動物處置符合動物倫理學要求。
將其隨機均分為0、50、100 g 三組[4-5],每組36 只,每組再 分為加力0、1、3、5、7、14 d亞組。
1.1.2 主要試劑 TB Green?Premix Ex Taq?Ⅱ試劑盒(TaKaRa公司,日本);RORγt以及內參甘油醛-3-磷酸脫氫酶抗體(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)的聚合酶鏈反應(poly‐merase chain reaction,PCR)引物(上海生物工程股份有限公司),引物序列見表1;鼠IL-17酶聯免疫吸附測定(enzyme-linked immunosorbent assay,ELISA)試劑盒(武漢市伊萊瑞特生物科技有限公司);兔抗鼠RORγt 多克隆抗體(北京市博奧森生物技術有限公司);兔抗鼠OPG多克隆抗體、辣根過氧化物酶標記的二抗(武漢市賽維爾生物科技有限公司);兔抗鼠抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase,TRAP)多克隆抗體(Boster公司,美國)。
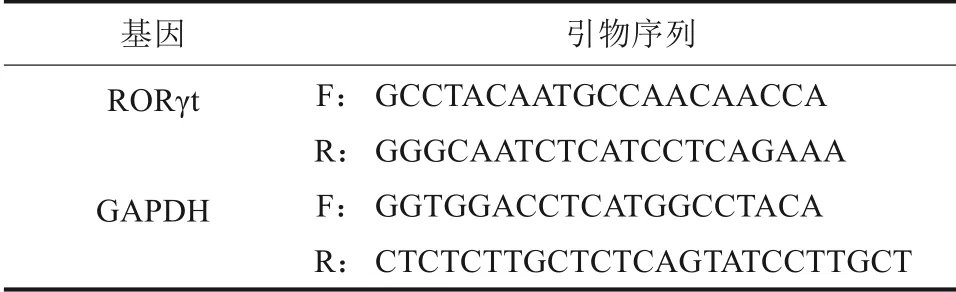
表1 PCR引物序列Tab 1 PCR primer sequence
1.2 方法
1.2.1 構建大鼠正畸牙移動模型(圖1) 以上切牙為支抗,用結扎絲在上頜第一磨牙上固定鎳鈦拉簧。建模后所有大鼠喂養軟食;每天檢查裝置,若松動脫落則重新固定;生理鹽水沖洗大鼠口腔,防止裝置處食物殘渣堆積導致牙齦炎癥。
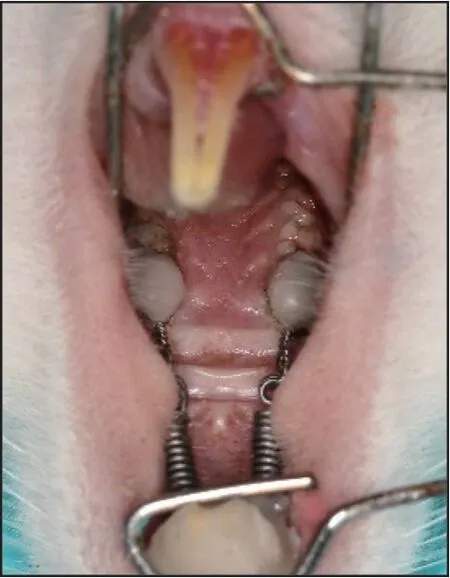
圖1 正畸牙移動模型Fig 1 Orthodontic tooth movement model
1.2.2 標本采集 于加力0、1、3、5、7、14 d 后,每組各處死6只大鼠,取雙側上頜第一磨牙及其牙周組織,一側組織用于實時定量PCR(real time quantitative PCR,Q-PCR)和ELISA 檢測;另一側組織用于免疫組織化學染色法(immunohistochem‐istry,IHC)檢測。
1.2.3 Q-PCR 法檢測RORγt mRNA 表達量 Trizol法提取Total RNA,經逆轉錄后,采用TB Green嵌合熒光法,以GAPDH為內參,進行PCR反應,反應條件為95 ℃30 s、95 ℃5 s、60 ℃30 s,40 個循環。采用2-△△C(t)法對數據進行相對定量分析。
1.2.4 ELISA 檢測牙周組織中IL-17 蛋白的表達量按試劑盒說明書操作,利用標準品制作標準曲線,酶標儀測出樣本波長450 nm 下的光密度值(opti‐cal density,OD)值,每個標準品的平均光密度值(mean optical density,MOD)減去空白孔的OD值作為矯正值,分別代入方程計算IL-17蛋白表達量。
1.2.5 組織學標本制作及蘇木精-伊紅(hematoxy‐lin-eosin staining,HE)染色 組織經固定、脫鈣、脫水、包埋后,制作上頜第一磨牙近遠中垂直向切片,厚度5 μm,烤片2 h,常規HE染色。
1.2.6 IHC檢測RORγt、OPG蛋白表達量以及TRAP陽性OC數量 采用鏈霉菌抗生物素蛋白-過氧化物酶連結法(streptavidin-perosidase,SP)法進行染色,抗體工作濃度分別為RORγt(1∶600)、OPG(1∶200)、TRAP(1∶200),陰性對照用磷酸緩沖鹽溶液代替一抗。
采圖:胞核藍染,陽性表達為棕黃色顆粒。胞核≥3 個的TRAP 陽性細胞為OC。在400 倍光鏡下,觀察上頜第一磨牙近中頰根壓力側根尖1/3 以上區域,隨機選取5 個視野,應用Image-ProPlus 6.0 軟 件進 行RORγt、OPG 的MOD 測量 以 及OC計數。
1.3 統計學分析
使用SPSS 23.0 軟件進行統計分析,數據采用均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用LSD 法,檢驗水準α=0.05,P<0.05時差異有統計學意義。
2 結果
2.1 大鼠正畸牙移動模型成功建立
2.1.1 牙齒移動情況 50 g 組在0~1 d 發生瞬時移動,1~5 d 緩慢移動,5~7 d 加速移動,7~14 d 緩慢移動;100 g 組在0~1 d 發生瞬時移動,1~3 d 緩慢移動,3~14 d 加速移動。0 g 組0~14 d 無移動,50 g 和100 g 組1~14 d 時 均 較0 g 組有明顯移 動,100 g 組在1、5、14 d 移動量顯著高于50 g 組(P<0.05)(圖2、3)。
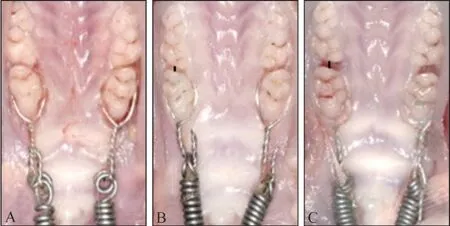
圖2 0、50、100 g組第14 d牙齒移動情況Fig 2 Tooth movement of 0,50 and 100 g group on the 14 th day
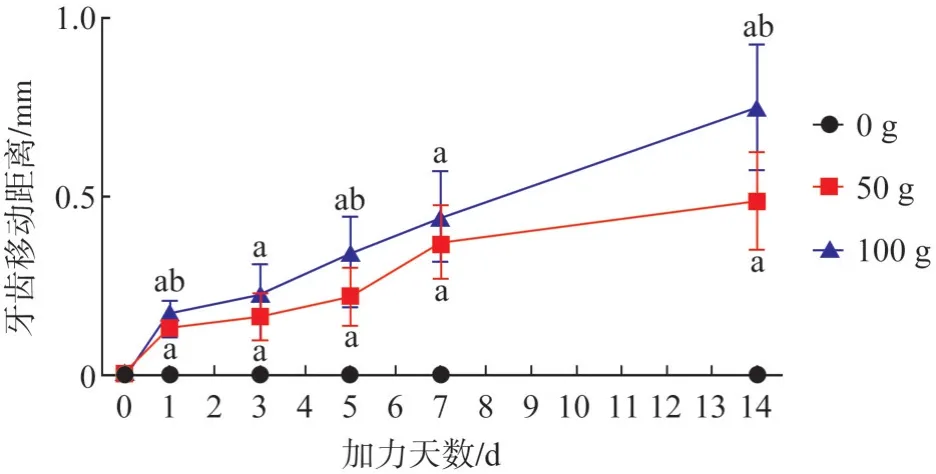
圖3 各組牙齒移動距離變化趨勢Fig 3 Trend of tooth movement distance in each group
2.1.2 HE 染色結果 0 g 組0~14 d 時兩側牙周膜間隙等寬,纖維排列規則(圖4)。50 g 組5~7 d 時壓力側牙槽骨邊緣見大量OC 及骨吸收陷窩,張力側纖維疏松,大量成骨細胞(osteoblast,OB)沿骨表面呈鏈狀排列,第5 d 時表現最為顯著;14 d 時牙周膜間隙趨于恢復,OC、OB 均較之前明顯減少,張力側大量新骨形成,在加力中后期偶見輕微牙骨質吸收(圖5)。
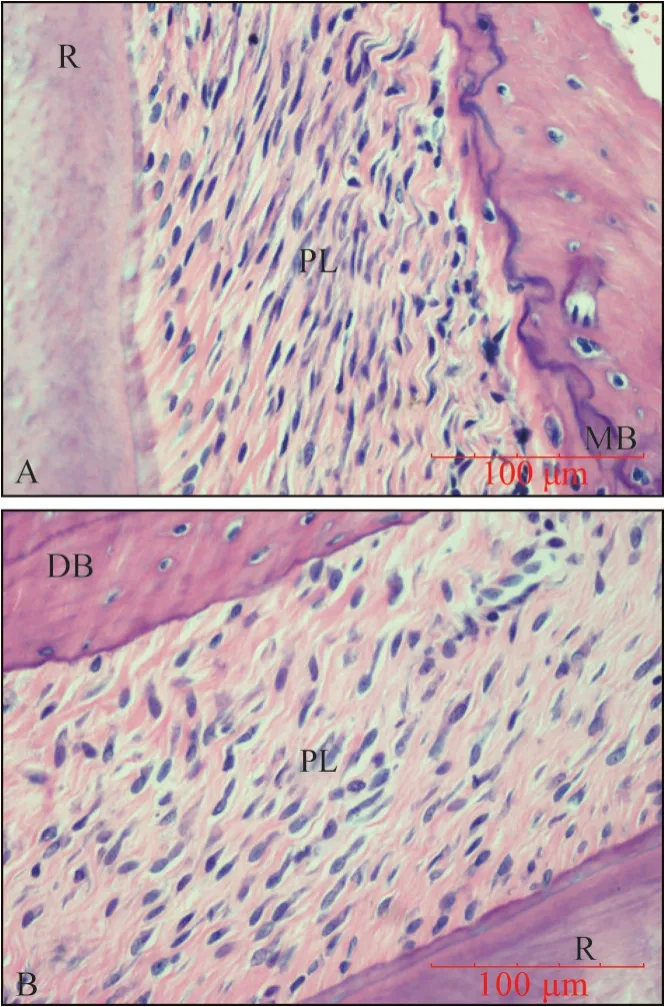
圖4 0 g組牙周組織HE染色結果 ×400Fig 4 HE staining of periodontal tissue in 0 g group ×400
100 g 組5~7 d 時壓力側見大范圍玻璃樣變區,牙槽骨邊緣明顯骨吸收及遠處出現潛掘性吸收,張力側牙周膜斷裂嚴重,OB 增多,7 d 時表現最為顯著;14 d 時壓力側潛掘性吸收明顯,張力側新骨形成不明顯,牙周受損嚴重,在加力初期即開始有明顯的牙骨質甚至牙本質的吸收(圖6)。
2.2 Q-PCR 法 檢 測 牙 周 組 織 中RORγt mRNA 的表達
50 g 組和100 g 組RORγt mRNA 表達量均隨加力時間呈先升高后降低趨勢,峰值分別位于5、7 d,50 g 組于14 d 可恢復至基線水平,而100 g 組仍維持較高水平(圖7)。
同一天數下不同力值組的比較:組間比較顯示,3 組之間在0、1 d 的差異無統計學意義(F值分別為0.045、2.159,P>0.05);3、5、7、14 d 的差異均有統計學意義(F值分別為17.604、48.185、77.660、40.647,P<0.05)。50 g 組RORγt mRNA表達量在3~7 d 顯著高于0 g 組,100 g 組RORγt mRNA 表達量在3~14 d 顯著高于0 g、50 g 組(P<0.05)。
同一力值下不同天數的比較:0 g 組不同天數間的差異無統計學意義(F值為0.727,P>0.05);50 g、100 g組間的差異均有統計學意義(F值分別為26.278、50.141,P<0.05)。50 g組RORγt mRNA表達量在3~7 d 高于0 d,100 g 組RORγt mRNA 表達量在3~14 d高于0 d(P<0.05)。
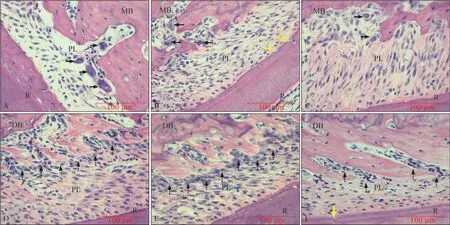
圖5 50 g組牙周組織HE染色結果 ×400Fig 5 HE staining of periodontal tissue in 50 g group ×400
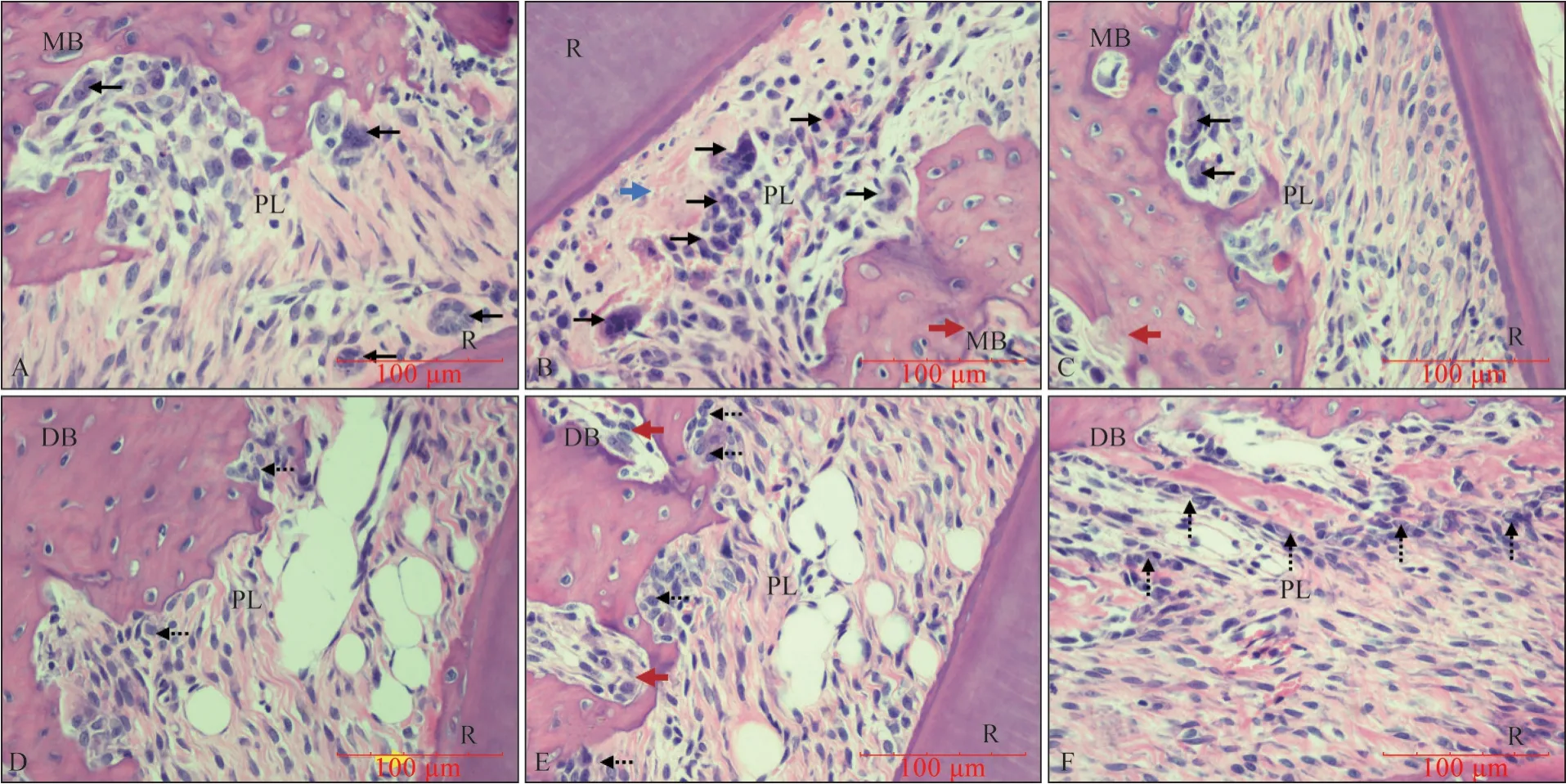
圖6 100 g組牙周組織HE染色結果 ×400Fig 6 HE staining of periodontal tissue in 100 g group ×400
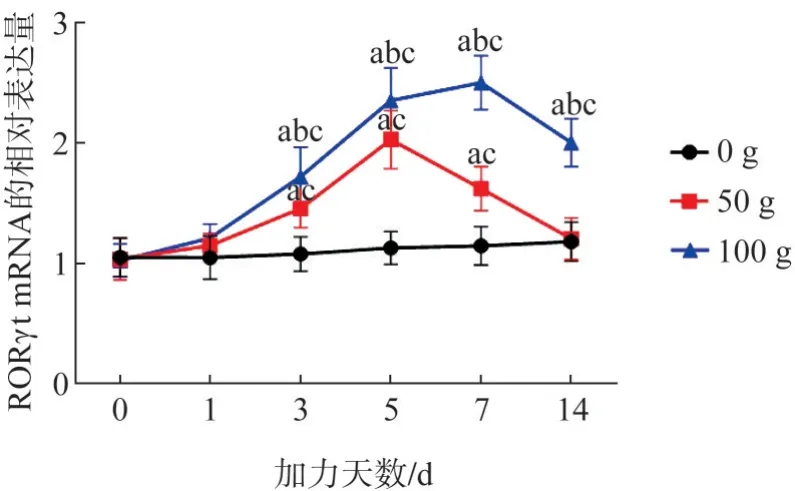
圖7 各組在不同時間內RORγt mRNA表達變化趨勢Fig 7 The expression trend of RORγt mRNA in each group at different times
2.3 ELISA法檢測牙周組織中IL-17蛋白的表達
IL-17 蛋白表達量趨勢同RORγt mRNA 趨勢基本一致(圖8)。
同一天數下不同力值組的比較:組間比較顯示,三組間在0、1 d的差異無統計學意義(F值分別為0.072、3.904,P>0.05);3、5、7、14 d 的差異均有統計學意義(F值分別為82.260、279.354、419.838、297.783,P<0.05)。50 g 組IL-17 蛋白表達量在3~7 d 顯著高于0 g 組;100 g 組IL-17 蛋白表達量在1~14 d 顯著高于0 g 組,在3~14 d 顯著高于50 g組(P<0.05)。
同一力值下不同天數的比較:0 g 組不同天數之間的差異無統計學意義(F值為0.545,P>0.05);50 g、100 g組的差異均有統計學意義(F值分別為112.942、294.515,P<0.05)。50 g 組和100 g 組的IL-17蛋白表達量均在3~14 d高于0 d(P<0.05)。
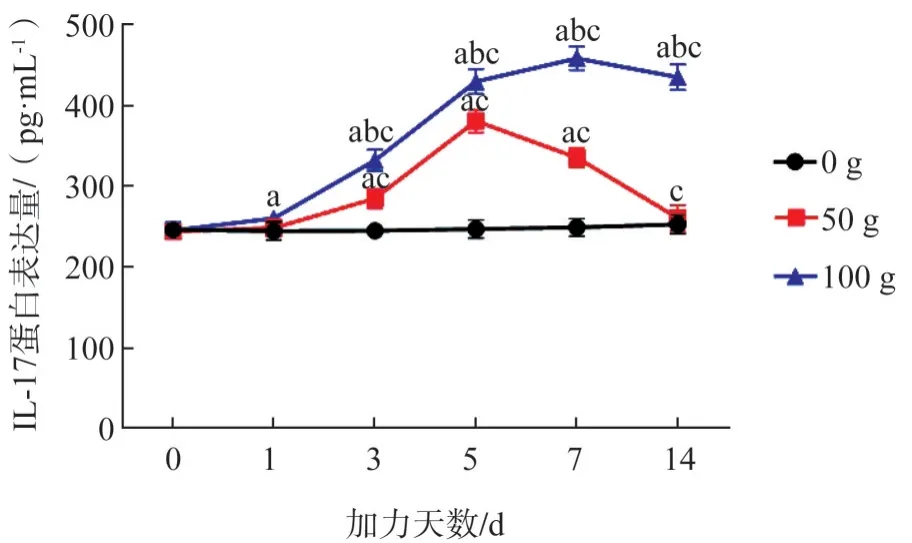
圖8 各組在不同時間內IL-17蛋白含量表達變化趨勢Fig 8 The expression trend of IL-17 protein in periodontal tis‐sues of each group at different times
2.4 IHC 法檢測牙周組織中RORγt、OPG 蛋白的表達以及TRAP陽性OC數量
2.4.1 RORγt的表達 RORγt陽性表達位于Th17 細胞胞核中,其MOD 變化趨勢、同一天數下不同力值組的比較差異以及同一力值下不同天數的比較差異同RORγt mRNA 的基本一致,陰性對照組的Th17細胞胞核中未見棕黃色顆粒(圖9、10)。

圖9 RORγt IHC染色 ×400Fig 9 RORγt IHC staining ×400
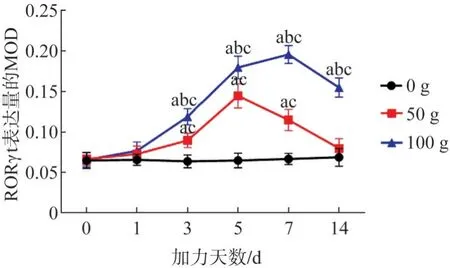
圖10 各組在不同時間內RORγt蛋白含量表達變化趨勢Fig 10 The expression trend of RORγt protein in periodontal tis‐sues of each group at different times
2.4.2 OPG 的表達 OPG 陽性表達主要位于OB、成纖維細胞、骨襯里細胞和OC 的胞漿、胞膜中,陰性對照組的上述細胞胞漿、胞膜中未見棕黃色顆粒(圖11、12)。
OPG 蛋白表達量在50 g 組隨加力時間先降低、再升高、后降低趨勢,3 d 達最低值、7 d 達最高值,14 d 基本降至基線水平;在100 g 組呈先降低后升高趨勢,5 d 降至最低值,且小于50 g 組最低值,14 d仍處于較高水平。
同一天數下不同力值組的比較:組間比較顯示3 組之間在0、1 d 的差異無統計學意義(F值分別為0.214、2.752,P>0.05);3、5、7、14 d 的差異均有統計學意義(F值分別為26.677、97.737、111.376、14.739,P<0.05)。50 g 組OPG 蛋白表達量在3 d 顯著低于0 g 組,在5 d 顯著高于0 g 組;100 g組OPG蛋白表達量在1~7 d低于0 g組、在3~7 d低于50 g組,14 d高于0 g、50 g組(P<0.05)。
同一力值下不同天數的比較:0 g 組不同天數之間的差異無統計學意義(F值為0.333,P>0.05);50 g、100 g組的差異均有統計學意義(F值分別為50.658、56.480,P<0.05)。50 g 組OPG 蛋白表達量在3 d 低于0 d,在5 d 高于0 d;100 g 組OPG 蛋白表達量在1~7 d 低于0 d,在14 d 高于0 d(P<0.05)。
2.4.3 TRAP 陽性OC 數量 TRAP 陽性表達位于OC 胞核中,OC 數量變化趨勢同RORγt mRNA 變化趨勢基本一致,陰性對照組OC 胞核中未見棕黃色顆粒(圖13、14)。
同一天數下不同力值組的比較:組間比較顯示3 組之間在0 d 的差異無統計學意義(F值為0.441,P>0.05);1、3、5、7、14 d 的差異均有統計學意義(F值分別為5.671、21.848、55.702、55.323、63.116,P<0.05)。50 g 組OC 數在3~7 d高于0 g 組;100 g 組OC 數在1~14 d 高于0 g 組,在3~14 d高于50 g組(P<0.05)。
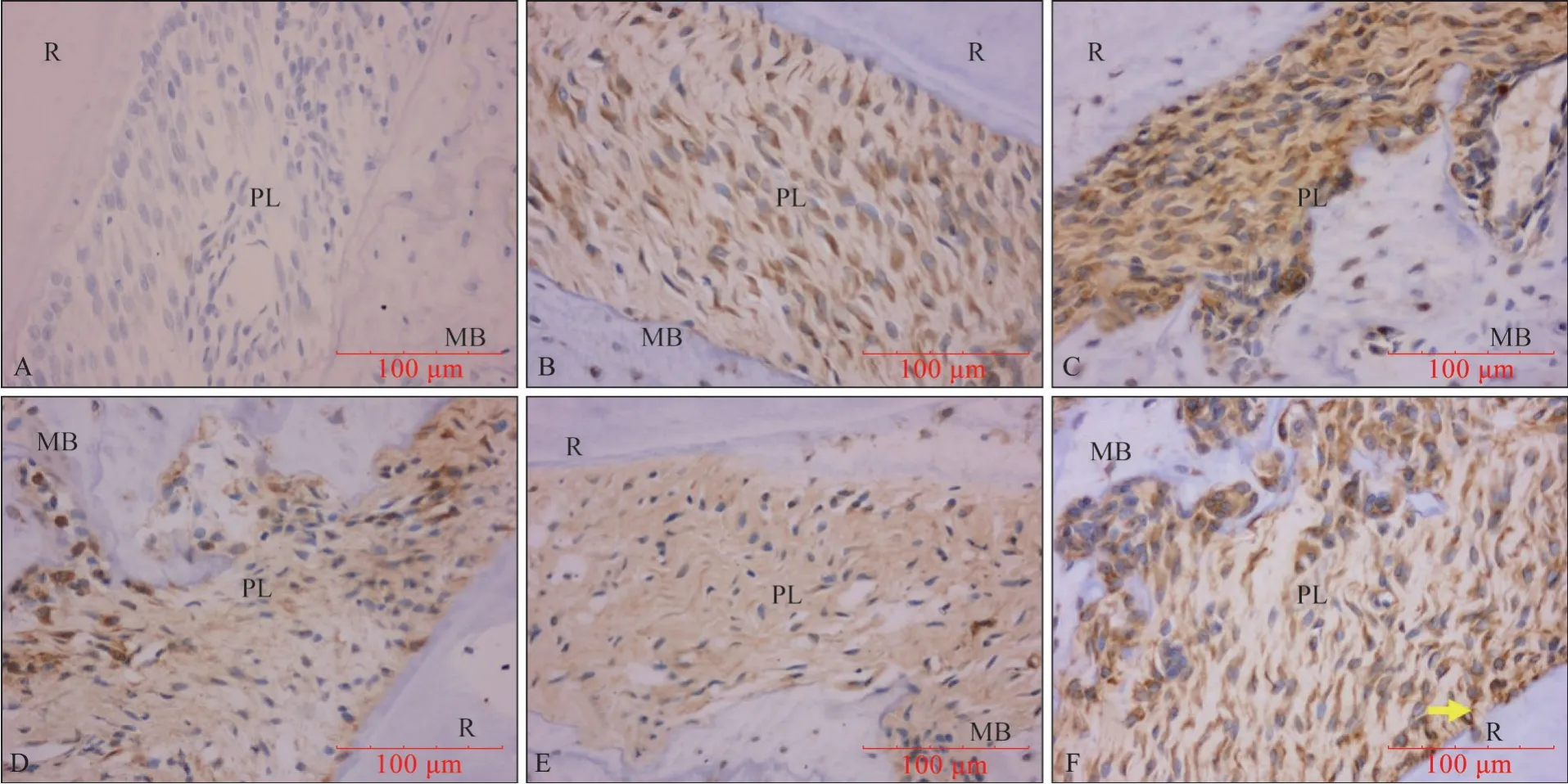
圖11 OPG IHC染色 ×400Fig 11 OPG IHC staining ×400
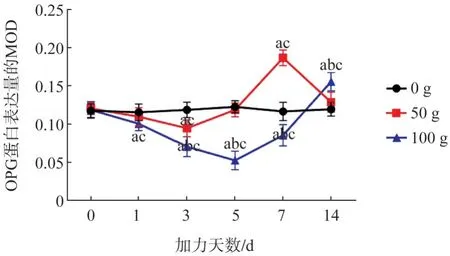
圖12 各組在不同時間內OPG蛋白含量表達變化趨勢Fig 12 The expression trend of OPG protein in each group at different times
同一力值下不同天數的比較:0 g 組不同天數之間的差異無統計學意義(F值為0.517,P>0.05);50 g、100 g組的差異均有統計學意義(F值分別為18.475、42.777,P<0.05)。
50 g 組OC 數在3~14 d 高于0 d,100 g 組OC數在1~14 d高于0 d(P<0.05)。
3 討論
Thl7 細胞因大量分泌IL-17 而得名,在初始CD4+T 細胞向其分化的過程中,轉化生子因子-β和IL-6 是啟動分化因子[6],通過與信號轉導和轉錄激 活 因 子3 聯 合 誘 導RORγt 高 表達[7]。RORγt 是Th17 細胞的特征性核轉錄因子,可促進Th17 細胞分化,誘導IL-17分泌[8],Ivanov等[9]將小鼠的RORγt基因敲除后發現,體內Th17 細胞及IL-17 較正常小鼠顯著減少,因此RORγt 的含量在一定程度上可大致代表Th17細胞含量。
IL-17 為Thl7 細胞的主要效應細胞因子,具有強大的促炎活性,可介導慢性炎癥的發展。既往研究證實,IL-17 在促進牙周炎[10]、根尖周病[11]和顳下頜關節骨關節病[12]等骨丟失性口腔疾病中發揮重要作用。一方面,IL-17 能上調成纖維細胞和OB 上骨吸收因子核因子-κB 受體活化因子配體(receptor activator of nuclear factor?κB ligand,RANKL)的表達,下調OPG 的表達[13],直接調節OC 前體細胞的增殖和分化及成熟OC 的形成和活化;另一方面,IL-17 能通過募集和激活免疫細胞促進局部炎癥,產生大量炎性細胞因子與RANKL信號轉導產生協同作用[14-15],增強RANKL 表達,間接激活OC 前體細胞。此外,RANKL 在Th17 細胞上高表達也可能參與OC 的形成[16]。成熟OC 活化后會產生大量的TRAP,是檢驗OC的重要指標。研究[17]發現,在小鼠關節炎模型中,經抗IL-17 治療后,RANKL 以及TRAP 等OC 標志物的數量明顯降低。
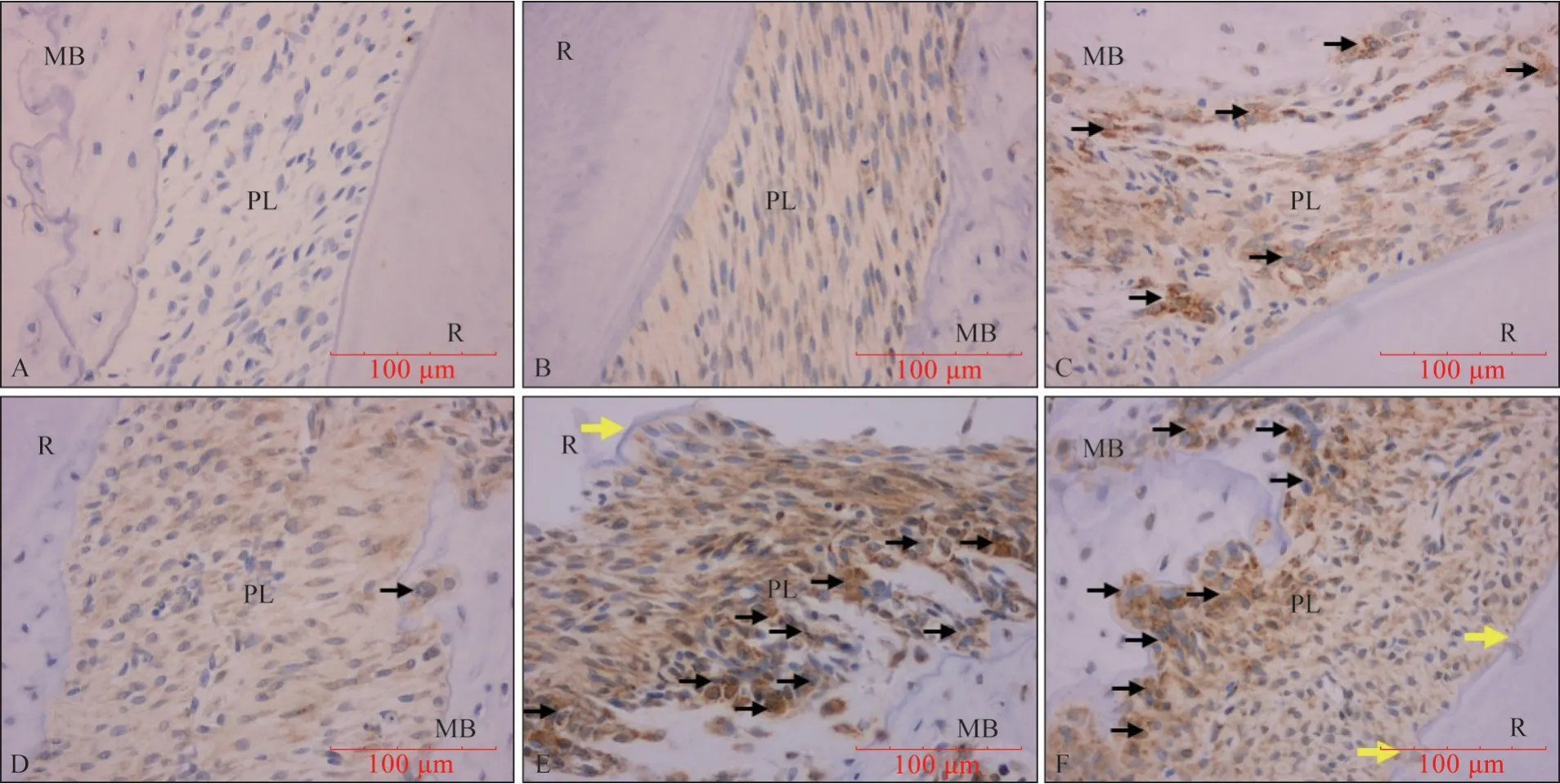
圖13 TRAP IHC染色 ×400Fig 13 TRAP IHC staining ×400
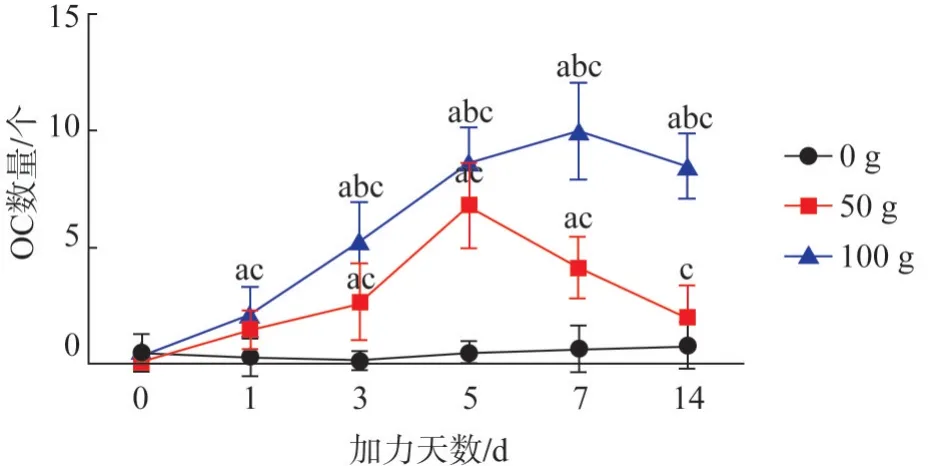
圖14 各組在不同時間內OC數量變化趨勢Fig 14 The trend of the number of OC in each group at different times
RORγt 和IL-17 在壓力側牙周組織中表達變化的意義。本研究顯示,0 g 組RORγt 和IL-17 含量變化趨勢不明顯(P<0.05),說明加力裝置對結果影響較小;加力前,這兩個因子在牙周組織中均為弱陽性表達,表明其在正常牙周組織中有一定表達量以維持牙周組織的生理狀態;50 g、100 g組加力后,這兩個因子的表達均呈先升高后降低趨勢,50 g 組兩因子均在加力5 d 達峰值,14 d 基本恢復基線水平,具有一定周期性,且與OC 數量變化趨勢一致,提示適宜正畸力作用下牙周組織發生生理限度內的改建,達到新的骨吸收與沉積的動態平衡。100 g 組兩因子均在加力7 d 達峰值且高于50 g 組峰值,14 d 雖較前降低但仍處于較高水平,且與OC 數量變化趨勢一致,由HE 及IHC 染色也可觀察到100 g 組不僅發生明顯的直接骨吸收,而且還在遠離牙周膜側發生潛掘性吸收,以及牙骨質和牙本質的吸收,提示重力使牙周組織過度損傷。100 g 組14 d 時兩因子含量雖然仍處于較高水平,但也表現出一定的自限性,可能隨著加力時間的延長,力值不斷衰減,最終也會建立新的動態平衡,表明100 g 力下牙周組織改建周期較50 g 長,當正畸治療需施加較大力值時,可以適當延長復診時間以保證牙周組織充分改建。
OB、成纖維細胞和骨髓基質細胞產生的OPG,又稱破骨細胞生成抑制因子,可充當RANKL的誘餌受體,通過競爭性與RANKL結合,阻止RANKL與其受體相互作用[18],從而抑制OC 分化的終末階段和基質OC 的活化,誘導OC 細胞凋亡[19],防止骨組織過度吸收。Kanzaki 等[20]通過將OPG 基因轉移到大鼠壓力側牙周組織發現,高水平OPG 在機械應力過程中可抑制RANKL 介導的OC 生成,從而限制牙移動。
OPG 在壓力側牙周組織中表達變化的意義。本實驗中,加力初期OPG 稍有降低,可能是由于IL-17隨加力時間逐漸增多,對OPG 的抑制作用愈加明顯,這與彭娟敏等[21]研究一致。有學者[22]發現,此抑制作用依賴于絲裂原活化蛋白激酶、蛋白激酶B 和核因子κB 信號通路。50 g 組加力5 d時,IL-17開始降低,對OPG 的抑制作用減弱,故OPG 迅速升高,以防止OC 過度活化,促進其凋亡,使牙周組織適度改建,達到生理性牙移動。100 g 組14 d 時OPG 表達 高于0 g 及50 g 組,且 較50 g 組峰值低,是由于14 d 時IL-17 含量仍維持較高水平,壓力側骨改建處于負平衡狀態。
50 g 組和100 g 組在不同力下牙齒移動規律也不同。1 d 時,由于牙周膜被壓縮,兩組牙齒均產生瞬時移動;之后進入移動遲滯期,50 g 組在1~5 d,100 g組在1~3 d移動相對緩慢,此時OC數雖不斷上升,但與其發揮作用引起牙齒移動有一定滯后性,這一方面是由于壓力使細胞損傷,其分解代謝產物導致組織水腫[23],另一方面牙周膜中玻璃樣變區的清除也需一定時間[24];50 g 組在5~7 d,100 g 組在3~14 d 隨著OC 高表達及障礙的逐漸清除,移動較為快速;50 g 組隨后又因OC 數逐漸降至基線水平而移動減緩。在整個階段,100 g組牙齒移動距離均大于50 g組,這與100 g組Th17細胞相關因子含量及OC數均大于50 g組有關。14 d時100 g 組牙齒移動距離較大,可能是因為潛掘性骨吸收導致骨質疏松多孔,過大的機械力牽引使牙根能迅速占據骨組織中的空虛部分,加之張力側重力導致牙周纖維韌帶斷裂,從而產生大量位移。提示在正畸操作時注意施加適宜力值,避免重力對牙周組織的過度破壞;同時,這也給予正畸醫生對于控制支抗牙的新思路,可在支抗牙牙周局部注射IL-17 抗體、OPG,以降低OC 活性,增強支抗牙穩固性。
綜上,本實驗通過體內實驗初步證明了Th17細胞通過分泌IL-17 參與了正畸牙壓力側牙槽骨改建過程,在不同力值下,其相關因子表達變化具有一定周期性,趨勢同OC 基本一致,但仍需日后再結合體外實驗進一步探討Th17 細胞對于不同力值刺激下免疫炎性反應的具體機制。
利益沖突聲明:作者聲明本文無利益沖突。

