術中高場強MRI聯合熒光引導技術在腦膠質瘤切除術中的應用
董澤平 趙旸 陳凡 李文忠 陳大偉
腦膠質瘤是中樞神經系統最常見的惡性腫瘤,手術全切除是延長無進展生存期(PFS)和提高生活質量的重要方法[1],但是由于腫瘤細胞分化差、增殖迅速、侵襲性強,術中常難以判斷腫瘤邊界,導致腫瘤殘留[2],如果擴大切除范圍,特別是位于腦功能區的腫瘤,可能造成永久性神經功能損傷。近年來,多種手術輔助技術如神經導航系統、熒光引導技術、術中超聲檢查(OUS)等的應用,使腫瘤全切除率顯著提高[3-6],但各項技術均有其局限性,神經導航系統可隨術中腦脊液釋放和腫瘤部分切除引起腦漂移,降低準確性;低級別膠質瘤熒光素鈉(FLS)和5-氨基乙酰丙酸(5-ALA)染色不明顯,邊緣模糊;術中超聲檢查難以辨別腫瘤邊界和殘留腫瘤。而術中MRI(iMRI)可以精準分辨腫瘤邊界,辨認重要神經結構,并及時更新數據,糾正腦組織移位,準確判斷腫瘤切除程度,從而在保留神經功能的前提下最大限度安全切除腫瘤[7]。研究顯示,術中高場強MRI可以提高不同類型膠質瘤全切除率,并明顯改善預后[8]。鑒于此,吉林大學白求恩第一醫院對比分析熒光引導下腦膠質瘤切除術與術中高場強MRI聯合熒光引導下腦膠質瘤切除術的有效性和安全性,以期提高患者術后無進展生存期和生活質量。
資料與方法
一、臨床資料
1.納入標準 (1)頭部MRI顯示額顳頂枕葉和丘腦占位性病變,T1WI呈低信號,周圍存在大片高信號水腫區,增強掃描病灶呈明顯不規則強化或環狀強化。(2)均行熒光引導下腫瘤切除術,并經術中冰凍病理及術后病理證實為腦膠質瘤。(3)所有患者及其家屬均對研究內容和手術方法知情同意并簽署知情同意書。
2.排除標準 (1)影像學診斷為腦膜瘤、腦轉移瘤、中樞神經系統淋巴瘤或腦膿腫。(2)病變位置表淺,位于非功能腦區的膠質瘤。(3)熒光素鈉過敏試驗陽性。(4)存在MRI掃描禁忌證或安全隱患。
3.一般資料 選擇2017年6月至2018年6月在吉林大學白求恩第一醫院神經腫瘤外科住院治療的腦膠質瘤患者共53例,男性39例,女性14例;年齡29~73歲,平均(48.24±23.12)歲;原發腫瘤46例(86.79%),復發7例(13.21%);腫瘤位于額葉26例(49.06%),顳 葉14例(26.42%),頂 枕 葉8例(15.09%),丘腦5例(9.43%);其中33例(62.26%)腫瘤位于重要腦功能區,分別位于運動區17例,語言區11例,丘腦5例。根據術中是否應用高場強MRI分為熒光引導組(28例)和術中高場強MRI聯合熒光引導組(聯合組,25例)。兩組患者一般資料比較,差異無統計學意義(均P>0.05,表1)。

表1 聯合組與熒光引導組患者基線臨床資料的比較Table 1. Comparison of basic clinical data between combined group and fluorescence guidance group
二、研究方法
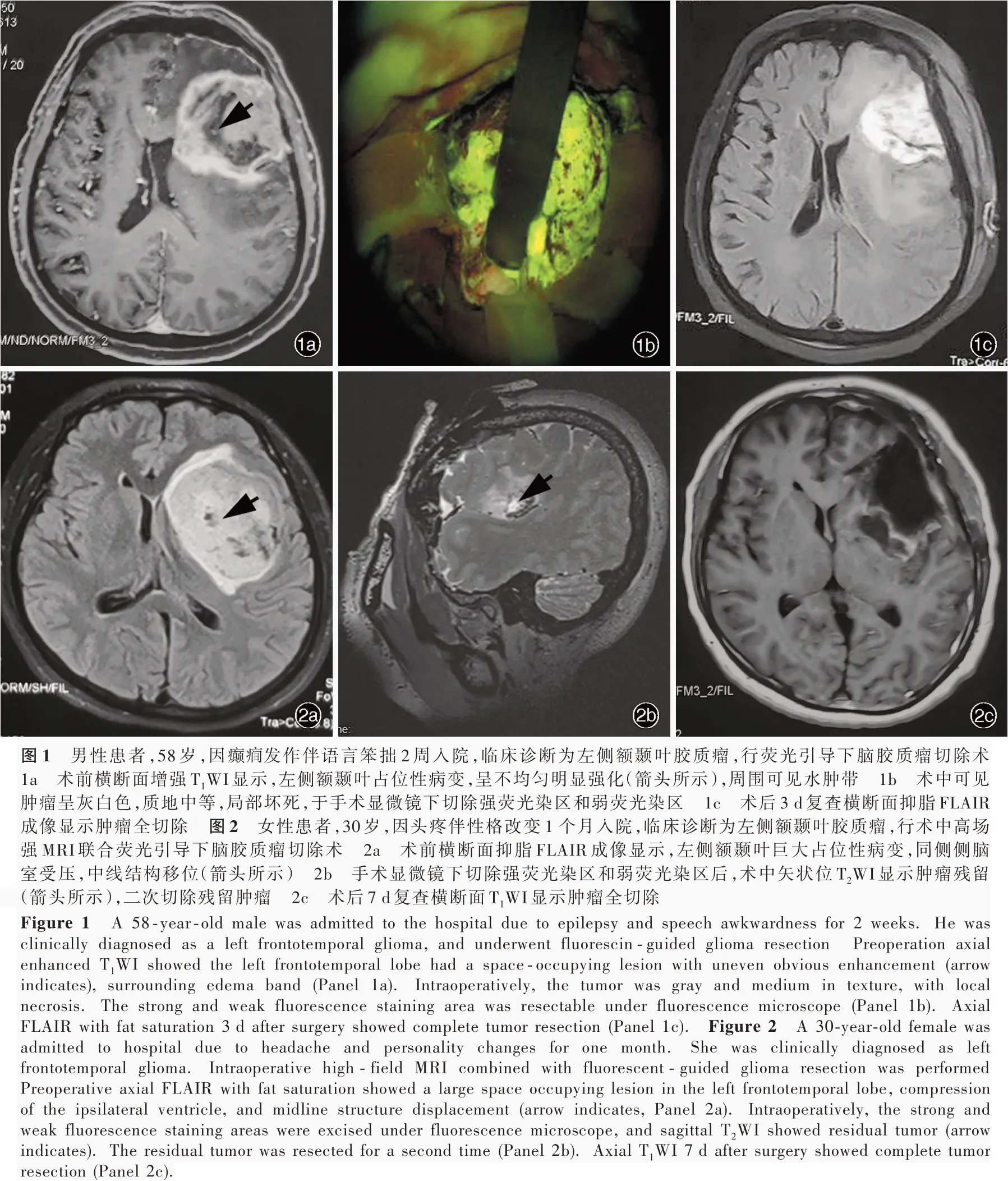
1.熒光引導下腦膠質瘤切除術 熒光引導組患者根據腫瘤部位擺放術中體位,氣管插管全身麻醉。麻醉前行熒光素鈉過敏試驗,將0.50 ml熒光素鈉注射液(5 ml:500 mg,美國Alcon Laboratories公司,進口藥品注冊證號:H20090507)以生理鹽水稀釋至5 ml(終濃度1%)靜脈注射,監測患者生命體征和有無皮疹,15~30 min后無異常者即為熒光素鈉過敏試驗陰性。常規開顱顯露腫瘤,靜脈注射10%熒光素鈉10 ml(10~15 mg/kg),觀察腫瘤染色,自淺黃色逐漸加深,5~10 min達熒光染色高峰,于手術顯微鏡(OPMI PENTERO 900雙熒光手術顯微鏡,德國Zeiss公司)下切除強熒光染區、弱熒光染區至無熒光染區,結束手術(圖1)。本組有15例患者腫瘤位于重要腦功能區,術中同時行神經電生理監測,在直接皮質電刺激(DCS)保護下切除腫瘤。術中對切除的不同熒光染區行快速冰凍病理學檢查。
2.術中高場強MRI聯合熒光引導下腦膠質瘤切除術 聯合組患者根據腫瘤部位擺放體位,氣管插管全身麻醉。根據術前多模態MRI檢查結果,避開重要腦功能區和神經傳導束,選擇適宜手術入路,于熒光引導下切除腫瘤,熒光素鈉過敏試驗同熒光引導組。如果術者發現腫瘤未全切除,腫瘤鄰近重要腦功能區,腦脊液流失較多致腦組織移位而迷失腫瘤位置,或腦組織腫脹或膨出懷疑顱內出血時,行術中高場強(3.0T)MRI檢查,由術者和影像科醫師共同根據增強T1WI和T2-FLAIR成像判斷是否腫瘤殘留及其殘留程度。確定無顱內血腫后重新標記殘留腫瘤,勾畫神經傳導束,糾正腦組織移位,必要時可以重復行MRI檢查,直至全切除腫瘤(圖2),瘤腔內無需止血材料以免干擾術中MRI的評估。腫瘤全切除為MRI增強掃描顯示殘留腫瘤體積<0.175 cm3[9],腫瘤體積(cm3)=長徑×寬徑2/2[10]。
3.觀察指標 (1)有效性:詳細記錄術中高場強MRI掃描次數、手術時間、腫瘤全切除率、腦功能區腫瘤全切除率、腫瘤復發率和病死率。(2)安全性:記錄術后言語障礙、運動障礙、精神障礙、顱內感染和顱內出血等并發癥發生率。
4.統計分析方法 采用SPSS 17.0統計軟件進行數據處理與分析。計數資料以相對數構成比(%)或率(%)表示,采用χ2檢驗或Fisher確切概率法。呈正態分布的計量資料以均數±標準差(±s)表示,采用兩獨立樣本的t檢驗。以P≤0.05為差異具有統計學意義。
結 果
本研究53例患者均順利完成手術,腫瘤全切除42例(79.25%),次全切除11例(20.75%);其中33例腫瘤位于重要腦功能區(運動區、語言區、丘腦),腫瘤全切除25例(75.76%),次全切除8例(24.24%);經術后病理證實星形細胞瘤(WHOⅡ級)12例(22.64%),間變性星形細胞瘤(WHOⅢ級)17例(32.08%),膠 質 母 細 胞 瘤(WHOⅣ級)24例(45.28%);術后出現言語障礙16例(30.19%)、短暫性肢體活動障礙21例(39.62%)、精神障礙6例(11.32%)、顱內感染8例(15.09%)、少量硬膜外血腫2例(3.77%),予以脫水、甲潑尼龍沖擊、營養神經、鎮靜和抗感染對癥治療后7天至3個月恢復正常,無死亡病例。聯合組患者行術中MRI掃描1~2次,手術時間長于熒光引導組(P=0.000),腫瘤全切率高于熒光引導組(P=0.031),WHO分級比例兩組差異具有統計學意義(P=0.036),而重要腦功能區腫瘤全切除程度(P=0.101)和術后并發癥發生率(P=1.000)組間差異無統計學意義(表2)。
本組術后有41例高級別(WHOⅢ級和Ⅳ級)膠質瘤患者輔以放療和替莫唑胺化療。隨訪6~12個月,有11例(20.75%)患者腫瘤復發,其中,熒光引導組8例,6例再次手術獲得全切除;聯合組3例,1例再次手術獲得全切除、2例放棄治療,兩組腫瘤復發率差異無統計學意義(P=0.138,表2)。

表2 聯合組與熒光引導組患者術后臨床資料的比較Table 2. Comparison of postoperative clinical data between combined group and fluorescence guidance group
討 論
熒光素鈉pH值為8時熒光染色最強,靜脈注射后有60%~80%與血清白蛋白結合,其余為游離熒光素,可產生強烈的熒光。膠質瘤呈侵襲性生長破壞血-腦屏障,熒光素鈉透過血-腦屏障進入腫瘤組織和腫瘤侵襲的腦組織,從而呈熒光染色,據此可清晰辨認出腫瘤邊界,術中指導腫瘤切除。Kuhnt等[11]于熒光素鈉引導下切除膠質母細胞瘤,術中清晰顯示腫瘤與正常腦組織的界限,且熒光染色區與術前CT/MRI增強區相吻合。Wu等[12]于熒光素鈉引導下切除多形性膠質母細胞瘤,腫瘤全切除率達84.4%,且未出現高劑量熒光素鈉導致的不良反應。國內陳大偉等[13]于熒光素鈉引導下切除腦膠質瘤,手術全切除率為80%。本組患者均靜脈注射熒光素鈉,術中熒光染色邊界與術中冰凍病理學和術后病理學結果相一致,證實強熒光區是腫瘤主體部分,弱熒光染區是術中常誤認為正常腦組織的部分,其中12例星形細胞瘤(WHOⅡ級)患者熒光染色不明顯,提示熒光素鈉染色在高級別膠質瘤切除術中可清晰顯示腫瘤邊界,從而提高腫瘤全切除率,但是對于血-腦屏障破壞不嚴重的低級別膠質瘤,熒光素鈉染色則不明顯。此外,熒光素鈉無法進入腫瘤細胞內,故其標記腫瘤的特異性較差,周圍正常腦組織亦可呈熒光染色[14],因此,熒光引導技術尚不足以用于無神經功能損害的腦膠質瘤的全切除。本研究熒光引導組有15例腫瘤位于重要腦功能區,其中15例行術中神經電生理監測,腫瘤全切除9例,全切除率為60%,可能與低級別膠質瘤血-腦屏障相對完整、熒光素鈉無染色有關。術后16例出現言語障礙、21例發生短暫性肢體活動障礙、6例出現精神障礙、8例發生顱內感染、2例出現少量硬膜外血腫,予脫水、甲潑尼龍沖擊、營養神經、鎮靜和抗感染對癥治療后,7天至3個月恢復。
近年來,隨著iMRI的應用,術者可以直觀分辨腫瘤邊界,辨別重要神經結構,糾正腦組織移位,從而判斷腫瘤切除程度,并使二次手術對腦組織的損傷最小化[15]。iMRI通過客觀的影像學證據,實時判斷有否腫瘤殘留,并在保護神經功能的前提下最大限度切除腫瘤,使術者操作更精準,降低手術損傷。Kuhnt等[16]和Woodworth等[17]認為,即使術者判斷顯微鏡下腫瘤全切除,仍有33%~67%殘留,單純采用神經導航系統也有約30%的腫瘤殘留。周權煒等[18]在41例島葉膠質瘤切除術中行MRI檢查,腫瘤全切除16例,次全切除18例,大部切除7例。丁大領等[19]在28例丘腦膠質瘤切除術中行MRI檢查,腫瘤全切除率達71.43%(20/28)。Hofmann等[20]的研究顯示,術中高場強(1.5T)MRI對殘留腫瘤診斷的靈敏度為98%,特異度為94.3%,準確度為96.1%,顯著優于術中超聲和術中低場強(0.15T)MRI。本研究有25例術前行多模態MRI導航,精確定位腫瘤體表投影,得以設計手術切口和骨窗,明確腫瘤、腦功能區、神經傳導束和神經血管的解剖關系,從而制定手術入路和策略,并于術中神經電生理監測下盡可能保留神經功能,于熒光引導下最大限度切除腫瘤,術中首次MRI顯示13例腫瘤全切除,余12例腫瘤位于重要腦功能區有不同程度殘留,更新手術計劃后最終10例全切除,2例因殘留腫瘤緊鄰重要皮質功能區或者皮質下傳導束而次全切除,術后出現言語障礙6例、短暫性肢體活動障礙8例、精神障礙2例、顱內感染3例,硬膜外血腫1例,經對癥治療后于7天至3個月恢復正常,表明術中高場強MRI聯合熒光引導下腦膠質瘤切除術可以降低術后永久性神經功能障礙發生率,提高患者生活質量、延長無進展生存期。
本研究有33例(62.26%)腫瘤位于重要腦功能區,分別位于運動區17例、語言區11例、丘腦5例,腫瘤全切除25例(75.76%),次全切除8例(24.24%),而聯合組與熒光引導組腫瘤全切除率差異無統計學意義,可能是由于聯合組重要腦功能區腫瘤次全切除僅2例,樣本量太小,今后尚待擴大樣本量進一步驗證。本組患者術后隨訪6~12個月,平均9個月,有11例(20.75%)腫瘤復發,其中,熒光引導組8例,6例再次手術獲得全切除;聯合組3例,1例再次手術獲得全切除、2例放棄治療,兩組腫瘤復發率差異無統計學意義。聯合組手術時間較熒光引導組耗時2~3小時,術中行MRI檢查時術者及相關人員均及時撤離至中控室,掃描完成后所有人員重新更換無菌手術衣,關顱時以含萬古霉素的生理鹽水反復沖洗術區,從而有效減少顱內感染。
綜上所述,術中高場強MRI聯合熒光引導技術可以顯著提高腦膠質瘤全切除率,同時盡可能保留重要腦功能區和神經結構,提高患者生活質量和延長無進展生存期。
利益沖突無

