實時影像融合的超聲虛擬導航技術用于腹腔寡轉移腫瘤射頻消融治療8例
谷春苗 徐飛 謝貴林 王敏
腹膜腔轉移是許多惡性腫瘤常見的轉移途徑,不同大小的轉移性腫瘤可以發生在從膈肌到盆腔的任何位置[1]。部分患者原發病灶已手術切除,當發現腹腔寡轉移病灶時,特別是全身治療效果佳的患者,強烈要求切除病灶,但手術對機體損傷大,有些患者不能耐受,因此研究一種微創、有效的方法代替傳統外科手術將有重要意義。筆者使用實時影像融合的超聲虛擬導航技術對二維超聲難以顯示清楚的原發腫瘤術后腹腔寡轉移腫瘤進行消融治療,取得良好效果,現報道如下并對此技術在射頻消融治療中的應用價值作一探討。
1 對象和方法
1.1 對象 選取2019年1至11月在紹興文理學院附屬醫院肝細胞性肝癌術后發現腹腔寡轉移腫瘤的患者8例,男6例,女2例,平均年齡58歲。納入標準:(1)原發腫瘤已切除,CT、MRI檢查顯示原發臟器未見復發病灶;(2)增強 CT、MRI檢查提示腹腔可見轉移腫瘤;(3)活檢提示腫瘤為原發腫瘤的腹腔轉移灶。排除標準:(1)腹腔轉移性腫瘤>2個,單個病灶最大直徑>5 cm;(2)影像學提示血管受侵征象、有其他臟器轉移或已出現腹腔積液;(3)凝血功能障礙:PLT<50×109/L,PT 延長>3 s;(4)有嚴重心、肺功能障礙不能耐受射頻消融治療。本研究經本院醫學倫理委員會批準,所有患者均簽署知情同意書。
1.2 儀器 超聲檢查采用GE Logiq晶準E9彩色多普勒超聲儀(美國GE公司),實時虛擬導航技術采用GE Logiq E9超聲配備的圖像融合導航計劃系統和磁定位器套件等,凸陣探頭 C1-9,頻率 3.5~5.0 MHz。射頻消融治療采用Olympus Celon POWER系統,射頻發生器頻率 460~480 kHz,最大功率 200~250 W,電極針 14~16 G。
1.3 方法
1.3.1 術前準備 經增強MRI檢查明確腹腔占位,增強MRI與超聲融合導航下穿刺活檢,病理診斷明確。術前充分清潔腸道并禁食、水24 h以上,根據腫瘤位置及大小選擇消融針,確定進針點、最佳進針路線和進針角度,制訂布針方案。對較大病灶則根據腫瘤的大小及形態設計成多個消融區,進行多點布針,逐次消融。
1.3.2 術中操作 患者全麻,消毒鋪巾、超聲儀套無菌套及探頭套,將增強CT或增強MRI圖像導入GE Logiq E9圖像融合導航計劃系統。圖像配對采用兩步法:第一步,超聲圖像與CT或MRI圖像利用脾靜脈、腹腔干、雙腎動脈起始部3個固定的解剖標志進行第1次配對。第二步,對腫瘤周圍結構以及腫瘤中心位置進行第2次配對。精準配對成功后,實現同步顯示圖像,按預先制定的方案,在實時超聲引導下多影像學融合對比進針進行射頻消融(圖1、2)。操作時應注意以下幾個方面:(1)操作者應熟練掌握實時影像融合的超聲虛擬導航系統以及超聲引導下射頻消融技術,使因技術產生的并發癥發生率降到最低;(2)對于腫瘤周邊緊鄰腸管、血管等重要組織器官時,在其軟組織中注入0.9%氯化鈉注射液,增大兩者的距離;(3)盡量一次性穿刺成功,避免多次穿刺腫瘤,如射頻電極針已進入腫瘤,仍需調整位置時,須原位消融后再回撤調整,消融結束后出針要注意燒灼針道,以減少穿刺針道轉移的機會[2]。
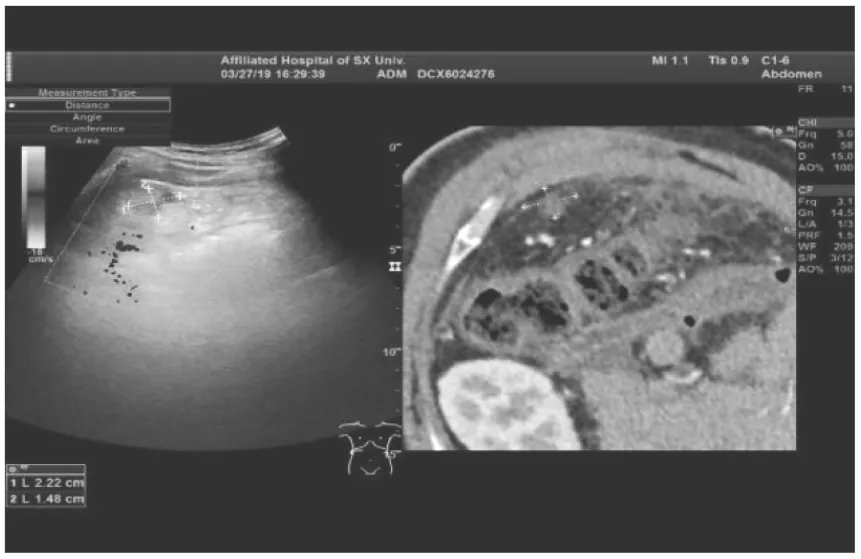
圖1 超聲虛擬導航術中精準匹配
1.3.3 術后監測與復查 術后密切監測和復查肝腎功能、血常規和超聲,以及時發現并處理消融相關并發癥。術后1個月復查增強MRI。
1.4 療效評價
1.4.1 術中指標 圖像融合成功判定:設定當腫瘤周圍3個解剖結構的對位誤差均約5 mm時,為圖像融合成功,否則為圖像融合失敗。圖像融合成功率=(圖像融合成功病灶數/總病灶)×100%。
1.4.2 并發癥和死亡情況 觀察射頻消融術中及術后出血、胃腸穿孔等并發癥和死亡發生情況。
1.4.3 消融率 術后1個月復查。判定標準[2]:(1)病灶完全消融:患者復查增強 CT或MRI,腫瘤所在區域為低密度(超聲表現為高回聲),動脈期未見強化;(2)不完全消融:肝臟三期CT/MRI或超聲造影隨訪發現,腫瘤病灶內局部動脈期有強化,提示腫瘤殘留。消融有效率=[(部分消融病灶數+完全消融病灶數)/總病灶數]×100%,完全消融率=(完全消融病灶數/總病灶數)×100%。
2 結果
本組8例患者虛擬導航下超聲檢查顯示病灶最大直徑18.7~48.6 mm,平均26.25 mm,其中右上腹5例,胃周3例;腫瘤圓形2例,橢圓形3例,不規則形3例。8例患者虛擬導航匹配成功率100%,其中3例消融術后有殘留,消融有效率100%(8/8),完全消融率62.5%(5/8)。腫瘤殘留的3例患者影像學顯示,1例位于右上腹腹膜中,增強MRI檢查顯示有一較粗的動脈緊貼腫瘤,術后1個月增強MRI復查顯示殘留腫瘤位于動脈血管周圍。1例腫瘤位于橫結腸與小腸之間,形態不規則,因腸道氣體影響,超聲下橫結腸后側部分腫瘤顯示欠清。最后1例腫瘤直徑48.6 mm,且緊鄰胃竇,消融時為避免損傷胃壁,而未能使腫瘤達到完全消融。
本組患者術中及術后未發生與消融相關的出血、胃腸穿孔等嚴重并發癥,無一例死亡,均在術后1周內出院。腹腔寡轉移腫瘤消融前后對比如圖3、4。
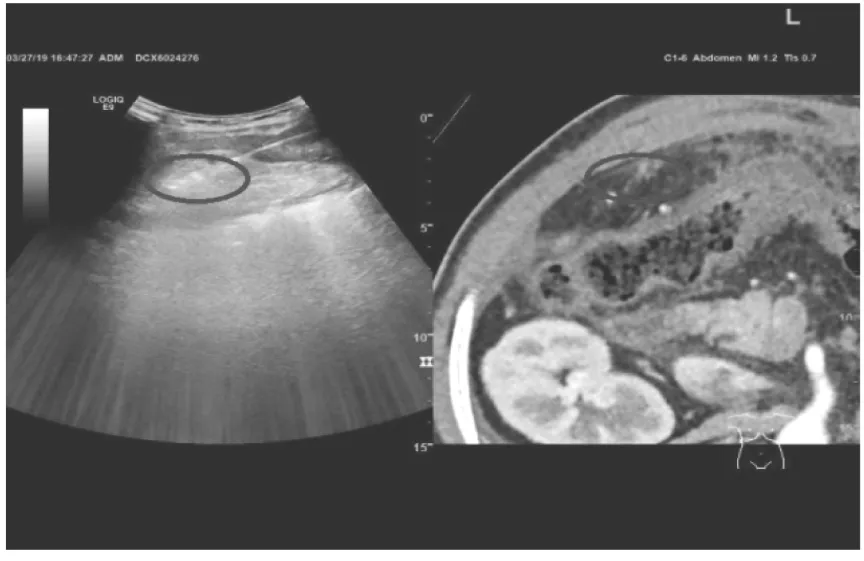
圖2 射頻消融腹腔寡轉移腫瘤
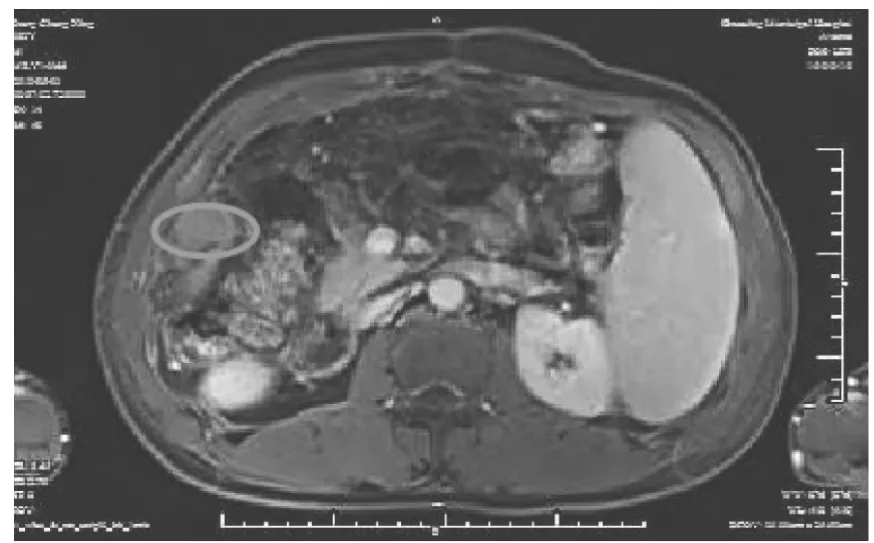
圖3 射頻消融前增強MRI圖像顯示右肝下大網膜轉移病灶
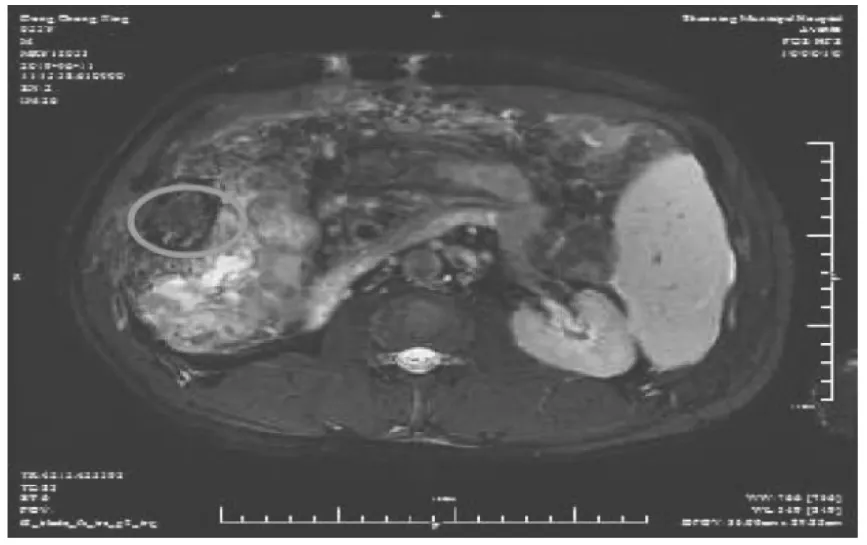
圖4 射頻消融治療1個月增強MRI圖像顯示后轉移病灶未擴散
3 討論
原發腫瘤術后產生腹腔轉移性腫瘤的患者,病情發展快、預后差,但隨著醫療技術的發展,實體腫瘤的治療模式由單一治療逐漸向多學科聯合治療轉變,而在眾多的非手術切除治療方式中,射頻消融以其創傷小、安全有效、可重復性強等優點,在腫瘤的治療中得到了越來越廣泛的應用[3-5]。基于影像融合的超聲虛擬導航技術在腹腔寡轉移腫瘤射頻消融中的應用就是多學科聯合治療腫瘤的一個重要組成部分,本組患者治療有效率達100%,完全消融率達62.5%。
原發腫瘤術后,受腹腔組織粘連、腸腔氣體以及消融術中產生的氣體影響,腹腔轉移性腫瘤及其周圍組織在二維超聲下顯示不佳或僅部分顯示,選擇消融穿刺路徑時,難以準確避讓重要結構[6]。虛擬導航技術采用磁定位系統對位,融合了CT/MRI靜態圖像和常規超聲實時成像,既可以利用CT/MRI準確、敏感的空間分辨能力,又可以保留超聲實時動態顯示的優勢,以便顯示常規超聲難以顯示和定位的腹腔轉移性腫瘤[7-8],便于術前手術方案的制定[9]。
術中操作過程采取兩觀察法:(1)觀察消融區域,尤其是消融氣化增強區域,使增強區完全包裹腫瘤,對不規則腫瘤采用分塊消融,使消融范圍能完全包裹腫瘤,但又避免過度消融。(2)觀察腸蠕動情況,以確保手術安全。當射頻針穿刺進入腫瘤時,緊鄰的腸管同時被固定,腸蠕動消失,當消融熱量傳到腸壁時,在自我保護機制下,腸內會有液體通過,帶走熱量,并且隨著消融熱量傳至腸壁增多,腸腔內通過的液體隨之增多,進而腸蠕動亢進。本組中3例患者為確保消融徹底,略增大了消融范圍,術后按照胃腸手術標準護理,均未見腸穿孔等并發癥。
術后1個月復查增強MRI提示腫瘤有殘留3例,1例緊鄰腸系膜動脈,血液流動帶走了一部分熱量導致腫瘤未能完全滅活。受到鄰近膈肌、胃腸道等危險臟器的病變在微波消融時可以采用人工胸腹水的方法降低并發癥[8]的啟發,在后續1例類似患者治療中,在腫瘤和動脈間隙注入0.9%氯化鈉注射液,人為造成組織水腫帶壓迫血管,術后復查該腫瘤完全消融。另1例受腸道氣體影響,腫瘤局部顯示欠清,導致消融不全,后續方案中利用虛擬導航精準確定目標穿刺后,針尖向遠離腸腔側加壓,使腸腔遠離,以提高腫瘤完全消融率。最后1例腫瘤直徑48.6 mm,因腫瘤較大且緊鄰胃竇導致消融不完全,后續消融時,在兩者間隙中注入0.9%氯化鈉注射液,增大間隙,同時先在緊鄰區小范圍消融,然后再次布針大范圍消融相對安全區的腫瘤,以提高腫瘤完全消融率。
本組患者術中及術后未發生與消融相關的死亡、出血以及胃腸穿孔等嚴重并發癥。但本研究尚存在不足之處,由于原發腫瘤術后發生腹腔寡轉移腫瘤的患者中位生存期短,導致消融治療的遠期效果如何無從考證;其次本研究為小樣本研究,因此無法進行多種危險因素的分析。
綜上所述,實時影像融合的超聲虛擬導航射頻消融技術在原發腫瘤術后腹腔寡轉移腫瘤局部治療上是有價值的,其安全、微創、可靠,可作為原發腫瘤術后腹腔寡轉移腫瘤全身治療中的有效補充。

