探討腦膠質瘤中IDH1/2、TERT 基因分布的相關性及其意義
李秋燕,黃發明,張凱元,谷云艷,莫彥妮,夏春波,朱琳*
(1.桂林醫學院臨床醫學院,廣西 桂林 541000;2.桂林醫學院附屬醫院病理科,廣西 桂林 541000;3.桂林醫學院基礎醫學院,廣西 桂林 541000)
0 引言
在中樞神經系統原發性惡性腫瘤中,具有高發病率和高病死率等特點的膠質瘤是最常見的。目前我國膠質瘤發病率呈現逐年上升趨勢,盡管通過結合手術、放化療和其他輔助治療進行治療可以取得一定的療效,但高級別膠質瘤患者的預后仍然令人沮喪,中位生存期僅為10 至15 個月[1]。在過去的十年里,神經膠質瘤的分子特征有了顯著的發展。分子標記是2016 年世界衛生組織(WHO)給中樞神經系統腫瘤分類增加的新組成部分,對膠質瘤的臨床病理診斷和預后產生深遠影響[2]。Parsons 等[3]在2008 年,通過對蛋白質編碼基因的研究測序和分析,最先發現異檸檬酸脫氫酶1(isocitrate dehydrogenase 1,IDH1)的基因突變在膠質母細胞瘤中大約占比12%。隨之,越來越多的研究人員逐漸發現在低、高級別膠質瘤以及繼發性膠質母細胞瘤中IDH1/2 突變普遍存,可作為其初步判斷預后結果的標志,并在腫瘤的發生、發展以及演變過程發揮著重要作用。膠質瘤中另一個重要的突變是端粒酶逆轉錄酶(TERT)突變[4],包括C228T 和C250T 兩種類型,TERT 基因啟動子突變會導致不良預后[5]。目前已經發現對于神經膠質瘤診斷、治療和預后起著積極意義的分子標志物有異檸檬酸脫氫酶(IDH)、端粒酶逆轉錄酶(TERT)、1p19q、表皮生長因子受體(EGFR)、O6-甲基鳥嘌呤-DNA 甲基轉移酶(MGMT)等。本研究旨在探究IDH1/2,TERT 基因啟動子區突變在不同病理級別腦膠質瘤中分布的聯系性及意義。
1 材料與方法
1.1 一般資料
采集2016 年1 月至2019 年12 月在桂林醫學院附屬醫院神經外科行腦膠質瘤切除術并且經病理確診為腦膠質瘤患者的60 例腫瘤組織標本及尸檢獲取的正常腦組織標本各30例,其中膠質瘤患者年齡為22 歲至71 歲,平均44.8 歲;尸檢患者年齡為0 歲至78 歲,平均43.0 歲。患者術前均未接受過放療和化療,排除病理質量較差的病例及合并其他惡性腫瘤的標本。標本均經桂林醫學院附屬醫院病理科2名經驗豐富的醫師進行診斷并確診為腦膠質瘤,根據研究目的按照2016 版WHO 中樞神經系統腫瘤分類標準將標本分為高級別組(Ⅲ級、Ⅳ級)和低級別組(Ⅰ級、Ⅱ級)以及正常組(正常腦組織),如圖1 所示,其標本數量依次分別為37 例,23 例和30 例。
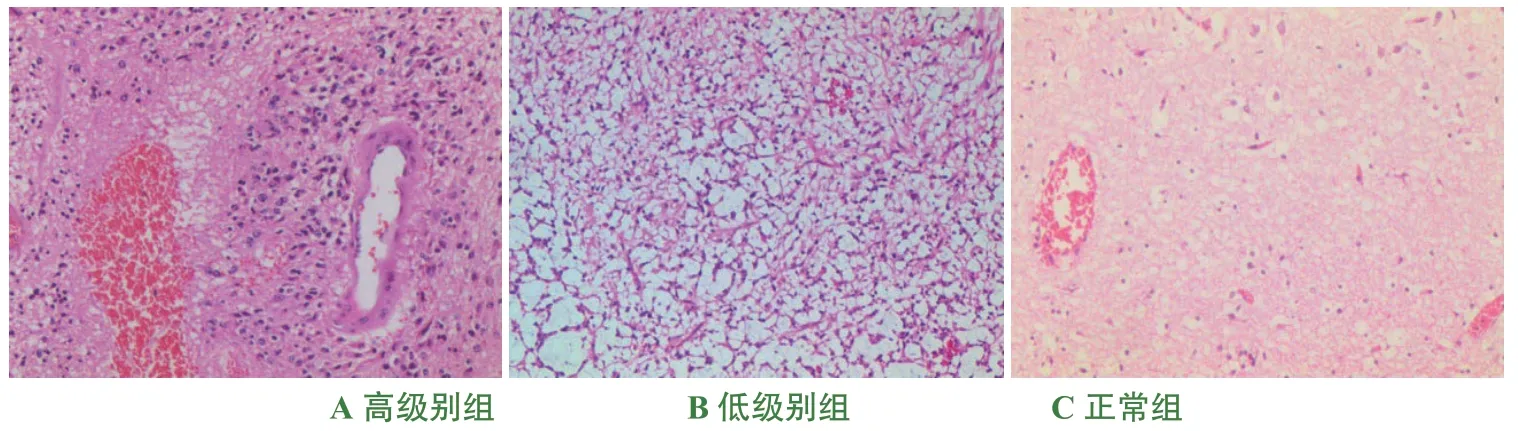
圖1 不同病理級別腦膠質瘤HE 染色
IDH1/2 基因突變與TERT 基因啟動子區突變檢測
1.1.1 腦膠質瘤組織樣本DNA 的提取
①參照北京泛生子生物科技有限公司提供的試劑說明書準備好60 例膠質瘤和30 例尸檢標本的蠟卷各10 卷,編好號后依次置于1.5mL 無菌離心管中,向離心管內加入1mL 二甲苯,劇烈渦旋離心后棄上清。②將1mL 無水乙醇加入上述管中,渦旋混勻離心后棄上清,待乙醇揮發后加入200μ1 緩沖液GA 和20μl Proteinase K 進行孵育裂解。③在上管中加入220μl 緩沖液GB 和250μl 無水乙醇,渦旋震蕩短暫離心后將混合液轉移至對應的吸附柱CR2 中并進行離心。④倒掉廢液,重新將吸附柱放回收集管中并向吸附柱CR2 中加入500μl 緩沖液GD,離心后倒掉收集管中的廢液。⑤加600μl漂洗液PW 于吸附柱CR2 中,離心后倒掉收集管中的廢液,將吸附柱開蓋晾干殘余漂洗液。⑥將吸附柱CR2 轉入一個對應編號的干凈離心管中,懸空滴加65℃預熱的60μl 洗脫緩沖液TE 后離心,收集到相應樣本DNA。
1.1.2 實時熒光定量PCR 技術檢測IDH1/2 基因突變與TERT 基因啟動子區突變
①使用分光光度計檢測待檢樣本DNA 濃度。按照DNA濃度為10ng/L 的標準,用去離子水稀釋待檢樣本,制成待檢DNA 樣品,并制備等體積的陰性對照品。②將融化好的檢測試劑和陽性對照品短暫離心后置于冰上,制備等體積的陽性對照品。③往已裝有待檢DNA、陰性對照及陽性對照的PCR管中加入Taq DNA 聚合酶,混勻后短暫離心。④打開裝有檢測試劑的8 聯管管蓋,將待檢DNA、陰性對照和陽性對照按3μ1/孔分別加至檢測試劑的不同反應孔中,混勻后短暫離心立即上機檢測。
1.2 統計學分析
本研究所涉及的統計學分析選用SPSS 20.0 統計軟件進行。IDH1/2 基因突變和TERT 啟動子基因突變在不同病理級別腦膠質瘤組織中的分布差異采用χ2檢驗,二者相關性選用Spearman 相關分析,以P<0.05 為差異具有統計學意義。
2 結果
2.1 在不同病理級別腦膠質瘤中IDH1/2 基因突變的檢測分布結果
IDH 基因突變型在60 例腦膠質瘤標本中共發現26 例(總突變率43.33%),包括高級別組37 例,突變型12 例(突變率32.43%);低級別組23 例,突變型14 例(突變率60.87%)。檢測結果顯示在不同級別腦膠質瘤中IDH 基因突變的分布差異具有統計學意義(P<0.001),詳見表1。IDH 基因突變型與野生型擴增曲線圖詳見圖2。

表1 IDH 基因突變在不同級別腦膠質瘤中的分布情況表
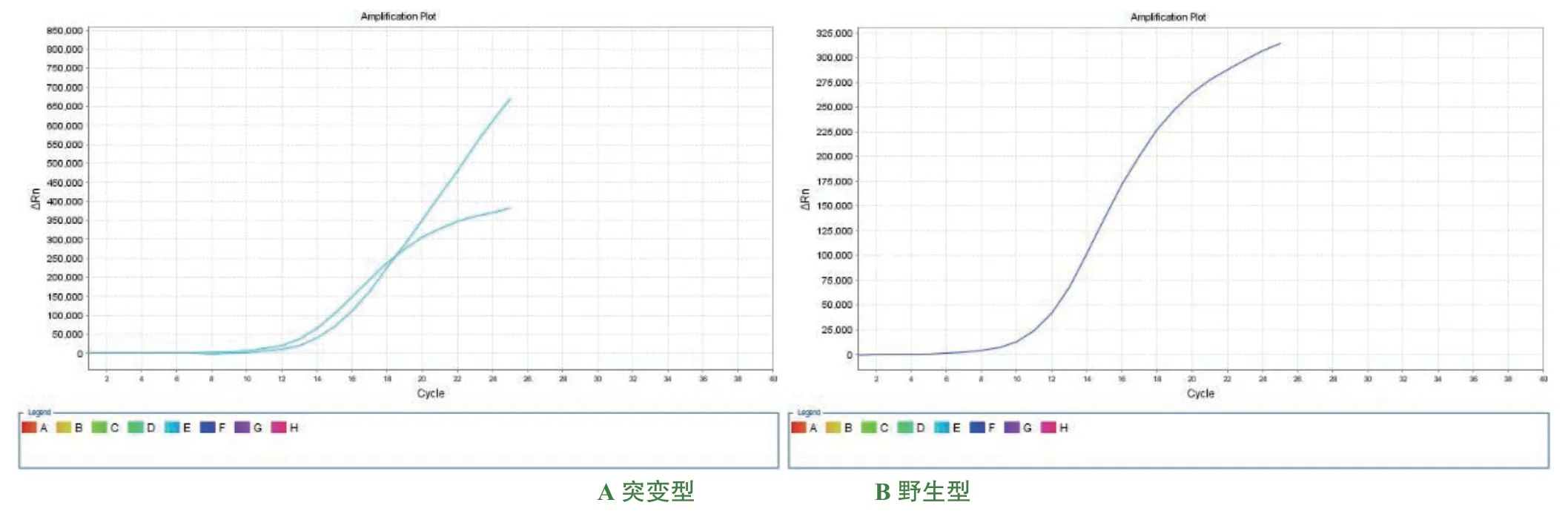
圖2 IDH 基因突變型與野生型擴增曲線圖
2.2 在不同病理級別腦膠質瘤中TERT 基因啟動子區突變的檢測分布結果
TERT 基因啟動子區突變型在60 例腦膠質瘤中發現共有32 例(總突變率53.33%),其中23 例C228T 位點突變,9例C250T 位點突變。高級別組37 例,突變型17 例(突變率45.95%);低級別組23 例,突變型15 例(突變率65.22%)。檢測結果表明,低級組的TERT 基因啟動子突變的分布明顯高于高級組和正常組,差異有統計學意義(P<0.001),見表2;TERT 基因啟動子突變型與野生型擴增曲線圖詳見圖3。
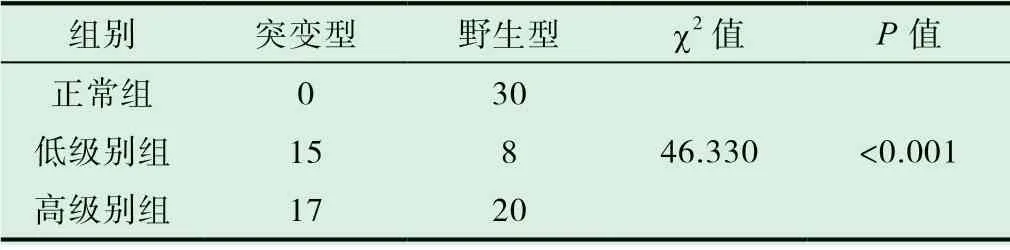
表2 TERT 基因啟動子區突變在不同級別腦膠質瘤中的分布情況表

圖3 TERT 基因突變型與野生型擴增曲線圖
2.3 IDH 基因突變與TERT 基因啟動子區突變相關性分析
我們通過進一步Spearman 相關分析,探究了IDH 基因突變與TERT 基因啟動子區突變的相關關系,發現IDH 基因突變、TERT 基因啟動子區突變呈負相關(r=-0.396,P<0.01)。詳見表3。

表3 IDH 基因突變與TERT 基因啟動子區突變的相關性
3 討論
高級別膠質瘤是中樞神經系統腫瘤中最常見的最具侵襲性和致命性的彌漫性惡性腫瘤[6],其總體生存期并不長[7]。目前臨床上膠質瘤的主要治療方式仍然是依賴手術切除結合術后化療,但是其治療的總體效果較差,生存時間短,生活質量大大降低。所以,找到有效的治療策略和方法去提高患者的生存質量和時間。目前新的分子標記物的出現為膠質瘤的診斷、預后及改善生存率提供了可能,近年來的熱門研究課題也逐漸向IDH1/2 基因突變和TERT 基因啟動子突變傾斜,并且其也是分子標記研究相對較多、較熟悉且有價值的領域。IDH 是三羧酸循環中關鍵限速酶,研究多次證明IDH1/2 與腫瘤的發生、發展、預后相關,梁博等[8]發現,具有IDH1 突變的膠質母細胞瘤的患者總生存期比野生型長,這也間接證實了IDH1 基因突變可能會與神經膠質瘤的發生和預后密切相關。同時,研究發現IDH1/2 突變相對獨立并且相互排斥,同時發生的情況并不多見[9]。此外,發現IDH 基因突變與膠質瘤的病理分型也可能存在某種聯系,在鑒別與診斷上起到重要意義[10-13],與本研究結果在不同級別腦膠質瘤中IDH 基因突變的分布存在差異一致。另有研究表明IDH 基因突變可作為臨床醫生發現早期膠質瘤患者的提示,這也就對于確診患者為神經膠質瘤和其腫瘤分級以及預估術后腦膠質瘤患者生存時間同樣是具有重要參考價值。
TERT 基因啟動子區突變最先在黑色素瘤中發現[14],其后證實在腦膠質瘤中也存在TERT 基因啟動子區突變[15],對膠質瘤的形成和發展起重要作用[16]。突變后的TERT 能夠產生兩個結構相同的啟動子結合域,使轉錄活性成倍的增加,進而使端粒酶的活性增強并抑制腫瘤細胞的凋亡[17-18]。Nonoguchi 等人[19]研究發現TERT 啟動子突變多位于C228T和C250T,且C228T 突變患者預后差于C250T 突變。另有研究表明端粒的維持可能是腦癌形成的必要前提[20],在WHOⅡ級和膠質母細胞瘤中具有一定的預后評估價值[21]。本研究中,在60 例腦膠質瘤中有32 例發生TERT 基因啟動子區突變,其中23 例發生C228T 位點突變,9 例發生C250T 位點突變,且在低級別組中的突變率明顯高于高級別組及正常組,提示突變可能對患者預后提供評估價值。
Nonoguchi 等[19]研究發現TERT 基因突變和IDH1 基因突變存在互斥現象,認為TERTp-mut 對腫瘤不良預后的預測價值很大程度上是得益于其與IDH1/2 突變的負相關性。本研究結果顯示IDH 基因突變與TERT 基因啟動子區突變存在明顯負相關,與上述研究結果相似。Killela 等[22]和Zachary等[23]研究表明TERT 啟動子區突變和IDH1/2 突變在不同亞型的膠質瘤中也明顯存在著分布差異。有研究[24]發現同時存在IDH1/2 突變和TERT 啟動子區突變時高級別膠質瘤患者的個體生存期最長,其次為僅存在IDHI/2 突變的研究組,預后較差的是無兩者中任何突變和僅存在TERT 啟動子區突變的患者。這種現象可能與IDH1 突變和TERT 基因啟動子突變的協同作用有一定的聯系。它們互相影響于彼此的下游信號通道,并使TERT 啟動子的轉錄活性下降。因此,TERT基因突變的患者預后較差。
本研究結果顯示在腦膠質瘤中IDH1/2 基因突變與TERT基因啟動子區突變存在明顯相關性,但是仍舊需要進一步的實驗以確認它們之間的相互作用,并探討IDH1/2 基因突變與TERT 基因啟動子區突變在膠質瘤發生、發展的作用機制,以期發現更多腫瘤標志性基因以及靶向用于臨床。目前雖然IDH1/2 和TERT 基因等分子靶向基因檢測尚處于早期階段,但隨著更深入的研究,快速、低價和精準的分子手段一定會為臨床治療提供新的途徑和方法,提高腦膠質瘤患者的生活質量以及改善預后,推進膠質瘤患者的個體化治療。

