miRNA-192-5p在多發性骨髓瘤中的表達水平及其調控機制研究
李嵐,鄭研,高瑛,張維華,侯麗敏,高秋英
(陜西省人民醫院血液內科,西安 710068)
多發性骨髓瘤(MM)是一種惡性漿細胞病,約占所有血液腫瘤的10%。70%的MM患者出現嚴重骨痛,伴有溶骨性骨損傷,這是由于破骨細胞骨吸收增加和成骨細胞骨形成減少所致[1-2]。其特點是骨髓漿細胞惡性增殖,導致造血功能不全和骨溶解性骨病。此外,單克隆免疫球蛋白的過度產生可能導致有害的組織沉積,導致腎衰竭或淀粉樣變,從而影響心臟或腎臟等關鍵器官[3-4]。miRNAs是一種短鏈內源性非編碼、高度保守的RNA,通過與3′-非翻譯區(3′-UTR)mRNA結合,抑制靶基因的表達。根據以往的研究,miRNAs參與了許多細胞過程,包括細胞增殖、侵襲、凋亡等[5]。許多研究已經證明miRNAs的異常表達在腫瘤細胞中起著重要的作用,在癌癥發生和發展中扮演重要角色。大量研究表明miR-192-5p在惡性腫瘤中表達顯著下調,而miR-192-5p的過表達可能通過不同的機制抑制腫瘤的發生[6-9]。在人骨髓瘤中,miR-192-5p抑制骨髓瘤的發生。然而,miR-192-5p調節骨髓瘤發生和發展的潛在機制仍不清楚。本研究旨在探討miR-192-5p在多發性骨髓瘤中的表達水平及其調控機制。
1 材料與方法
1.1 材料 多發性骨髓瘤U266細胞株購自中國科學院上海細胞庫,對照標本為正常志愿者骨髓單個核細胞,已取得知情同意。胎牛血清、RPMI-1640培養基均購自美國GIBCO公司;Trizol試劑、Lipofectamine 2000購自美國Invitrogen公司,逆轉錄試劑盒購自日本Takara公司。
1.2 細胞培養 多發性骨髓瘤U266細胞株接種于含10%胎牛血清的RPMI-1640培養基中,在37 ℃,5%CO2恒溫細胞培養箱中培養,傳2~3代進行實驗。
1.3 qRT-PCR檢測miR-192-5p的表達 按照Trizol試劑說明書提取細胞總RNA,使用逆轉錄試劑盒合成cDNA,引物由廣州銳博生物技術公司合成,miR-192-5p引物序列為miR-192-5p-F:5'-GTGGACCTGACCTGCCGTCT-3',miR-192-5p-R:5'-GGAGGAGTGGGTGTCGCTGT-3';U6引物序列為U6-F:5'-CTCGCTTCGGCAGCACA-3',U6-R:5'-CGCTTCACGAATTTGCG -3'。根據試劑盒說明書配置PCR反應體系,反應條件為:95 ℃預變性3 min;95 ℃變性10 s;60 ℃退火30 s;72 ℃延伸25 s,循環40次。U6為 miR-192-5p的內參,記錄每個反應管中的熒光信號到達所設定的閾值時所經歷的循環數Ct值,以2-ΔΔCt計算miR-192-5P的相對表達量,ΔCt=Ct目的基因-Ct內參,ΔΔCt=實驗組 Ct-對照組Ct。
1.4 細胞轉染 取對數生長期U266細胞以1×105/孔密度接種于6孔板中,培養24 h。當細胞融合度為70%左右時開始進行轉染,按照Lipofectamine 2000試劑盒(美國Invitrogen公司)說明書進行操作,實驗設置4組,分別為miR-192-5p mimics組、mimics control 組、miR-192-5p inhibitor組、inhibitor control組。轉染后6 h換10%胎牛血清的RPMI-1640培養基,轉染后48 h收集細胞用于后續實驗。
1.5 CCK-8增殖實驗 利用CCK-8法檢測轉染后細胞的增殖情況,以5 000/孔的細胞密度接種于 96 孔板中,每組準備3個96孔板,在24、48、72 h 時分別取一個96孔板,每孔中加入10 μL CCK-8 試劑,在37 ℃細胞培養箱中繼續培養 2 h后,使用酶標儀檢測450 nm處各孔吸光度值(OD值)。
1.6 細胞劃痕實驗 在恒溫孵箱中培養,等細胞長滿視野時進行后續實驗。將轉染的細胞在6孔板中培養24 h,用marker筆在6孔板背后,用直尺比著劃橫線。使用無菌的10 μL移液器槍頭盡量垂直于背后的橫線劃痕,保證槍頭劃痕時垂直。劃好后用磷酸緩沖鹽溶液(PBS)清洗細胞3次,去除劃下的細胞,加入無胎牛血清的培養基。放入培養箱中培養,培養0、24、48、72 h拍照記錄。
1.7 Transwell體外侵襲轉移實驗 實驗前細胞撤血清饑餓培養12~24 h,進一步去除血清的影響。胰蛋白酶消化細胞后離心,棄去培養液,PBS清洗1~2遍,無血清培養基重懸,調整細胞密度為1×106/mL,將Matrigel預涂到8 μm Transwell中。取細胞懸液100 μL加入Transwell小室上室,500 μL含10%胎牛血清的培養基加入下室進行化學誘導,置于細胞培養箱孵育24 h。用無菌棉簽輕度擦拭除去濾膜上的Matrigel基質膠和細胞,4%多聚甲醛固定10 min、結晶紫染色 1 min,PBS 清洗 5 min,在顯微鏡下觀察小孔膜表面的細胞并計數。
1.8 流式細胞術檢測細胞凋亡 使用Annexin V-FITC染色試劑盒對細胞進行凋亡檢測,收集各組轉染后培養48 h的U266細胞,將細胞低速離心(1 500 r/min)5 min,用PBS洗滌細胞2次,加入結合緩沖液制成細胞懸液;按試劑盒說明書中建議的試劑體系用量依次加入5 μL Annexin V-FITC、碘化丙啶(PI,10 mg/L)后輕輕混勻,在室溫下避光孵育15 min,設置調整流式細胞儀進行流式細胞檢測。
1.9 靶基因預測及驗證 應用四個miRNA靶基因預測網站TargetScan (http://www.targetscan.org/)、miRBase(http://www.mirbase.org/)、microRNA(http://www.microrna.org/)、miRDB(http://www.mirdb.org/)預測 miR-192-5p的候選靶基因,結合既往研究結果,選擇USP1作為候選靶基因。
將野生型和突變型USP1 3′-UTRs序列插入到pmirGLO載體(美國Promega公司)中,Lipofectamine 2000試劑盒測定熒光素酶值。構建含有 USP1基因 3′-非翻譯區(Untranslated Regions,UTR)潛在結合位點的熒光素酶報告基因載體質粒,包括野生型USP1基因 3′-UTR(WT-USP1 3′-UTR)和突變型 USP1基因 3′-UTR(MUT-USP1 3′-UTR),放于-20 ℃冰箱中保存備用;將構建好的 WT-USP1和 MUT-USP1分別與miR-192-5p mimics 或mimics control共轉染入中,實驗分為4組:miR-192-5p mimics+ USP1+WT,miR-192-5p mimics+ USP1+MUT,mimics control + USP1+WT,mimics control + USP1+MUT。轉染48 h后,PBS 溶液洗滌 3 次,按雙熒光素酶報告系統檢測試劑盒說明書操作,收集細胞,檢測細胞內熒光素酶活性。
1.10 Western-blot檢測 收集轉染48 h后的細胞,加入適量的RIPA裂解緩沖液,離心后提取細胞內總蛋白,采用BCA法檢測蛋白濃度。用10% SDS-PAGE上樣緩沖液電泳分離所有蛋白,并將其電轉移到PVDF膜上,室溫下搖床封閉1 h,然后在4 ℃下與一抗USP1和GAPDH孵育過夜。用TBST清洗5次后,在室溫下用二抗孵育1 h。然后再次用TBST清洗膜3次后采用ECL化學發光法顯色。以GAPDH作為內參,采用Western blot技術常規方法操作來檢測各組USP1蛋白的表達水平。
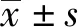
2 結果
2.1 miR-192-5p在骨髓瘤細胞中的表達 通過熒光定量PCR檢測MM細胞株U266和正常人骨髓單個核細胞中miR-192-5p的表達水平相比,miR-192-5p在MM細胞株U266中的表達量(0.41±0.03)顯著低于對照組(0.98±0.05),t=16.932,P<0.01。
2.2 miR-192-5p對U266細胞增殖能力的影響 通過CCK-8實驗結果顯示,轉染miR-192-5p mimics組24 h(0.45±0.05)、48 h(1.01±0.09)、72 h(1.55±0.16)后U266細胞增殖活力顯著低于對照組24 h(0.89±0.09)、48 h(1.70±0.16)、72 h(2.64±0.29);t=7.402,P<0.01;t=6.510,P<0.01;t=5.700,P<0.01;轉染miR-192-5p inhibitor組24 h(0.92±0.08)、48 h(1.89±0.21)、72 h(2.85±0.27)后U266細胞增殖活均顯著高于對照組24 h(0.64±0.07)、48 h(1.15±0.13)、72 h(1.84±0.20);t=4.562,P<0.05;t=5.190,P<0.01;t=5.206,P<0.01。
2.3 miR-192-5p對U266細胞遷移能力的影響 通過細胞劃痕實驗探討miR-192-5p對U266細胞遷移的影響,結果顯示,轉染miR-192-5p mimics組U266細胞的遷移率(23.11±3.55)顯著低于對照組(59.63±6.61),t=8.431,P<0.01;轉染miR-192-5p inhibitor組U266細胞的遷移率(45.39±4.88)顯著高于對照組(31.02±3.52),t=4.137,P<0.05。
2.4 miR-192-5p對U266細胞侵襲能力的影響 通過細胞劃痕實驗探討miR-192-5p對U266細胞侵襲的影響,結果顯示,轉染miR-192-5p mimics組U266細胞的侵襲數(125.13±17.63)顯著低于對照組(330.34±37.55),t=8.568,P<0.01;轉染miR-192-5p inhibitor組U266細胞的侵襲數(370.51±30.44)顯著高于對照組(290.67±18.97),t=3.856,P<0.05。
2.5 miR-192-5p對U266細胞凋亡能力的影響 流式細胞儀檢測細胞凋亡結果顯示,過表達miR-192-5p組細胞凋亡率(27.18±3.21)高于對照組(12.96±1.18),t=7.202,P<0.001;抑制miR-192-5p組細胞凋亡率(14.53±1.67)低于對照組(19.26±2.07),t=3.080,P<0.05。見圖1。


圖1 miR-192-5p表達對MM細胞U266凋亡能力的影響(n=3)
2.6 miR-192-5p靶向基因的預測及驗證 利用miRNA數據庫(TargetScan,miRBase,microRNA,miRDB)進行了miR-192-5p的靶基因預測,通過數據庫篩選發現,miR-192-5p可以與USP1基因3′-UTR區結合,特異性靶向作用于USP1基因(見圖2)。

圖2 數據庫預測的miR-192-5p與USP1 3′-utr區結合位點
通過雙熒光素酶報告基因實驗結果顯示,在MM細胞U266中,miR-192-5p mimics+USP1+MUT組相對熒光素酶活性(1.20±0.09)與mimics control+USP1+MUT組(1.27±0.08)差異無統計學意義(t=1.007,P>0.05);miR-192-5p mimics+USP1+WT組熒光素酶活性(0.47±0.04)顯著低于mimics control+USP1+WT組(1.25±0.12),t=10.681,P<0.001。miR-192-5p抑制了USP1-3'UTR-WT相對素酶活性,在突變USP1的3'-UTR區,miR-192-5p失去了對USP1基因的抑制作用。
2.7 miR-192-5p調控USP1的表達 Western blot結果顯示,轉染miR-192-5pmimics的USP1蛋白表達水平(0.46±0.04)顯著低于對照組(1.10±0.09),t=8.764,P<0.001,轉染miR-192-5p inhibitor的USP1蛋白表達水平(1.40±0.11)顯著高于對照組(0.89±0.06),t=7.050,P<0.01,表明了miR-192-5p對USP1的負向調控作用。見圖3。

圖3 轉染miR-192-5p對U266細胞中對USP1蛋白的表達水平影響(n=3)
3 討論
多發性骨髓瘤是一種以骨髓中分泌抗體的生發中心血漿細胞浸潤和克隆增殖為特征的腫瘤性疾病。它是第二常見的血液系統惡性腫瘤,約占所有血液學惡性腫瘤的10%,多發于老年人。多發性骨髓瘤的臨床表現多種多樣,其典型表現為骨痛、反復感染、貧血、腎功能損害。由于骨髓異常漿細胞和單克隆免疫球蛋白過度增生,導致嚴重的體液免疫缺陷和骨損害,死亡率高,目前它的發病機制尚不清楚[10-13]。miR-192-5p作為重要的調控因子參與基因的表達及細胞的生理活動,miR-192-5p的異常表達在多種惡性腫瘤的發生發展中起著重要作用[14]。以往研究表明,miR-192-5p在許多癌癥中均被顯著下調,而且miR-192-5p還可以調節腫瘤細胞的生物學功能,包括增殖、遷移、侵襲和凋亡等等。如Feng等[15]研究發現miR-192-5p在肺癌中明顯偏低,通過RB1抑制細胞增殖并誘導細胞凋亡。Lian等[16]證明,miR-192-5p通過靶向肝細胞癌的SLC39A6/SNAIL途徑減少了腫瘤轉移。Chen等[17]發現,與正常組織相比,miR-192在前列腺癌組織中過表達,且miR-192可以促進前列腺癌細胞增殖和細胞周期進程。近年來,許多研究表明USP1在多種腫瘤中表達上調,并發現USP1可抑制腫瘤細胞的增殖、遷移、侵襲等生物學行為。Liu等[18]證實USP1在骨肉瘤中上調,沉默USP1可以通過減少一些下游蛋白(包括Notch信號傳導)的表達來抑制細胞增殖和侵襲。Williams等[19]指出,USP1在骨肉瘤細胞中上調,從而促進細胞增殖,抑制成骨細胞分化以及穩定ID蛋白。Lee等[20]發現,相對于正常腦組織,USP1在神經膠質瘤中高表達,通過RNA干擾或用化學USP1抑制劑處理會減弱膠質母瘤干樣細胞的克隆形成生長和存活,并增強膠質母瘤細胞的放射敏感性。本研究分析miR-192-5p在多發性骨髓瘤中的表達水平以及調控機制,以期對多發性骨髓瘤患者的精準治療提供更多的理論依據。
本研究選取了骨髓瘤細胞株U266作為研究對象。研究結果表明,與正常骨髓細胞相比,miR-192-5p在骨髓瘤細胞株U266中的表達水平顯著降低。進一步研究miR-192-5p對MM細胞的增殖、遷移、侵襲和凋亡的影響。結果顯示miR-192-5p過表達對MM細胞的增殖、遷移、侵襲具有抑制作用,對MM細胞的凋亡具有促進作用。而miR-192-5p低表達則具有相反作用。由此,本組推測miR-192-5p在MM細胞的發生發展中扮演抑癌基因的功能。通過miRNA數據庫靶向預測,得出USP1可能是miR-192-5p在MM細胞中的潛在靶基因,進而通過雙熒光素酶報告實驗驗證了miR-192-5p和USP1之間的調節關系和潛在作用位點,結果證實了USP1是miR-192-5p在MM細胞中的靶基因的觀點。Western blot檢測結果發現miR-192-5p對USP1蛋白表達起到負調控作用,這也進一步證實了miR-192-5p對USP1的靶向調控關系。
綜上所述,miR-192-5p在多發性骨髓瘤中可能作為抑癌基因發揮作用,通過靶向作用于USP1抑制多發性骨肉瘤的發展。因此,miR-192-5p可能是一個有價值的生物標志物,miR-192-5p靶向調控USP1是骨肉瘤治療的新靶點。

