不同病態竇房結綜合征造模方法對SAN結構、功能的影響
畢路甲,付升旗

摘要:目的:不同病態竇房結綜合征造模方法對竇房結(SAN) 解剖位置、組織細胞形態學及起搏相關離子通道功能的影響。方法:將36只兔隨機分成假手術組、甲醛濕敷組和甲醛滴注組,每組12只。甲醛濕敷組兔采用甲醛濕敷法進行建模;甲醛滴注組兔采用甲醛滴注法進行建模;假手術組僅打開胸腔,剪開心包膜,不進行甲醛濕敷或甲醛滴注。HE染色觀察SAN組織形態變化。采用心房調搏法測量造模前及造模后1 h的竇房傳導時間(SACT) 、竇房結恢復時間(SNRT) 、校正竇房結恢復時間(SNRTc) 。采用心房調搏法測量造模前及造模后1 h的竇房傳導時間(SACT) 、竇房結恢復時間(SNRT) 、校正竇房結恢復時間(SNRTc) 。Western blot檢測SAN組織超極化激活環核苷酸門控非選擇性陽離子通道(HCN4) 蛋白。結果:甲醛濕敷組和甲醛滴注組組織細胞形態學差異不明顯(P > 0.05) 。甲醛滴注組SNRT、SNRTc和SACT高于甲醛濕敷組(P < 0.05) 。甲醛滴注組HCN4 mRNA和蛋白表達低于甲醛濕敷組(P < 0.05)。結論:甲醛濕敷法建立兔SAN損傷模型優于甲醛滴注法。
關鍵詞:病態竇房綜合征;竇房結;組織細胞形態學;離子通道
竇房結(SAN) 是各種哺乳動物心臟右心房上的一個特殊的小結節,能啟動和調控心臟節律。病態竇房結綜合征簡稱病竇綜合征或病竇,又稱竇房結功能障礙,是由竇房結病變而引起的一組由癥狀組成的心血管疾病[1~2]。對于明確診斷為病態竇房結綜合征患者,無論是內科保守治療還是外科手術介入治療,臨床患者都會受到一系列并發癥的威脅,嚴重者可發生阿斯綜合征導致暈厥,甚至猝死[3]。在探討病態竇房結綜合征治療方法過程中,一個重要的研究手段是在動物身上復制SAN功能損傷模型。目前多采用手術方法或者藥物方法建立竇房結功能損傷模型,然而對某一個體動物模型不同方式的建立對SAN以及起搏相關離子通道功能的影響尚無研究報道。本文采用甲醛濕敷法和甲醛滴注法對兔進行SAN損傷建模,比較兩種不同建模方式對SAN組織細胞形態學及起搏相關離子通道功能的影響。現報道如下:
1 材料與方法
1.1 實驗主要儀器和試劑
甲醛購自國藥集團化學試劑有限公司;超級化激活的環核苷酸陽離子通道(HCN1) 、HCN2、HCN3、HCN4抗體以及相應的二抗購于Santa Cruz公司;RNA提取試劑TRIzol及轉染試劑Lipofectamine 2000均購自武漢極捷生物科技有限公司;RIPA蛋白裂解液及BCA法蛋白濃度測定試劑盒購自金克隆(北京) 生物技術有限公司;ECL發光液購自北京伊塔生物科技有限公司;光學顯微鏡購于北京安麥格貿易有限公司;烏拉坦購自國藥集團化學試劑有限公司;B203LED 型生物顯微鏡(重慶奧特光學儀器有限公司) ;DF-5A 型心臟電生理刺激儀(蘇州市東方電子儀器廠) ;BL420S 生物機能實驗系統(成都泰盟科技有限公司) 。
1.2 實驗動物
普通級兔36只,雌雄各半,體重2.02~3.58 kg,購于吉林和元生物工程股份有限公司;許可證號:SYXK(吉) 2021-0004。將普通級兔隨機分成甲醛濕敷組、甲醛滴注組和假手術組,每組12只。所有家兔適應性喂養1周后進行造模。甲醛濕敷組兔采用甲醛濕敷法進行建模,甲醛滴注組兔采用甲醛滴注法進行建模。假手術組所有兔僅打開胸腔,剪開心包膜,不進行甲醛濕敷或甲醛滴注。在整個實驗過程中對動物的處置均符合醫學倫理學標準。
1.3 實驗方法
1.3.1 病態竇房綜合征模型建立
所有兔經耳緣靜脈注射 20 % 烏拉坦 4 ~5 mL/ kg 麻醉后固定,連接體表心臟Ⅱ導。第三肋骨水平為中心備皮、消毒后沿胸骨正中偏右 2 ~3 mm 縱行切開胸腔,暴露右心房,用注射器連接套管,深入心包膜腔內側,輕輕吸取心包液。
濕敷法:用干棉簽輕放于右心耳處,輕輕將心臟撥向左側,暴露右心房與上腔靜脈交界(SAN區) ,用40 %甲醛將棉簽底部充分浸潤,輕輕送至SAN區,濕敷3~5 min。當心率較濕敷前下降 30 %以上或出現竇性停搏、竇房阻滯或結性逸搏時取出棉簽,觀察心律變化情況。對未出現上述心律失常者則持續濕敷,并繼續觀察心律情況。
滴注法:將自制標測電極一端連接于心臟V1導聯,另一端放置于竇房結區,標測竇房結電圖,并固定位置,然后將自制標測電極末端接上裝有40 %甲醛的微量注射器,彈丸樣緩慢推注。當心率下降30 %以上或出現竇性停搏、竇房阻滯或結性逸搏時暫停推注,觀察心律變化情況。對未出現上述心律失常者則持續推注,最大量至0. 03 mL。
1.3.2 SAN組織形態觀察
按在建模1周后對兔進行麻醉、開胸、暴露心臟,去SAN組織制備標本。將切取的竇房結組織經生理鹽水沖洗干凈后立即置入4 %多聚甲醛固定,常規脫水、透明、石蠟包埋及HE染色,在光鏡下觀察竇房結細胞形態結構的改變。
1.3.3 檢測SAN功能指標
采用心房調搏法測量造模前及造模后1 h的竇房傳導時間(SACT) 、竇房結恢復時間(SNRT) 、校正竇房結恢復時間(SNRTc) 。比較各組模型兔造模前后SACT、SNRT和SNRTc。
(1) 實時熒光定量檢測(RT-PCR) 檢測HCN1、HCN2、HCN3、HCN4 mRNA表達:采用Trizol法提取SAN組織中的總RNA,采用紫外分光光度計法測定RNA的濃度。以RNA為模板進行逆轉錄獲得cDNA并置于4℃保存,進行熒光定量PCR擴增,置于RT-PCR儀(CFX96型,美國bio-radBiorad公司) 中進行測定。設置反應條件:95 ℃,5 min預變性;95 ℃變性10 s,60 ℃ 退火35 s,65 ℃延伸 30 s,擴增35個循環。以β-action為內參,引物序列如下:HCN1:上游序列:5′-TGGTGGCTACAATGCCTTTA-3′,下游序列:5′-TTCCTCCGGGACCTCGTT-3′ ;HCN2:上游序列:5′-CGTTACCAGGGCAAGATGTTT-3′,下游序列:5′-GTTGTCCACGATCAGCGAAT-3′;HCN3:上游序列:5′-TCTCCGACACCTTCT。TTCTGC-3′,下游序列:5′-CCCACTGGTGTATGTAGCGG-3′;HCN4:上游序列:5′-GTACTCCTACGCGCTCTTCA-3′,下游序列:5′-GCTCTCCTCGTCGAACATCT-3′;β-action:上游序列: 5′-GGAGCGAGATCCCTCCAAAAT-3′,下游序列:5′-GGCTGTTGTCATACTTCTCATGG-3′。采用 2-ΔΔCT 法對統計HCN1、HCN2、HCN3、HCN4 mRNA相對表達量。
(2) Western blot檢測起搏相關蛋白:取左心室SAN區心肌組織,裂解以3000 r/min轉速離心10 min,取上清液,提取心肌組織蛋白,經BCA法檢測蛋白濃度;凝膠電泳后轉膜;5 %脫脂奶粉封閉孵育2 h,添加相應的一抗和二抗,選擇GAPDH作為內參,使用ECL法顯示蛋白。
1.4 統計學處理
應用 SPSS 22.0 軟件進行統計分析。所有實驗數據均符合正態分布,計量資料用(均數±標準差)表示,t檢驗;計數資料采用[n(%) ]表示,χ2檢驗。檢驗水準為α = 0.05,以雙側P < 0.05時,說明該數據具有顯著性統計學差異。
2 結果
2.1 SAN損傷模型兔SAN變化
與假手術組相比,甲醛濕敷組和甲醛滴注組可見SAN細胞出現明顯腫脹,部分粒細胞浸潤和膠原纖維組織增生。甲醛濕敷組和甲醛滴注組組織細胞形態學差異不明顯(P > 0.05) 。
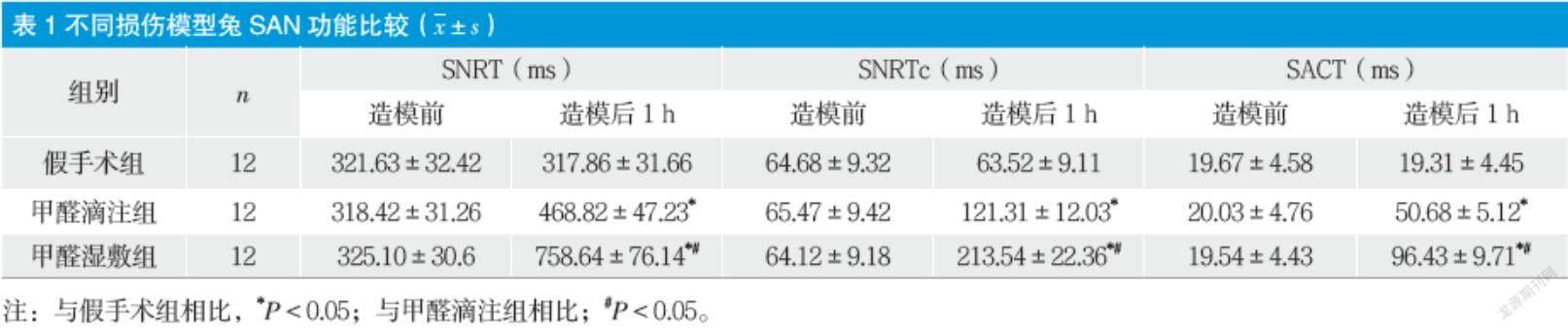
2.2 不同損傷模型兔SAN功能比較
三組兔造模前SNRT、SNRTc和SACT比較無明顯差異。造模后,與假手術組相比,甲醛濕敷組和甲醛滴注組SNRT、SNRTc和SACT明顯上升(P < 0.05) ,且甲醛濕敷組SNRT、SNRTc和SACT明顯高于甲醛滴注組(P < 0.05) 。見表1。
2.3 不同損傷模型兔SAN區HCN1、HCN2、HCN3和HCN4mRNA表達
研究結果發現,甲醛濕敷組和甲醛滴注組主要以HCN4 mRNA表達為主,少量HCN1、HCN2表達,未檢出HCN3 mRNA 表達。甲醛濕敷組和甲醛滴注組HCN4 mRNA分別為(0.86±0.09) 、(0.63±0.07) 明顯低于假手術組HCN4 mRNA表達(1.02±0.01) ,且甲醛濕敷組HCN4 mRNA表達低于甲醛滴注組HCN4 mRNA表達(P < 0.05) 。
2.4 不同損傷模型兔SAN區HCN4蛋白表達
甲醛濕敷組和甲醛滴注組HCN4蛋白相對表達水平明顯低于假手術組,且甲醛濕敷組HCN4蛋白相對表達水平低于甲醛滴注組HCN4蛋白相對表達水平(P < 0.05) 。見圖1。
3 討論
SAN呈非特異性退行性纖維變性,是導致病態竇房結綜合征的重要因素[4]。在該病變過程中起搏細胞逐漸被纖維組取代,從而導致SAN起搏細胞的直接減少,其正常起搏功能逐漸減退[5]。這些起搏細胞擁有特殊的離子通道流的組合,當SAN受到損傷時,這些起搏細胞原有的功能會出現異常,導致嚴重的心動過緩、高度房室傳導阻滯等心律失常的發生。
本研究結果顯示,甲醛濕敷組和甲醛滴注組可見SAN細胞出現明顯腫脹,可見部分粒細胞浸潤和膠原纖維組織增生,但甲醛濕敷組和甲醛滴注組組織細胞形態學差異不明顯,說明甲醛濕敷和甲醛滴注均可對兔SAN區造成一定的損傷。本研究結果還發現,與假手術組相比,甲醛濕敷組和甲醛滴注組SNRT、SNRTc和SACT明顯上升,且甲醛濕敷組SNRT、SNRTc和SACT上升幅度明顯大于甲醛滴注組。甲醛滴注法利用SAN損傷電圖的特異性,角度新穎,同時對兔產生的創傷較小,但SAN電圖測量困難,容易受到自身或外界其他因素影響,使得造模損傷程度無法控制。甲醛濕敷法雖然對兔創傷大,但便于控制模型的損傷程度。本研究結果顯示,甲醛濕敷組SNRT、SNRTc和SACT下降幅度明顯大于甲醛滴注法,分析其原因可能是因為心臟表面光滑,不易于甲醛吸附在心臟表面,導致SAN損傷程度不足造成,其具體原因需進一步研究分析。本研究分析不同建模方式對起搏相關離子通道功能的影響發現,甲醛濕敷組和甲醛滴注組均以HCN4表達為主,少見HCN1、HCN2表達,且甲醛濕敷組HCN4 mRNA和蛋白表達水平明顯低于甲醛滴注組。HCN是一種環總超家族陽離子通道,主要存在于細胞膜上,其異常表達可能導致嚴重的SAN功能障礙[6]。既往研究顯示[7],SAN免疫組化染色顯示HCN4表達位于結中央區,向周邊逐漸減少,甲醛加壓注射滲透法建立兔SAN組織損傷模型后,兔SAN組織HCN4蛋白表達有不同程度的下降。本研究結果說明,兩種SAN損傷建模方式對HCN4通道均有影響,但甲醛濕敷組影響較大,可能與其對SAN造成的損傷程度有關。
綜上所述,甲醛濕敷法建立兔SAN損傷模型優于甲醛滴注法。一個理想的制造病態竇房綜合征模型試劑,首先必須能對作用區域的心肌細胞造成一定程度的損傷。其次,其作用范圍及程度可控,不致使藥液作用范圍過大而損傷正常心肌組織。
參考文獻
[1]De Ponti R, Marazzato J, Bagliani G, et al. Sick Sinus Syndrom[J]e. Card Electrophysiol Clin, 2018, 10(2):183-195.
[2]Canpolat U, Yorgun H, Aytemir K. Treatment of Sinus Node Artery Occlusion During Anterior Left Atrial Tachycardia Ablation Using Intracoronary Tirofiban[J]. JACC Clin Electrophysiol, 2019, 5(7):870-871.
[3]Khanna S, Sreedharan R, Trombetta C, et al. Sick Sinus Syndrome: Sinus Node Dysfunction in the Elderly[J]. Anesthesiology, 2020, 132(2):377-378.
[4]王威,張世林,劉芳芳,等.竇房結病理性纖維化的研究進展[J].法醫學雜志,2021,37(2):225-232.
[5]De Ponti R, Marazzato J, Bagliani G, et al. Sick Sinus Syndrome[J]. Card Electrophysiol Clin, 2018, 10(2):183-195.
[6]Kharouf Q, Phillips AM, Bleakley LE, et al. The hyperpolarization-activated cyclic nucleotide-gated 4 channel as a potential anti-seizure drug target[J]. Br J Pharmacol, 2020, 177(16):3712-3729.
[7]劉如秀,暴美靜,王妮娜,等.益陽活血方對損傷兔竇房結組織HCN4蛋白表達的影響[J].實用藥物與臨床,2012, (3):129-132,193.

