保存條件對恒河猴CD8+ T 細胞活性的影響
羅嘉慧盧秋翰李國萃張京京叢 喆魏 強
(北京協和醫學院比較醫學中心,中國醫學科學院醫學實驗動物研究所,國家衛生健康委員會人類疾病比較醫學重點實驗室,國家中醫藥管理局人類疾病動物模型三級實驗室,新發再發傳染病動物模型研究北京市重點實驗室,北京 100021)
CD8+T 細胞在多種病毒感染性疾病的免疫控制中起著至關重要的作用,一般認為對病毒復制有更好控制能力的患者擁有更強的特異性T 細胞應答,其CD8+T 細胞也具有更高的細胞因子生產能力[1-4],但仍需要更多的相關研究來支持。 CD8+T細胞活性測定對細胞功能評定直接相關。 由于實驗條件限定,通常情況下細胞及組織常冷凍(-80℃、液氮等)保存[5-6],凍存會對細胞的部分理化狀態造成影響[7],但在多大程度上影響細胞活性,缺乏實驗依據。 因此,通過實際樣本測定,了解凍存對其活性的影響,有重要的實際應用意義,也為今后的細胞內細胞因子染色實驗提供借鑒。
1 材料和方法
1.1 實驗動物
9 只SPF 級中國恒河猴,4 只雌性,5 只雄性,年齡為3~6 歲,體重約4 ~5 kg,均購自北京協爾鑫生物資源研究所[SCXK(京)2015-0011]。 實驗前通過免疫熒光法篩查,排除猴皰疹病毒,猴逆轉錄D型病毒,猴免疫缺陷病毒及猴T 淋巴細胞性I 型病毒。 實驗動物的飼養及實驗操作在中國醫學科學院醫學實驗動物研究所生物安全三級實驗室進行[SYXK(京)2017-0027],實驗進程遵循3R 原則。本實驗使用的實驗動物程序通過了中國醫學科學院醫學實驗動物研究所實驗動物使用與管理委員會(IACUC)的批準(XJ19006)。
1.2 主要試劑與儀器
Cell Stimulation Cocktail(500×)(Cat.00-4975)購自eBioscience 公司;BD HorizonTMBV605 Mouse Anti-Human CD3(Cat. 562994)、BD PharmingenTMFITC Mouse Anti-Human CD8 (Cat. 557085)、 BD HorizonTMBV421 Mouse Anti-Human MIP-1β(Cat.562900)、BD HorizonTMPE-CF594 Mouse Anti-Human CD107a(Cat. 562628)、BD Cytofix/CytopermTMBD Cytofix/Cytoperm Plus Kit(with BD GolgiStop)(Cat.554715)購自BD Pharmingen 公司;Brilliant Violet 421TManti-human IL-2 Antibody(Cat. 500328)、PE anti-human TNF-α Antibody(Cat. 502909)、Zombie NIRTMFixable Viability Kit(Cat.423106)、Brefeldin A(Cat. 420601)、 Brilliant Violet 510TManti-human IFN-γ Antibody(Cat. 502544)購自BioLegend 公司。
1.3 實驗方法
1.3.1 樣本采集和外周血單個核細胞制備
使用乙二胺四乙酸二鉀(EDTA-K2)采血管采集猴抗凝全血,使用Ficoll 淋巴細胞分離液分離外周血單核淋巴細胞,一部分新鮮細胞直接用于檢測。 一部分使用加入了10% DMSO 的胎牛血清作為凍存液凍存于-80℃和液氮中。
1.3.2 細胞內細胞因子染色
淋巴細胞懸液加入48 孔板中,每孔1 mL,設陽性刺激組和陰性對照組。 陽性刺激組加入1×陽性刺激物,陰性對照組只加培養基。 1 h 后加入布雷菲德菌素A(Brefeldin A),GolgiStop 和CD107a 抗體,于37℃5% CO2培養箱中繼續培養5 h,收細胞進行流式數據分析[8-12]。
收取細胞,使用細胞死活染料(Zombie NIRTMFixable Viability Kit)將細胞在室溫下染色20 min。然后洗滌細胞并在4℃下用表面染色混合物染色30min。 隨后將PBMC 洗滌2 次,然后用固定/透化溶液Fixation/Permeabilization solution 在4℃下固定并透化20 min。 隨后將細胞在用1 ∶10 稀釋的Perm/WashTMBuffer 中洗滌兩次。 然后在4℃下用胞內染色混合物染色30 min。 洗滌后將細胞重懸于1%多聚甲醛中,并在4℃下在黑暗中儲存不超過24 h 直至分析。
1.4 統計學方法
數據由BD ArialⅡ流式細胞儀收集,從每個樣品收集30000 個淋巴細胞。 采用FlowJo 10 對多色流式細胞儀上機結果進行分析,使用Graphpad 8 軟件進行作圖和統計分析,不同組數據間進行t檢驗分析,以P<0.05 為具有統計學差異界限。
2 結果
2.1 不同保存條件下細胞存活率
保存條件對細胞狀態影響較大。 新鮮分離的PBMC 中活細胞占(95.19±3.37)%,而經液氮凍存1 周后,活細胞比例為(84.23±4.35)%,凍存1 年后,活細胞占(54.43±6.79)%,顯著低于經液氮凍存1 周后的細胞(P<0.0001)。 -80℃凍存1 周后活細胞比例為(75.46±4.50)%,凍存1 年后活細胞只占(40.63±5.26)%,顯著低于-80℃凍存1 周后的細胞(P<0.0001)(圖1)。
2.2 陽性刺激物刺激淋巴細胞分泌細胞因子流式結果
以CD8+T 淋巴細胞群做為目的細胞,以同型對照為基準劃十字門。 使用PMA 和離子霉素Inomycin 做為陽性刺激物刺激培養新鮮細胞6 h后,細 胞 高 表 達MIP-1β、 IL-2、 IFN-γ、 TNF-α 和CD107a。 見圖2。
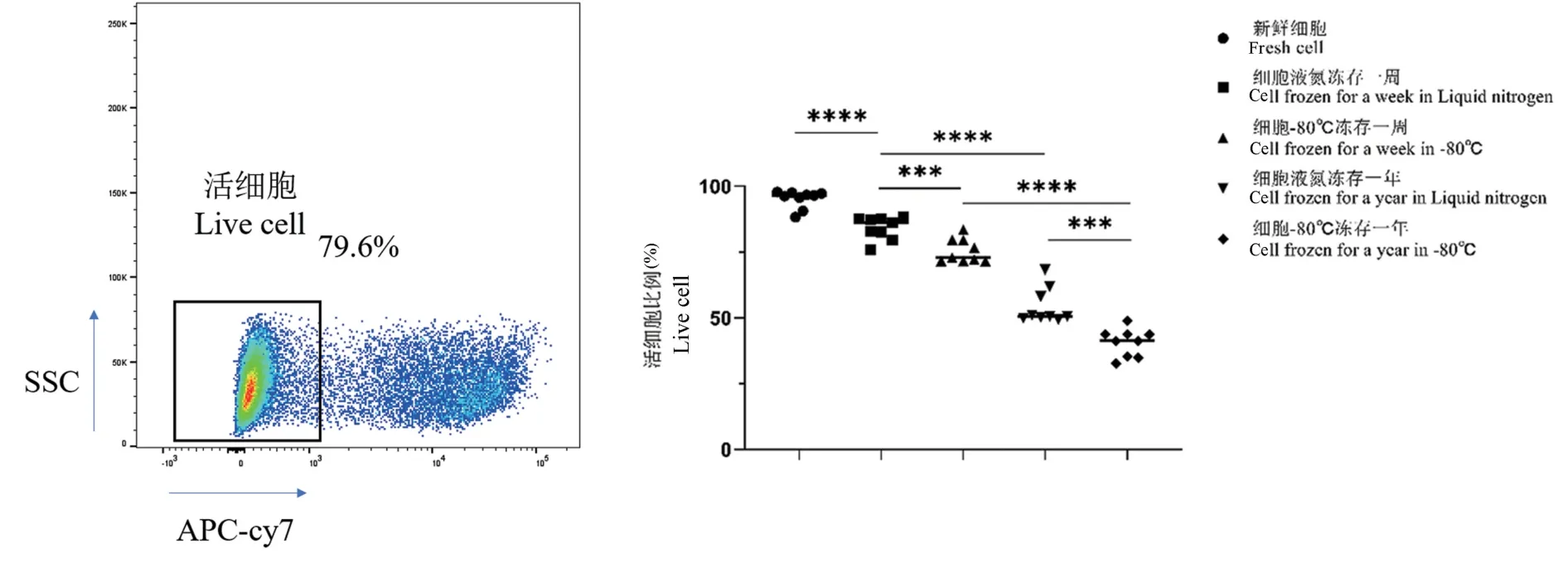
注:與新鮮細胞比較,****P<0.0001;與細胞液氮凍存一周比較,***P<0.001,****P<0.0001;與細胞-80℃凍存一周比較,***P<0.001,****P<0.0001;與細胞液氮凍存一年比較,***P<0.001。圖1 不同保存條件下PBMC 的存活率Note. Comparing to fresh cells, ****P<0.0001. Comparing to cell frozen for a week in liquid nitrogen, ***P<0.001,****P<0.0001. Comparing to cell frozen for a week in -80℃, ***P<0.001,****P<0.0001. Comparing to cell frozen for a year in liquid nitrogen, ***P<0.001.Figure 1 Survival rate of PBMC under different storage conditions
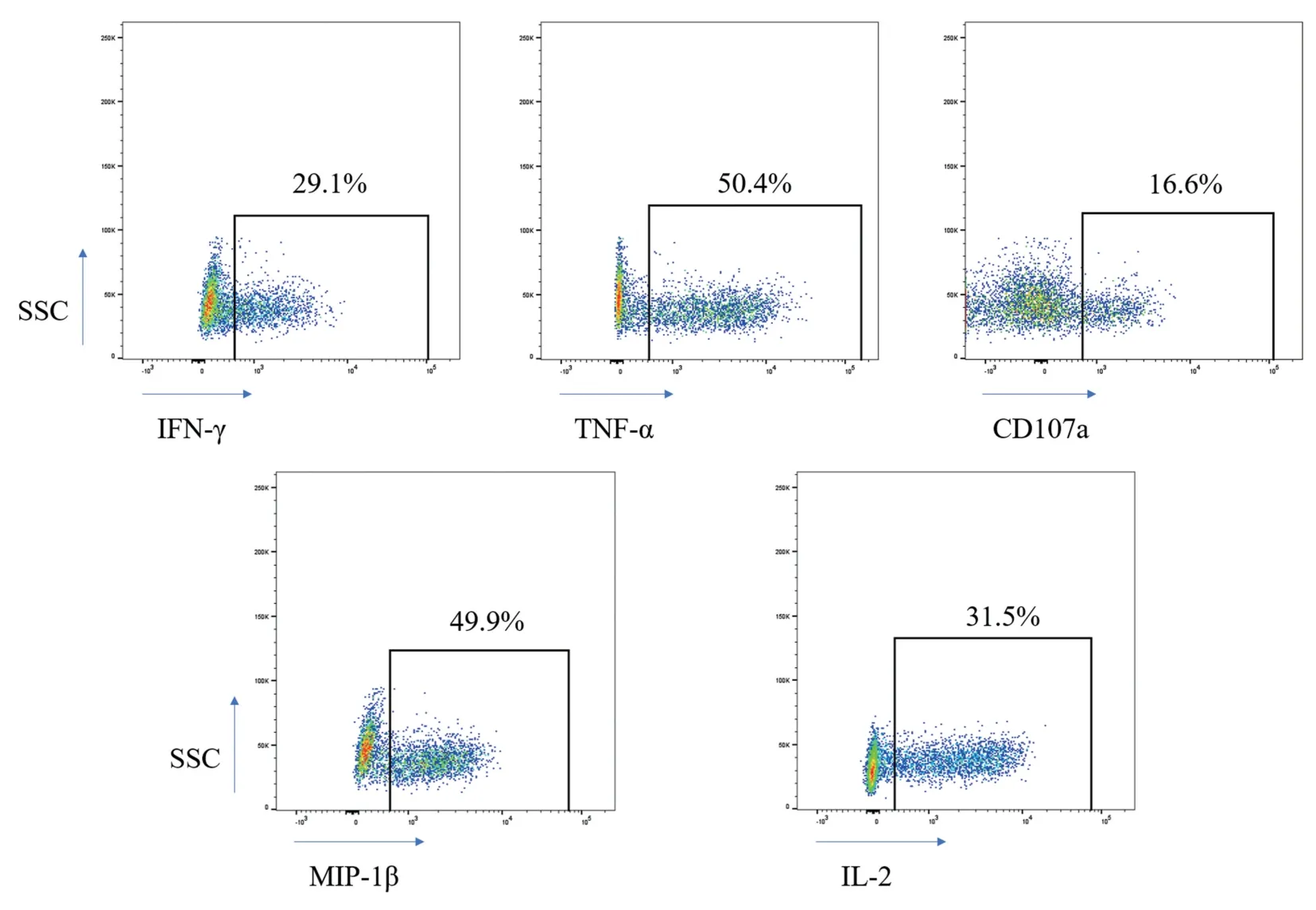
圖2 流式分析CD8+ T 淋巴細胞胞內細胞因子表達情況Figure 2 Flow cytometric analysis of intracellular cytokine expression in CD8+ T lymphocytes
2.3 不同保存條件下胞內細胞因子及細胞脫粒標志物表達結果
PMA 和離子霉素Inomycin 做為陽性刺激物培養PBMC 6 h 后,不同保存條件下胞內細胞因子及細胞脫粒標志物表達量如表1 所示,在MIP-1β 的表達中,新鮮細胞與凍存一周的細胞沒有顯著差異,但液氮凍存超過一年的細胞的表達量顯著高于新鮮細胞(P<0.001),液氮凍存一周的細胞與80℃凍存一周的細胞沒有顯著差異,液氮凍存超過一年的細胞與80℃凍存超過一年的細胞沒有顯著差異。在IL-2 的表達中,各組別均無顯著差異。 在IFN-γ的表達中,新鮮細胞的表達量顯著高于液氮凍存一周的細胞(P<0.0001),新鮮細胞與液氮凍存超過一年的細胞沒有顯著差異,液氮凍存一周的細胞與80℃凍存一周的細胞沒有顯著差異,液氮凍存超過一年的細胞與80℃凍存超過一年的細胞沒有顯著差異。 在TNF-α 的表達中,新鮮細胞與凍存一周的細胞沒有顯著差異,但液氮凍存超過一年的細胞的表達量顯著高于新鮮細胞(P<0.0001),液氮凍存一周的細胞與80℃凍存一周的細胞沒有顯著差異,液氮凍存超過一年的細胞與80℃凍存超過一年的細胞沒有顯著差異。 在CD107a 的表達中,各組別均無顯著差異。 (圖3)
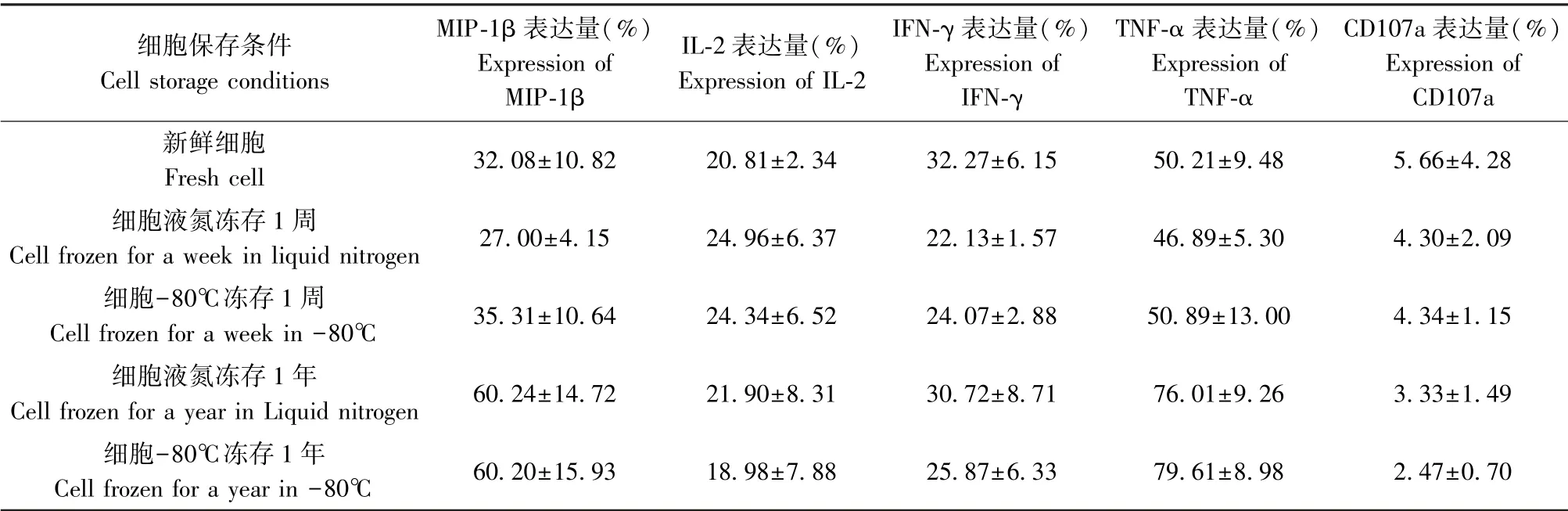
表1 不同保存條件下胞內細胞因子及細胞脫粒標志物表達量Table 1 Expression of intracellular cytokines and cell degranulation markers under different storage conditions
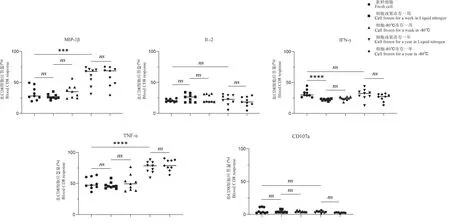
圖3 不同保存條件下胞內細胞因子及細胞脫粒標志物表達情況分析Figure 3 Analysis of the expression of intracellular cytokines and cell degranulation markers under different storage conditions
3 討論
近年來,越來越多的研究支持血液CD8+T 細胞反應與多種病毒感染性疾病控制有著密切的關系,CD8+T 細胞主要通過分泌細胞毒性顆粒和細胞因子來發揮其效應功能,因此同時選取CD8+T 細胞的細胞脫粒標志物及4 種細胞因子(CD107a,IFN-γ,MIP-1β,TNF-α 和IL-2)的分泌量來評估CD8+T 細胞反應的水平,是現在較多采用的一種方法[2-13]。現今部分測量CD8+T 細胞反應水平的實驗使用新鮮的細胞[14-15],但是由于實驗安排的不同,大部分測量CD8+T 細胞反應水平的實驗都需要用到凍存細胞[11],但是,在不同條件下,凍存會多大程度上影響細胞活性,缺乏確切的實驗依據,實驗樣本的凍存條件對實驗結果的影響尚未得到評估。
本實驗在保證凍存液的成分,血細胞的分離條件、細胞復蘇的過程等變量條件一致的情況下,探究凍存條件對恒河猴CD8+T 細胞活性的影響。 結果發現不同凍存條件對細胞存活率影響較大,細胞存活率因凍存而衰減,凍存時間越長,凍存溫度越高,細胞死亡率越高。 不同凍存條件的細胞因子及細胞脫粒標志物的表達量也不同,總體來說,短時間凍存的細胞反應水平與新鮮細胞最為接近,而長時間凍存的細胞,在MIP-1β 和TNF-α 的表達量上與新鮮細胞有顯著的差異。 由于本實驗采集自恒河猴實驗樣本,數量受限,未做樣本差異分析,條件充許時,盡量采集足量樣本,并排除因樣本差異造成可能的影響。 因此為了保持正常的CD8+T 細胞反應和高的細胞存活率,應使用新鮮細胞或短期凍存的細胞進行測量CD8+T 細胞反應水平的實驗,而在測定長期保存標本中,也應充分了解活性因凍存而有所變化。

