焦磷酸鈉對腺嘌呤核苷三磷酸解離氧化肌動球蛋白的影響
呂博文,耿曉茜,張月姝,于 澤,李春強,邵俊花
(沈陽農業大學食品學院,遼寧 沈陽 110866)
肌肉具有較高的營養價值,但是在貯藏和加工過程中汁液易流失,導致肉制品持水性差、口感粗糙。為了提高產品的多汁性和食用口感,焦磷酸鈉(sodium pyrophosphate,TSPP)、三聚磷酸鈉和六偏磷酸鈉等堿性磷酸鹽常用于肉制品中,通過調節pH值[1]、增加離子強度[2]、螯合金屬離子[3]、解離肌動球蛋白[4]等機制改善肉制品的品質[5-7]。其中TSPP應用最為普遍,其關鍵作用機制是可以解離肌動球蛋白。動物屠宰發生僵直后,由于腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)的缺乏,肌肉中的肌球蛋白和肌動蛋白以肌動球蛋白的形式存在,持水力差。TSPP是ATP的結構類似物,且與肌球蛋白頭部S1活性部位中ATP結合位點相同或相近[8-9],可將部分肌動球蛋白解離為肌球蛋白和肌動蛋白[4]。在肉制品加工過程中,焦磷酸鹽結合粉碎、混合、滾揉按摩等操作,會使肌原纖維解體,產生游離的肌球蛋白和肌動蛋白,持水能力和凝膠能力大大增加,故可提高肉及肉制品的持水性、嫩度和質地等品質[7,10-11]。而且,在鹽(≥0.4 mmol/L)和TSPP同時存在時,肌動球蛋白在解離的同時伴隨著粗絲解聚和肌原纖維膨脹,更多的水分被包裹在肌纖維內部,也會提高肌肉的持水性[12]。一般認為,足夠量ATP作用于肌動球蛋白時,會使其完全解離,但TSPP作用于肌動球蛋白會發生何種程度的解離尚不清楚。
此外,由于肌肉蛋白富含金屬離子、脂肪和血紅素類化合物等促氧化物質,在冷凍、貯藏和加工過程中易被氧化,導致肌肉蛋白結構發生變化[13]。Li Chunqiang等[14]研究表明,蛋白氧化能夠封閉肌球蛋白頭部S1活性部位中的SH1和SH2(活性巰基),使肌球蛋白頭部S1結構發生巨大變化,影響ATPase活性。而劉澤龍[15]和孫悅等[16]研究表明,1 mmol/L TSPP的加入能夠在一定程度上抑制蛋白氧化。而TSPP對蛋白氧化的抑制作用是否會影響ATP的完全解離作用還鮮有報道。因此,本實驗采用從豬外脊肉中提取的肌動球蛋白為研究對象,以羥自由基氧化系統為模型,研究TSPP的解離效果及其對ATP解離不同氧化程度肌動球蛋白的影響,旨在為TSPP在肉制品中應用和調控提供一定理論依據。
1 材料與方法
1.1 材料與試劑
本實驗選取宰后24 h內pH 5.5左右的金球牌豬外脊肉作為提取肌動球蛋白的原料,購買于遼寧沈陽興隆大家庭超市,豬品種為大白豬。
6-羥基-2,5,7,8-四甲基色烷-2-羧酸、ATP上海麥克林生化科技有限公司;2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH)、TSPP、NaHCO3、Na2CO3、H2O2、乙二胺四乙酸二鈉(ethylenediaminetetraacetic acid disodium salt,EDTA-2Na)國藥集團化學試劑有限公司;5,5′-二硫代雙(2-硝基苯甲酸)(5,5′-dithiobis-(2-nitrobenzoic acid),DTNB)、鹽酸胍、β-巰基乙醇(β-mercaptoethanol,β-ME)、哌嗪-N,N′-(2-乙磺酸)(piperazine-N,N′-bis(2-ethanesulfonic acid),PIPES) 美國GENVIEW生化試劑公司;N-乙基馬來酰亞胺(N-ethylmaleimide,N-EM) 百靈威科技有限公司;沒食子酸丙酯(propyl gallate,PG) 上海瑞永生物科技有限公司。
1.2 儀器與設備
DS-1高速組織搗碎機 無錫沃信儀器有限公司;AUY120電子分析天平 日本島津公司;STARTER2100 pH計 奧豪斯儀器有限公司;DJ-1磁力攪拌器 常州榮華儀器有限公司;奧氏黏度計 沈陽騰龍玻璃儀器公司;Cary 50紫外-可見光分光光度計 美國Varian公司;5804R高速冷凍離心機 德國Etsppendorf公司;Zeta Sizer Nano series激光粒度儀 馬爾文儀器有限公司;HT 7700透射電子顯微鏡 日立高新技術公司;GE-250電泳儀、AI600 UV超靈敏多功能成像儀 美國通用電氣公司。
1.3 方法
1.3.1 肌動球蛋白提取
根據Perry等[17]的方法,將10 倍體積的Weber溶液(0.6 mol/L KCl、0.01 mol/L Na2CO3、0.04 mol/L NaHCO3)加入豬外脊肉中,采用高速組織搗碎機以12 000 r/min轉速于4 ℃勻漿。將勻漿液密封放入冰盆中,置于磁力攪拌器上低速攪拌24 h后,用100 目絹布過濾。在濾液中加入蒸餾水,將KCl濃度稀釋到0.2 mol/L,12 000 r/min、4 ℃離心20 min,所得沉淀中加入0.2 mol/L KCl溶液于4 ℃、12 000 r/min勻漿,12 000 r/min離心20 min,沉淀即為肌動球蛋白。提取出來的肌動球蛋白密封放在4 ℃冰箱中,18 h內用完。蛋白濃度采用雙縮脲法測定[18],以牛血清蛋白作為標準蛋白。
1.3.2 肌動球蛋白TSPP處理
5 mg/mL肌動球蛋白分散于含有1 mmol/L TSPP、2 mmol/L MgCl2、0.6 mol/L NaCl的15 mmol/L PIPES緩沖液(pH 6.25)中,于4 ℃反應2 h。未加TSPP和MgCl2的蛋白溶液作為空白對照。
1.3.3 肌動球蛋白氧化處理
經TSPP處理(+TSPP)和未經TSPP處理(-TSPP)的肌動球蛋白溶液(5 mg/mL)中,添加Fenton試劑(0.01 mmol/L FeCl3,0.1 mmol/L抗壞血酸,1、5、10、20 mmol/L H2O2)于4 ℃氧化2 h,添加PG、Trolox和EDTA-2Na(終濃度各1 mmol/L)終止氧化反應。不加氧化劑(FeCl3/抗壞血酸/H2O2)且在相同條件下處理的蛋白作為空白對照。
1.3.4 羰基含量測定
將5 mg/mL肌動球蛋白溶液與含10 mmol/L DNPH的2 mol/L HCl溶液以1∶5的比例混合,按照Levine等[19]的方法測定羰基含量。反應后的樣品在370 nm波長處測定羰基含量,280 nm波長處測定蛋白含量,用摩爾吸光系數為22 000 L/(mol·cm)計算羰基含量。
1.3.5 總巰基含量測定
肌動球蛋白用含0.6 mol/L NaCl的15 mmol/L PIPES緩沖液(pH 6.25)稀釋為2 mg/mL,根據Liu等[20]的DTNB法測定總巰基含量。反應后的樣品于412 nm波長讀數,根據摩爾吸光系數13 600 L/(mol·cm)計算巰基含量。
1.3.6 完全解離處理
將TSPP和氧化處理的肌動球蛋白分散于含有5 mmol/L ATP、0.6 mol/L NaCl的15 mmol/L PIPES緩沖液(pH 6.25)中使其完全解離,未加ATP的蛋白溶液作空白對照。
1.3.7 十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)分析
參考Li Chunqiang[21]的方法并稍加改動。采用12%分離膠和5%濃縮膠分析TSPP、氧化處理后肌動球蛋白的聚集變化。4 mg/mL樣品與等體積含或不含10%β-ME的上樣緩沖液混合,置于沸水中煮沸3 min,每孔進樣量為20 μg蛋白。電泳凝膠用含1 mg/mL考馬斯亮蘭R250、50%甲醇和6.8%冰乙酸的溶液染色40 min,隨后用含5%甲醇和7.5%冰乙酸的脫色液脫色過夜。脫色后的膠片拍照,并用自帶軟件對條帶密度進行分析。
1.3.8 黏度的測定
為了解TSPP對不同氧化程度的肌動球蛋白解離情況的影響,根據Granicher等[22]采用黏度法(特性黏數)反映此過程的變化趨勢。將1.5 mg/mL蛋白加入到奧氏黏度計中,豎直放置黏度計并記錄不同處理的蛋白溶液的流出時間。特性黏數的計算公式如下:
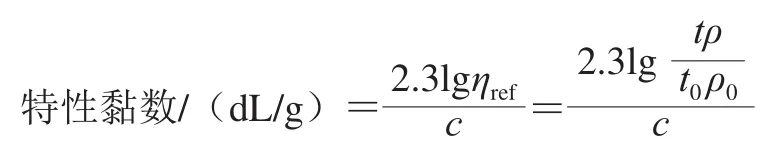
式中:ηref為相對黏度(無量綱);t和ρ分別為肌動球蛋白的流出時間和密度;t0和ρ0分別為溶劑的流出時間和密度;c為蛋白質量濃度/(g/dL)。
1.3.9 粒徑分布測定
1.5 mg/mL肌動球蛋白樣品分散于含有0.6 mol/L NaCl的15 mmol/L PIPES緩沖液(pH 6.25)中,分別使用激光粒度儀測量不同條件下處理樣品的粒徑分布,其中激光波長為633 nm,散射光強檢測器角度為173°。結果用3 次測定的平均粒徑表示[23]。
1.3.10 肌動球蛋白形態觀察
將0.1 mg/mL肌動球蛋白直接滴在銅網上,另滴加一滴負染液(2%磷鎢酸)染色10 min。采用透射電子顯微鏡觀察肌動球蛋白的形態變化,加速電壓采用100 kV[24]。
1.4 統計分析
本實驗所有數據均為至少3 次重復的平均值。使用Statistix 9軟件進行方差分析和顯著性分析(最小顯著性差異法),定量分析統計圖使用Origin 8.5繪制。
2 結果與分析
2.1 TSPP對肌動球蛋白氧化程度的影響
2.1.1 羰基含量
有研究表明,蛋白氧化會引起氨基酸側鏈修飾和肽鏈斷裂,均生成羰基衍生物,所以羰基是描述蛋白氧化程度的標志物之一[13]。如圖1所示,對于-TSPP樣品,羰基含量隨著H2O2濃度的升高而顯著升高(P<0.05)。當H2O2濃度為20 mmol/L時,羰基含量是未氧化蛋白的4 倍左右。雖然在相同氧化程度下+TSPP樣品與-TSPP樣品的羰基含量差異不顯著(P>0.05),但是-TSPP樣品在未氧化和1 mmol/L H2O2時均比+TSPP樣品的羰基含量稍高,并且經過多次重復實驗均得到同樣結果,這說明在1 mmol/L H2O2條件下,TSPP能抑制羰基衍生物的生成。然而,在H2O2濃度大于5 mmol/L時,+TSPP樣品的羰基含量稍高,但與-TSPP樣品的蛋白羰基含量沒有顯著差異(P>0.05),說明TSPP并不能抑制肌動球蛋白中羰基的生成。
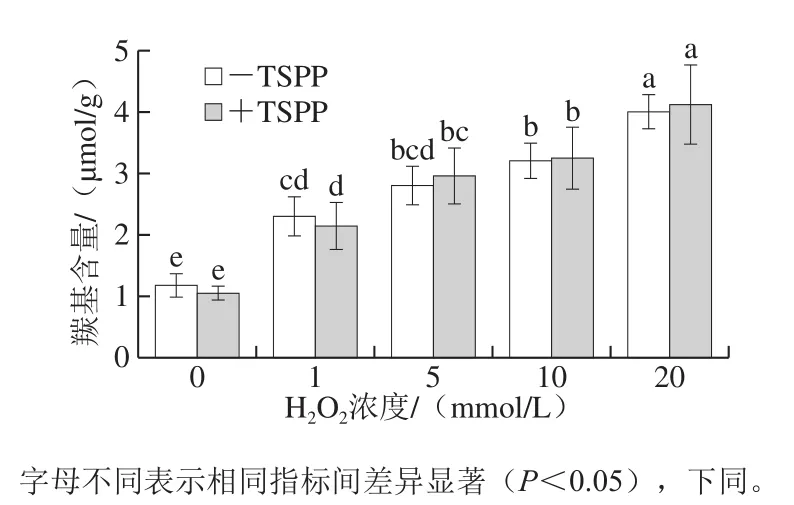
圖1 TSPP對肌動球蛋白羰基含量的影響Fig. 1 Effect of TSPP on carbonyl content of actomyosin
2.1.2 巰基含量
肌動球蛋白是由肌動蛋白和肌球蛋白組成的,而每個肌動蛋白中大約含有5 個巰基,每個肌球蛋白中大約含有40 個巰基,并且這些巰基易受羥自由基的攻擊而轉換成分子內或分子間的二硫鍵,從而導致蛋白氧化發生交聯[25-26]。因此,巰基含量的變化可以直接反映肌動球蛋白的氧化程度。由圖2所示,巰基含量隨著H2O2濃度增大而顯著降低(P<0.05)。-TSPP樣品和+TSPP樣品在未氧化時巰基含量分別為52.07 μmol/g和54.81 μmol/g,當H2O2濃度為5 mmol/L時,巰基含量分別下降了56.54%和47.27%,當H2O2濃度升高至20 mmol/L時,巰基含量分別下降了84.82%和84.36%,說明1~5 mmol/L H2O2時,TSPP對肌動球蛋白中巰基的氧化起到一定的保護作用,而10~20 mmol/L H2O2時保護作用不明顯。
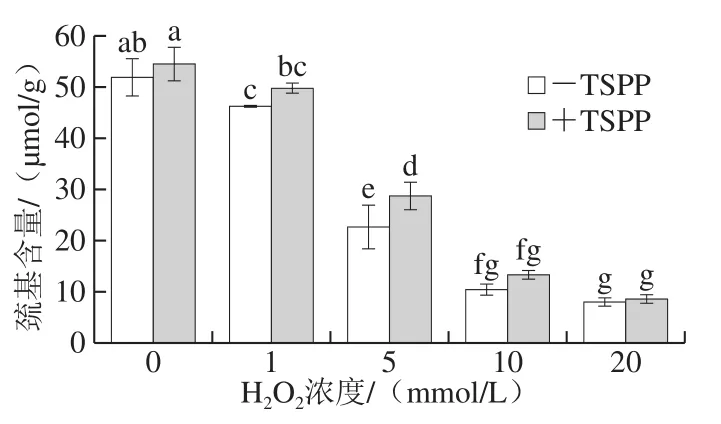
圖2 TSPP對肌動球蛋白巰基含量的影響Fig. 2 Effect of TSPP on sulfydryl content of actomyosin
2.1.3 SDS-PAGE分析
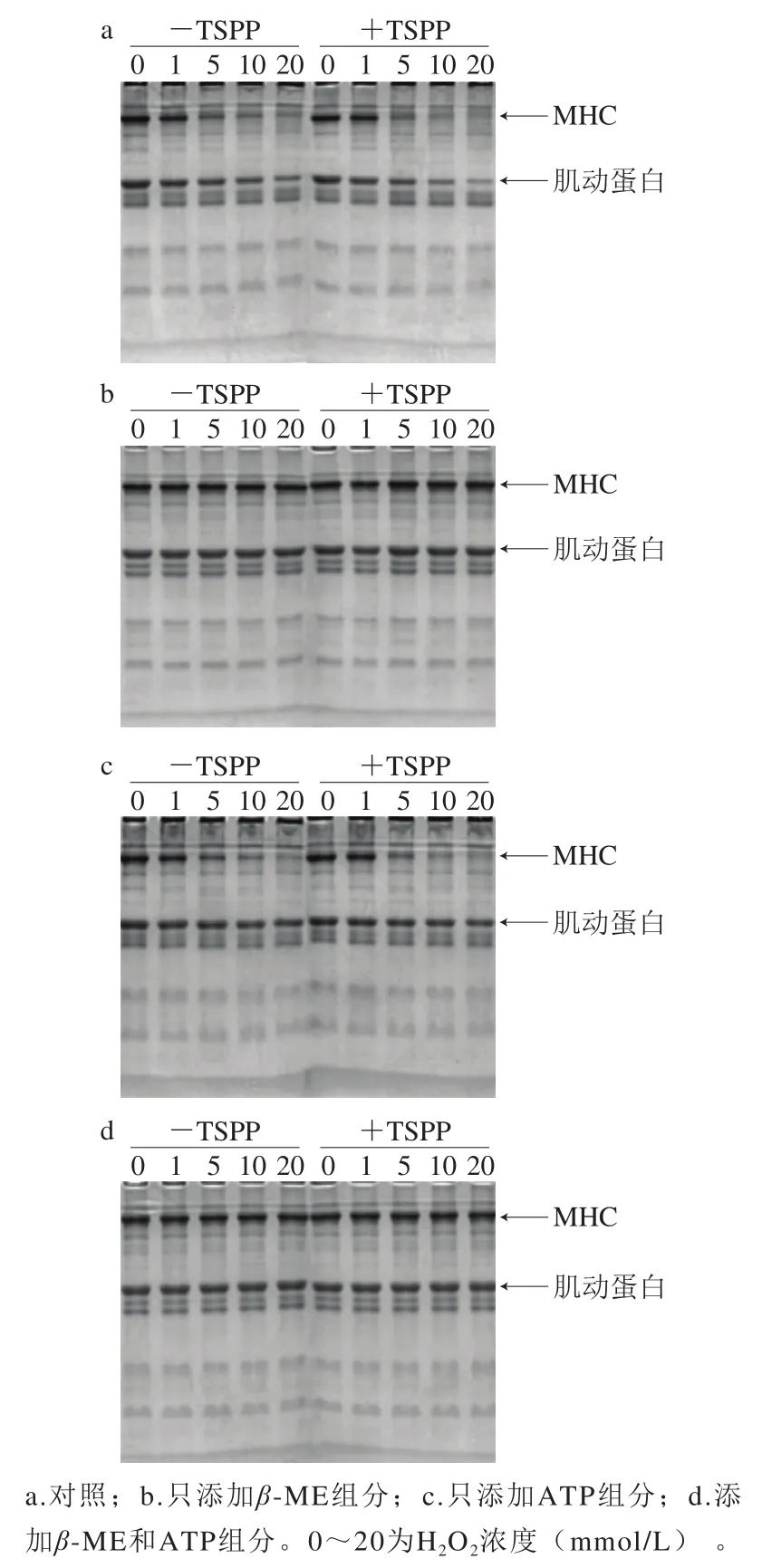
圖3 TSPP處理后肌動球蛋白的SDS-PAGE模式Fig. 3 SDS-PAGE patterns of actomyosin treated with TSPP
如圖3a所示,與未氧化樣品相比,隨著H2O2濃度的增加,-TSPP樣品和+TSPP樣品中的肌球蛋白重鏈(myosin heavy chain,MHC)和肌動蛋白均逐漸降低,當H2O2濃度增加到20 mmol/L時,MHC幾乎完全消失,肌動蛋白條帶也明顯減少。但是隨著氧化程度的增加,相對于未氧化的MHC和肌動蛋白,MHC條帶減少幅度遠大于肌動蛋白,說明肌球蛋白比肌動蛋白更易于氧化,與Li Chunqiang等[21]結果相符。這說明,肌動球蛋白氧化時,主要是其中的肌球蛋白發生氧化。在肌球蛋白和肌動蛋白條帶減少的同時,在濃縮膠上部出現大分子聚合物,但加入還原劑β-ME后,幾乎所有聚集體都消失,同時減少的MHC和肌動蛋白大部分恢復,說明這些大分子聚集體主要是通過二硫鍵形成的。Xiong[26]和Li Chunqiang[21]等指出羥自由基攻擊肌球蛋白時,二硫鍵主要通過肌球蛋白尾部-尾部模式進行交聯。然而,肌動蛋白中二硫鍵交聯模式研究較少,目前尚不明確。
利用AI600超靈敏多功能成像儀對圖3a、c中的MHC和肌動蛋白條帶進行掃描,獲得條帶密度,如圖4所示。對于未氧化蛋白,+TSPP和-TSPP樣品的MHC條帶密度之間沒有明顯差異。在H2O2濃度1 mmol/L時,+TSPP樣品的MHC條帶密度明顯高于-TSPP樣品,說明TSPP對MHC的氧化具有較好的抑制作用。然而,當H2O2濃度為10~20 mmol/L時,+TSPP樣品的MHC條帶密度只是稍高于-TSPP樣品,對MHC氧化的抑制作用不明顯。
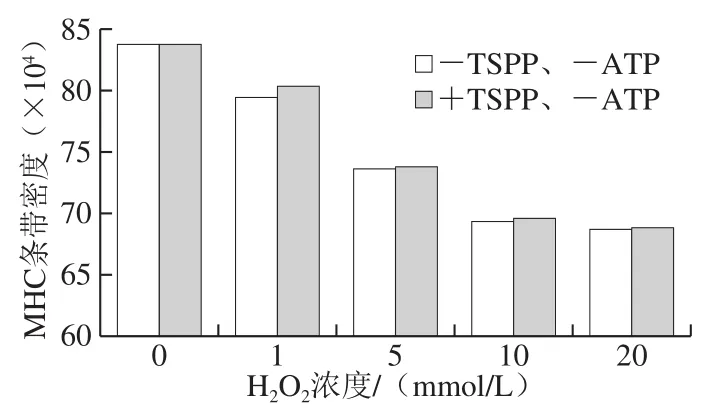
圖4 TSPP對MHC條帶密度的影響Fig. 4 Effect of TSPP on the density of MHC band
當受到羥自由基攻擊時,肌肉蛋白會發生多種變化,如氨基酸修飾、肽鏈斷裂和蛋白交聯等[13],故TSPP對肌動球蛋白氧化的影響需要根據多個指標進行綜合判定。綜合分析羰基、巰基和SDS-PAGE結果可以看出,在H2O2濃度為1 mmol/L時,TSPP抑制肌動球蛋白的氧化;而H2O2濃度為5~20 mmol/L時,TSPP對肌動球蛋白的氧化無抑制作用。劉澤龍[15]研究發現,在0.01 mmol/L FeCl3、0.1 mmol/L抗壞血酸和0.5 mmol/L H2O2條件氧化肌球蛋白,TSPP對肌球蛋白頭部S1和S2頸部起到保護作用,減弱羥自由基攻擊作用。這說明在一定氧化條件下,TSPP對肌肉蛋白確實存在一定的氧化保護作用。
2.2 TSPP對ATP解離作用的影響
2.2.1 黏度
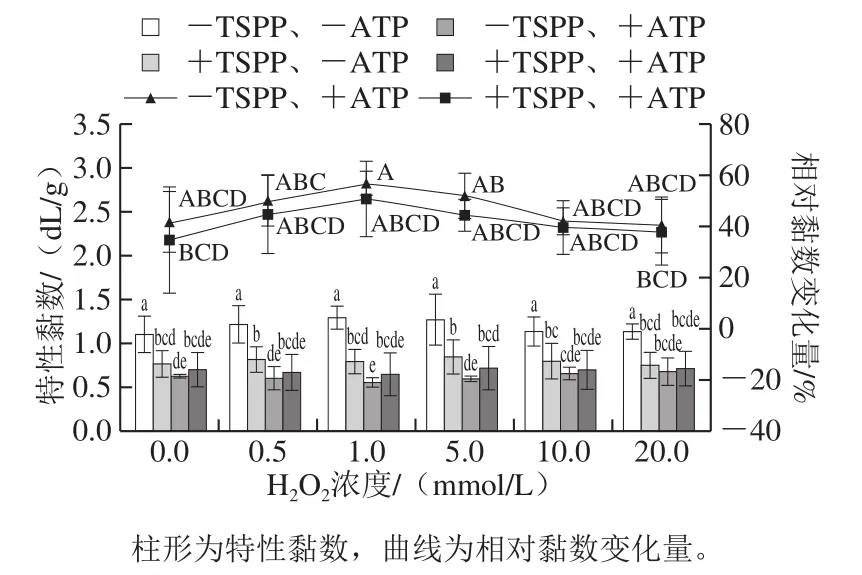
圖5 TSPP和ATP相繼處理后肌動球蛋白特性黏數的變化Fig. 5 Changes in intrinsic viscosity of actomyosin after being treated with TSPP and then completely dissociated with ATP
如圖5所示,相對于其他3 組樣品(+TSPP、-ATP;-TSPP、+ATP;+TSPP、+ATP),未經TSPP和ATP處理(-TSPP、-ATP)樣品的特性黏數最大,為1.10~1.29 dL/g,說明該組樣品的黏度最大,隨著H2O2濃度的增加,-TSPP、-ATP樣品的特性黏數出現先增高后降低的趨勢,但是差異并不顯著(P>0.05),說明蛋白氧化對黏度影響不大。在TSPP條件下,肌動球蛋白的特性黏數顯著下降(P<0.05),鑒于氧化對肌動球蛋白的黏度影響不大,推測黏度顯著下降是由肌動球蛋白發生部分解離[4]引起的。當加入ATP后,不管是否經過TSPP處理,特性黏數均繼續下降,說明肌動球蛋白發生進一步的解離,但是+TSPP肌動球蛋白的特性黏數卻稍高于-TSPP肌動球蛋白,說明TSPP的加入不利于ATP的解離作用,一種推測可能是由于焦磷酸鹽的結合位點與ATP的結合位點相同,存在競爭關系。有研究表明,焦磷酸鹽和ATP在肌球蛋白上的結合位點相同或相近[8-9],而本研究證明二者的結合位點是相同的。另一種推測可能是由于焦磷酸鹽結合到肌球蛋白頭部S1后,改變了ATP結合位點的結構,從而影響ATP的解離作用。對于未氧化肌動球蛋白,TSPP和ATP單獨作用下特性黏數分別下降了30.4%和41.9%,說明TSPP解離效果是ATP的72.6%,表明焦磷酸鹽可使大部分肌動球蛋白解離,但仍有部分肌動球蛋白無法解離。
為了排除氧化自身對特性黏數的影響,以-TSPP、-ATP樣品為對照,計算-TSPP、+ATP和+TSPP、+ATP樣品中由ATP解離引起的相對黏數變化量。如圖5所示,在-TSPP和+TSPP條件下,氧化樣品的相對黏數變化量幾乎都稍高于未氧化樣品。而且,隨著氧化程度的增加,-TSPP和+TSPP樣品的相對黏數變化量均先上升后下降,在H2O2濃度1 mmol/L時相對黏數變化量最大。雖然1 mmol/L H2O2樣品與其他氧化程度樣品的相對黏數變化量差異不顯著,但是在每次重復實驗中均出現此趨勢,說明無論是否存在TSPP,適度蛋白氧化都有利于ATP的解離作用,且氧化程度與TSPP和ATP的解離作用之間確實存在一定關系,推測可能是氧化修飾改變了肌球蛋白頭部與肌動蛋白結合位點的化學變化,也可能是氧化引起的蛋白結構展開更有利于ATP接近解離結合位點。劉澤龍[15]在低鹽(0.1 mol/L)條件下利用1 mmol/L H2O2羥自由基氧化系統氧化5 mg/mL肌動球蛋白6 h和12 h,采用與本實驗相同的方法測定黏度,發現氧化對ATP的解離作用沒有顯著影響,但若觀察相對黏數變化量,可以看出氧化樣品的相對黏數變化量明顯小于未氧化樣品,跟本研究得到的結果有一些差異。分析這2 種結果的差異,推測與鹽濃度有關,因為肌原纖維在低鹽和高鹽時,結構存在很大差異,例如高鹽更有利于肌原纖維膨脹和肌球蛋白的溶出[12,27]、增加肌原纖維靜電斥力等[28],可能會弱化ATP與肌球蛋白頭部的結合。
2.2.2 平均粒徑
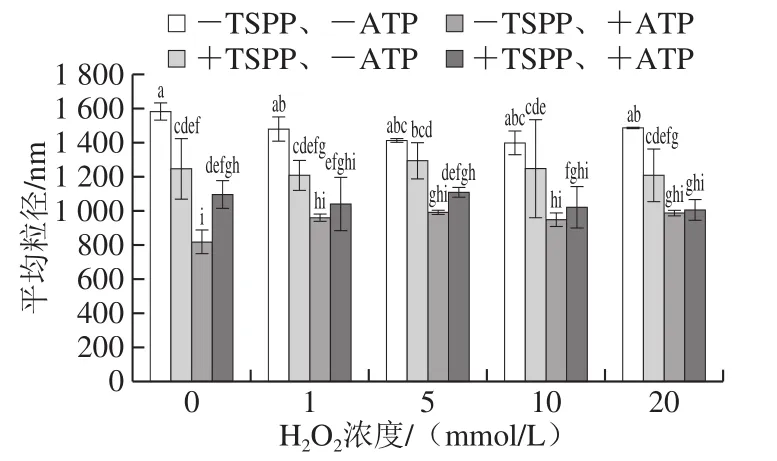
圖6 TSPP和ATP相繼處理后肌動球蛋白平均粒徑的變化Fig. 6 Changes in average particle size of actomyosin after being treated with TSPP and then completely dissociated with ATP
由于肌動球蛋白解離生成肌動蛋白和肌球蛋白,粒徑會隨解離進行而發生改變,所以可通過測量平均粒徑評判解離程度的高低[15]。TSPP和ATP處理后,不同氧化程度肌動球蛋白的平均粒徑變化如圖6所示。可以看出,-TSPP、-ATP肌動球蛋白的平均粒徑最大。TSPP處理后,肌動球蛋白的平均粒徑均顯著減小(P<0.05),說明部分肌動球蛋白在TSPP作用下解離為肌球蛋白和肌動蛋白,導致平均粒徑變小。加入ATP后,平均粒徑進一步顯著減小(P<0.05),說明肌動球蛋白進一步發生解離,但是+TSPP、+ATP肌動球蛋白的平均粒徑卻高于-TSPP、+ATP肌動球蛋白,間接說明TSPP的加入不利于ATP的解離作用。TSPP和ATP單獨作用時,未氧化肌動球蛋白的平均粒徑分別下降了21.2%和48.4%,TSPP處理樣品平均粒徑的下降幅度是ATP處理樣品的43.8%。對于4 組樣品(-TSPP、-ATP;+TSPP、-ATP;-TSPP、+ATP;+TSPP、+ATP),每一組樣品隨H2O2濃度的變化差異均不顯著,說明TSPP和ATP對粒徑的影響遠大于蛋白氧化。總體來看,平均粒徑和黏度的變化趨勢非常相似,進一步印證了TSPP和ATP的解離作用。
2.2.3 微觀結構
應用透射電子顯微鏡觀察TSPP及ATP處理后不同氧化程度的肌動球蛋白的解離情況,如圖7所示。未經TSPP和ATP處理時,未氧化的肌動球蛋白呈較長的纖維狀,此時肌球蛋白頭部與絲狀結構的F-肌動蛋白[29]呈結合狀態。單獨加入TSPP或ATP后,肌動球蛋白解離,導致蛋白的結構相對松散,生成較短的纖維簇,而且+ATP樣品中蛋白纖維長度比+TSPP樣品更短,說明ATP解離效果更好。此外,還可以看出相對于單獨+TSPP樣品,單獨+ATP樣品中出現更多離散的纖維結。張軍等[30]報道在含有2 mmol/L MgCl2、100 mmol/L KCl、1 mmol/L DTT和1 mmol/L ATP的5 mmol/L Tris-Cl緩沖液(pH 7.5)中及沒有微絲穩定劑(鬼筆環肽)存在的條件下,肌動蛋白微絲之間會相互纏繞或者形成多級螺旋的纖維結構,自組裝成離散的、大尺度的復雜聚集結構。在TSPP處理樣品中加入ATP,可以看出肌動球蛋白解離效果不如單獨使用ATP,存在一些稍長的纖維,這與圖5和圖6結果相符,說明TSPP的加入反而會在一定程度上抑制ATP的解離效果。
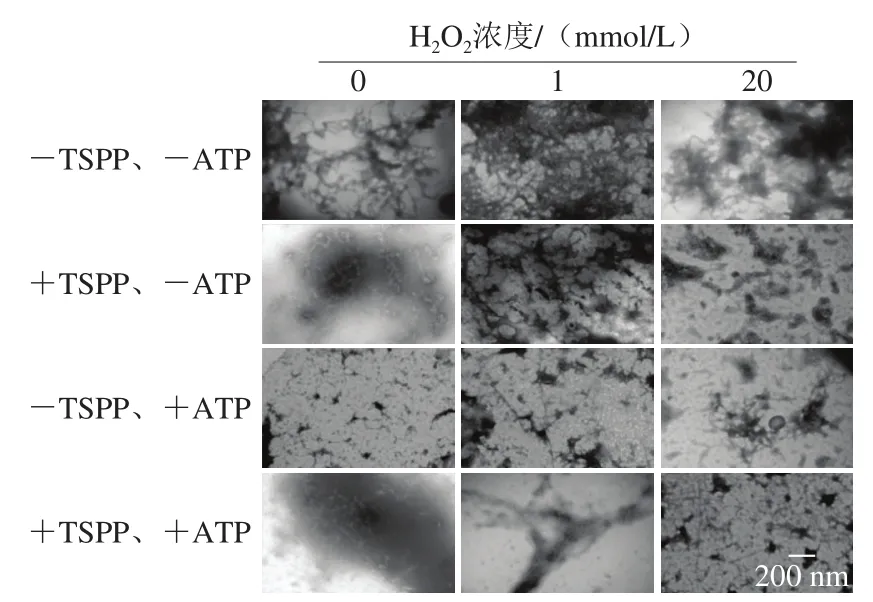
圖7 TSPP和ATP相繼處理后肌動球蛋白形態變化Fig. 7 Morphological changes of actomyosin after being treated with TSPP and then completely dissociated with ATP
4 組樣品(-TSPP、-ATP;+TSPP、-ATP;-TSPP、+ATP;+TSPP、+ATP),隨著H2O2濃度的增加,均發生蛋白聚集現象。對于-TSPP、-ATP樣品,當H2O2濃度為1 mmol/L時,纖維狀的肌動球蛋白聚集成空洞比較疏松的網狀結構;當H2O2濃度繼續增加為20 mmol/L時,疏松的網狀結構被破壞,大量肌動球蛋白聚集成致密的蛋白團塊。對于其他3 組解離樣品(+TSPP、-ATP;-TSPP、+ATP;+TSPP、+ATP),由于肌動球蛋白解離成肌球蛋白和肌動蛋白,雖然氧化程度增加,但是蛋白聚集程度比-TSPP、-ATP樣品弱,結構較松散。總體來說,3 組樣品的聚集程度由強到弱依次是:+TSPP、-ATP>+TSPP、+ATP>-TSPP、+ATP。其中+TSPP、-ATP和+TSPP、+ATP樣品中存在不同程度的蛋白網絡結構,而-TSPP、+ATP樣品中幾乎很少有密集的網絡狀蛋白聚集結構,這應該是因為3 種處理條件下,肌動球蛋白解離程度不同所致。
3 結 論
適度氧化(例如1 mmol/L H2O2Fenton試劑氧化2 h)時,TSPP對肌動球蛋白的氧化起到一定的抑制作用,而氧化程度加深時(例如20 mmol/L H2O2),TSPP的抑制作用不明顯。蛋白氧化在某種程度上有利于ATP的解離作用,然而,這種作用會被TSPP弱化,可能與TSPP與ATP結合位點相同有關。利用TSPP可使大部分肌動球蛋白解離的性質,結合滾揉腌制可提高肌肉的嫩度。然而,TSPP處理后,仍有部分蛋白無法解離。當遭受氧化時,未解離的肌動球蛋白仍會形成大的蛋白聚集物,不利于肌肉嫩度的提高。此外,由于肉制品加工(例如滾揉按摩、斬拌)時肌肉蛋白不可避免的發生氧化,且氧化形成的蛋白聚集物對肌肉蛋白在脂肪表面的分布及蛋白凝膠網絡結構的形成均有一定影響,故TSPP處理對肉制品品質(如質地、嫩度和多汁性等)的提高作用并不能達到最佳效果。因此,有必要進一步研究提高TSPP解離效果的方法及措施。

