采用室內質量控制和室間質評數據評定腫瘤標志物檢驗項目的測量不確定度
秦妍妍,楊延敏
北京豐臺醫院檢驗科,北京 100070
測量不確定度(measurement uncertainty,MU)是表征賦予被測量量值分散性的非負參數[1],是對測量結果質量的定量表征。MU在實驗室主要被用于提高檢驗結果質量、選擇可靠檢測程序及幫助臨床改進對患者結果的解釋與應用、將報告測量量值與醫學參考值或臨床決定限進行比較或同一患者的前、后兩次測量量值比較[2]。很多國際組織機構,如國際標準化組織(International Organization for Standardization,ISO)[3],國際臨床化學與檢驗醫學聯合會(International Federation of Clinical Chemistry and Laboratory Medicine,IFCC)[4]、國際實驗室認可合作組織(International Laboratory Accreditation Cooperation,ILAC)[5]要求評定測量不確定度。ISO15189:2012《醫學實驗室-質量和能力的具體要求》[3]認可明確規定測量不確定度的估計值可能包括確認患者的數值符合實驗室設定的質量目標,以及將患者檢測值與先前同類數值或臨床決定限值進行有意義的比較,明確指出,報告臨床結果時,醫學實驗室應確定每個測量程序的MU 及性能要求,當操作者、儀器設備或試劑發生變化時,實驗室應定期評估和審查MU并更新。ISO已被等同轉換為國家標準GB/T22576[6],這使我國臨床檢驗人員必須要面對檢驗結果不確定度的問題。中國合格評定國家認可委員會(China National Accreditation Service for Conformity Assessment,CNAS)頒布的《醫學實驗室——測量不確定度的評定與表達》的技術報告[7],介紹了“自上而下(top-down)”的評定方法,從不精密度和偏移兩個方面評定不確定度。其中,評定不精密度引入的不確定度多使用室內質量控制(internal quality control,IQC)數據,評定偏移引入的測量不確定度多使用與有證參考物質(certified reference material,CRM)進行比較、應用室間質量評價(external quality assurance,EQA)數據及與參考測量方法比較。目前,在常規臨床醫學實驗室實際工作中,腫瘤標志物檢驗項目的CRM成本高昂且較難獲取,參考測量程序要求高且方法復雜,一般常規臨床醫學實驗室無法建立相應的參考測量程序,而EQA 數據較易得到,可反映醫學實驗室的正確度,且更能用于評價該實驗室較長時間跨度的常規工作[8-9]。
目前由于MU 評定方法不統一,缺少一致化的MU 評價標準等問題,限制了其在醫學檢驗臨床實踐中的應用。此外,由于在醫學檢驗科學中,定量檢測項目MU 概念相對較新,因此醫學檢驗人員在面對實驗室認可、認證的要求時,無法準確有效評價和應用臨床實驗室的MU。本文嘗試收集本實驗室腫瘤標志物IQC數據和北京市臨床檢驗中心腫瘤標志物EQA數據,采用top-down方法,評定腫瘤標志物檢驗項目MU,探討利用實驗室常規工作中易獲取數據建立一種方便可行的MU評估方法;并與北京市臨床檢驗中心EQA計劃的的允許總誤差(allowable total error,TEa)及基于生物學變異推導出的TEa[10-11]進行比較,以觀察本實驗室腫瘤標志物檢驗項目的檢測水平。
1 材料與方法
1.1 儀器與試劑 雅培i2000化學發光免疫分析儀(美國雅培公司生產)及其配套試劑、校準品。
1.2 檢測指標 甲胎蛋白(α-fetoprotein,AFP)、癌胚抗原(carcinoembryonic antigen,CEA)、糖類抗原125 (carbohydrate antigen 125,CA125)、糖類抗原153(carbohydrate antigen 153,CA153)、糖 類 抗 原199(carbohydrate antigen 199,CA199)、總前列腺特異性抗原(total prostate-specific antigen,t-PSA)、游離前列腺特異性抗原(free prostate specific antigen,f-PSA)共7項。
1.3 質控品與EQA樣本 質控品購自美國伯樂公司(批號:54642)。質控品工作日每天測定1 次,收集2019 年7月1日至2019 年12 月31日在控數據,該時間段內各項質控品批號一致。EQA 樣本由北京市臨床檢驗中心提供,實驗室在規定時間內以與測量患者樣本相同的方式測量EQA樣本,并將結果反饋到北京市臨床檢驗中心網站。
1.4 數據來源
1.4.1 測量復現性引入的相對測量不確定度[urel(Rw)]分量評定 采用室內質量控制數據不精密度來表示。收集本實驗室2019 年7~12 月共6 個月相同批次在控的室內質控數據,以確保考慮到由于不同操作員、試劑、試劑批號和儀器維護保養而引入的潛在變化,計算變異系數作為不精密度分量。
1.4.2 偏移引入的相對測量不確定度[ucrel(bias)]分量評定 收集本實驗室參加北京市臨床檢驗中心2017—2019年腫瘤標志物室間質量評價共計6次[7,12-14],質評成績均100%合格。同時采納EQA組織者給出的公認值Ccons,i、本實驗室測量值xi、本組EQA數據得出的測量復現性RSDR,i和參加單次EQA的實驗室數量m。由于每次EQA 的公認值很難一致,所以通過EQA 數據評定由偏移引入的測量不確定度時多采用相對值進行計算。
1.5 不確定度計算 收集本實驗室IQC 數據和北京市臨檢中心EQA 數據,采用top-down 法進行測量不確定度的評定。
1.5.1 實驗室內測量復現性引入的相對測量不確定度[urel(Rw)]評定 統計實驗室連續6個月(1次/d),1 個濃度水平相同批號質控品室內質控數據,統計質控累積的均值、標準差和變異系數,依據公式(1)計算,其中CV(Rw)為批間變異系數,x為內室內質控數據的均值,S(Rw)為標準差。
1.5.2 偏移引入的相對測量不確定度urel(bias)評定 包括評估偏移時重復測量引入的不確定度[方法和實驗室偏移,RMSrel(bias)]和評估偏移所使用方法本身的不確定度[urel(Cref)]。按照下列公式計算:(a)根據實測值和北京市臨床檢驗中心提供的公認值,依據公式(2)計算每次EQA的相對偏移量值(brel,i),其中xi為實驗室本身每次測量值,Ccos,i為每次EQA 的公認值。(b)計算方法和實驗室相對偏移[RMSrel(bias)]:依據公式(3)計算,其中n為EQA 次數。(c) 計算單次EQA 公認值的測量復現性引入的相對測量不確定度[urel(cons,i)]:依據公式(4)計算,其中RSDR,i為單次EQA的相對測量復現性,m為參加單次EQA的實驗室數量。(d)計算多次EQA 公認值的測量重復性引入的相對測量不確定度[urel(Cref)]:依據公式(5)計算,其中n為EQA 次數。(e)計算偏移引入的相對測量不確定度ucrel(bias):依據公式(6)計算。
1.5.3 相對合成標準不確定度評定(urel) 依據公式(7)計算。
1.5.4 相對擴展不確定度評定(urel) 依據公式(8)計算,對于95%置信水平,k=2。

1.6 目標不確定度的設定與比較 將計算的相對擴展不確定度分別與北京市臨床檢驗中心室間質量評價允許總誤差TEa、基于生物學變異推導出的TEa進行比較,以觀察腫瘤標志物檢驗項目的檢測水平。
1.7 統計學方法 采用Microsoft Excel 2010,計算測量不確定度和相關分量。
2 結果
2.1 實驗室內測量復現性引入的相對測量不確定度 統計實驗室2019年7~12月的腫瘤標志物1個濃度水平室內質控(同一批號)數據,使用不同批號的試劑進行檢測,經多次校準、常規儀器維護、校準品批號改變等并由不同的實驗室工作人員輪流操作,見表1。

表1 7項腫瘤標志物檢驗項目的相對實驗室內測量復現性
2.2 偏移引入的不確定度
2.2.1 實驗室和方法偏移 統計2017—2019 年的6次EQA 結果,記錄與室內質控濃度接近樣本的偏移,計算RMSrel(bias),見表2。
2.2.2 偏移所使用方法本身的不確定度 下載每次EQA 的能力驗證報告,記錄本室設備所在分組的實驗室數(m)和單次EQA 的相對實驗室內測量復現性(RSDR,i,%),計算urel(Cref),結果見表3。
2.3 相對合成標準不確定度和相對擴展不確定度 將上述不確定度分量進行合成,并與北京市臨床檢驗中心室間質量評價TEa、基于生物學變異推導出的TEa進行比較,見表4。7項腫瘤標志物檢驗項目的相對擴展不確定度分別是AFP,11.9%;CEA,11.5%;CA125,11.8%;CA153,9.7%;CA199,9.80%;t-PSA,11.6%;f-PSA,15.9%(k=2)。7項檢驗指標均符合北京市臨床檢驗中心室間質量評價TEa 要求;CEA、CA125、CA153、CA199、t-PSA的相對擴展不確定度符合基于生物學變異最佳的TEa 質量規范要求,AFP 的相對擴展不確定度未達到基于生物學變異最佳的TEa質量規范要求。

表2 7項腫瘤標志物檢測項目的方法和實驗室偏移
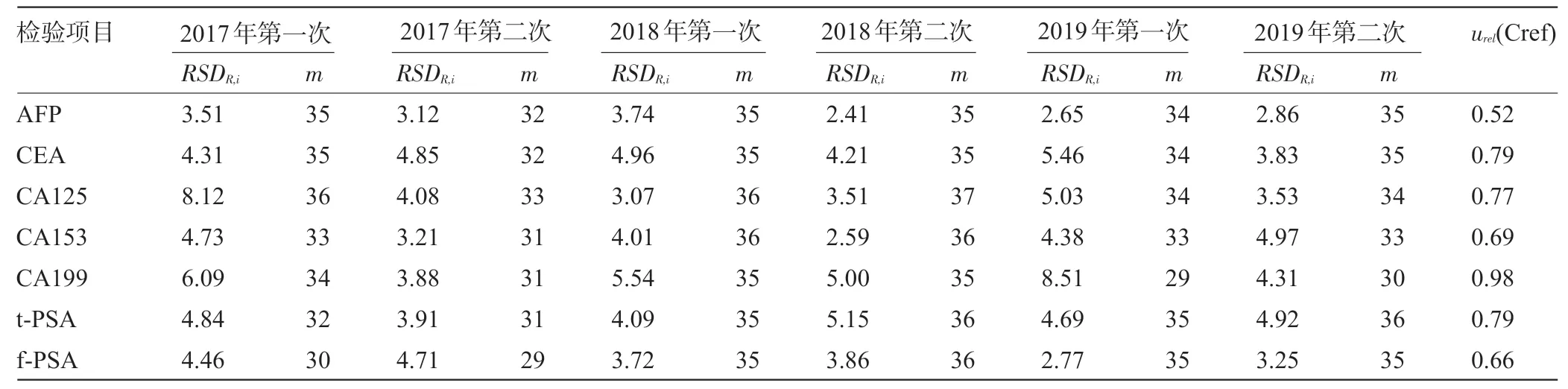
表3 7項腫瘤標志物檢測項目的EQA公認值相對測量不確定度
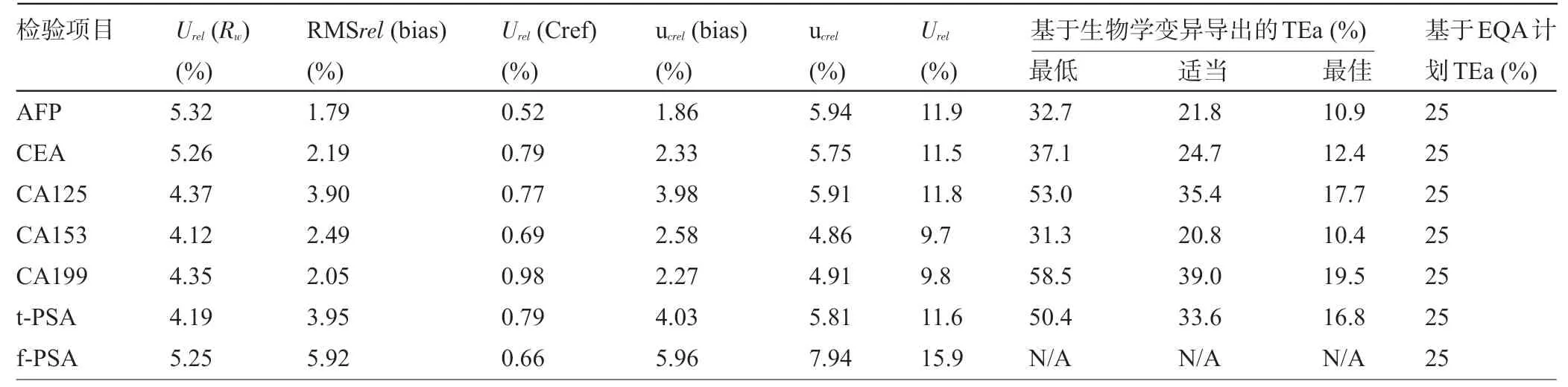
表4 7項腫瘤標志物檢驗項目的相對合成不確定度和相對擴展不確定度及其與不同質量規范TEa比較
3 討論
在許多惡性腫瘤疾病中,腫瘤標志物檢測在患者治療和監測管理中發揮重要作用,為此對腫瘤標志物檢驗質量也提出了更高的要求。對醫學實驗室來說,如何正確認識和提高其測量質量是一個挑戰,測量不確定度作為質量管理評價指標,為腫瘤標志物檢驗結果的準確性提供了良好的保障。
測量不確定度評定大致可分為“自下而上(bottom-up)”和“自上而下(top-down)”兩種方法[15]。bottom-up 是基于對測量的全面、系統分析后,識別出每個可能的不確定度來源并加以評定,該方法已得到計量機構和標準物質供應商的認可,主要應用于執行參考測量程序的認證實驗室和參考物質賦值中的不確定度評定,常規臨床醫學實驗室應用較少。top-down方法是在控制不確定度來源或程序的前提下,評定每個測量值的不確定度,即運用統計學原理直接評定特定測量系統之受控結果的測量不確定度。通常通過質量控制數據和能力驗證數據進行評定,主要考慮偏移的影響和實驗室內的復現性,方法簡便,適于常規臨床醫學實驗室應用。有研究證實:在通常情況下,如果臨床實驗室測量結果不確定度的評估是正確的,兩種方法的評估結果應非常相近,可以互換[16-17],這意味著臨床實驗室可以使用更簡單的自上而下的方法來確定測量不確定。CNAS 技術報告也推薦使用top-down 方法,通過不精密度和偏移兩個方面評定測量不確定度。童清等[18]使用top-down 方法,采用室內質控與能力驗證數據,從實驗室內復現性和偏移兩個主要分量對北京市47 家三級醫院檢驗科酶學項目測量不確定度進行評估;王尉等[19]使用top-down方法,采用北京市臨床檢驗中心EQA 數據初步建立了北京地區常規凝血項目目標測量不確定度;國外PADOAN等[20]、MAGNUSSON 等[21]使用top-down 方法,采用室內質量控制數據和室間質量評價數據,評估生化部分項目不確定度。MEIJER等[22]提出測量不確定度可以通過EQA數據估計方法和實驗室偏移。在這種情況下,實驗室間比對的數據以與參考物質數據相同的方式使用(即估算偏移)。為了對實驗室間比對數據的偏移有一個合理清晰的了解,實驗室應在規定的時間段內至少參與6個批次實驗室室間比對計劃[12]。
本研究采用top-down法對本實驗室7項腫瘤標志物檢驗項目評定其測量不確定度,評定過程相對簡單,數據易得。不精密度來源于室內質控數據,這些數據來自常規臨床醫學實驗室一段較長期間(通常6個月或更長時間)的日常工作,包含了各種影響因素(不同批號試劑、不同批號校準品、多次校準、不同操作者、儀器維護等分量),這樣評估的測量不確定度能夠客觀、準確地反映本實驗室實際測量結果。該方法實用、簡便,只要開展了IQC的項目,就可用此方法評定不精密度引入的不確定度。在評定偏移引入的不確定度時,應用了本室最近3 年共6 批次室間質量評價成績合格的EQA 數據,選取的數據跨越了較長的時間,EQA結果又足夠可信,數據也易獲得,所需的計算是直接的,不增加實驗室工作量,相比于購買昂貴的CRM 或被測量尚無法計量溯源到公認的參考系統的項目進行測量不確定度評定而言,這不失是一種既經濟又實用的方法。重要的是,常規臨床醫學實驗室可以獨立計算測量不確定度。并且,隨著參與時間、參與頻次的增加,使用EQA數據持續更新實驗室測量不確定度的數據,可以作為定期評定的方法,具有良好的臨床應用前景。
本研究將評定相對擴展不確定度分別與北京市臨床檢驗中心室間質量評價TEa、基于生物學變異推導出的TEa進行比較,從表4結果可知,在目前的實驗條件和方法下,7 項腫瘤標志物檢驗指標均符合北京市臨床檢驗中心室間質量評價TEa要求,多數腫瘤標志物檢測指標均能達到基于生物學變異最佳的TEa的質量規范要求。北京市臨床檢驗中心室間質量評價TEa 具有廣泛的接受度,通常室間質量評價計劃設置的最低目標是使大多數實驗室均能通過,從而鑒別少數質量不能達到最基本要求的實驗室或測試項目,因此多數實驗室能夠通過室間質量評價計劃,但并不很關注所選測試項目的的具體檢測性能。北京市臨床檢驗中心每年發放2~3 次質評樣本,基于測量不確定度的結果可用來常規監測實驗室檢測質量。而基于生物學變異的目標更具有實用性,可以更全面客觀地了解各實驗室的檢測水平,特別是有助于進一步區分免疫項目的檢測性能。本實驗室AFP 的相對擴展不確定度未達到基于生物學變異最佳的TEa質量規范要求,進一步分析其不確定度各分量貢獻的大小,主要原因為不精密度,要減小本實驗室AFP 擴展不確定度,可通過進一步提高AFP 的不精密度來實現,可采取如下措施:加強儀器定期維護和保養、規范校準品及質控品的復溶和分裝保存、嚴控試劑機載時間、規范操作流程,加強人員培訓等。同時也提示臨床實驗室可根據自己目前實際情況,評估自身能達到的質量水平,為實驗室設置合適的質量評價目標,結合不確定度評定指導實驗室的質量管理與持續改進。
綜上所述,應用top-down,結合實驗室室內質量控制數據和室間質量評價數據,評定臨床實驗室腫瘤標志物檢驗結果的測量不確定度是一種簡單易行的方法,適用于常規臨床醫學實驗室,對促進臨床實驗室標準化管理,提高臨床檢驗質量有重要指導意義。

