基于生物信息學方法分析頸動脈粥樣硬化的關鍵通路和樞紐基因
李先芳,林璋
(福建省老年醫院心血管內科,福建 福州350000)
頸動脈粥樣硬化是心腦血管疾病發生的主要因素,明確頸動脈粥樣硬化的發病機制是預防心腦血管的關鍵[1-3],盡管影響頸動脈粥樣硬化的相關因素較多,但目前頸動脈粥樣硬化的分子機制尚未完全明確,因此,研究頸動脈粥樣硬化的分子機制具有重要意義。隨著測序技術的發展及公共數據庫的建立,利用生物信息學探索疾病的相關機制越來越普遍[4]。本研究利用生物信息學和GEO公共數據庫進行分析,獲得頸動脈斑塊與斑塊旁組織的差異基因(differentially expressed genes,DEGs),并利用GO和KEGG對差異基因進行富集分析,同時利用PPI網絡和cytoscape技術篩選差異基因的樞紐基因,探索經頸動脈粥樣硬化潛在的治療靶點,為心腦血管疾病的早期預警奠定一定的理論基礎,現報道如下。
1 材料與方法
1.1 差異基因的篩選 在GEO數據庫分析GSE43292數據集,該數據集含有32例頸動脈粥樣斑塊組織和32例斑塊旁組織,利用GEO2R在線工具分析獲得DEGs,利用R語言進行火山圖繪制。
1.2 GO和KEGG分析GO富集分析是按照生物學進程(biological process,BP)、分子功能(molecular function,MF)和細胞組分(cellular component,CC)進行富集調查的方法,對基因功能進行注解;KEGG是將基因按照所在生物學通路進行富集分析。利用R語言包clusterprofile對DEGs進行GO和KEGG分析。
1.3 蛋白互作網絡構建和樞紐基因的篩選 蛋白互作(proetin-protein interaciton,PPI)網絡是用于預測和分析蛋白之間的潛在相互作用,利用STRING在線數據庫構建PPI網絡(https://string-db.org/cgi/input.pl),將蛋白互作網絡導入cytoscape軟件,利用cytohubba篩選樞紐基因。
2 結果
利用GEO2R分析GSE43292共獲得97個DEGs,包括46個上調DEGs和51個下調DEGs,所獲結果可視化為火山圖,見圖1。

圖1 GSE43292的火山圖Figure 1 Volcano map of GSE43292
2.1 差異表達基因的GO功能富集及KEGG通路分析 利用R語言對97個DEGs進行GO功能注釋和KEGG信號通路富集分析,按富集基因數目排序,分別取位于前10的分析結果。GO功能注釋結果顯示:在生物學過程中,DEGs主要涉及細胞外結構組織、平滑肌細胞增殖的負調控、吲哚烷基胺代謝過程等,見圖2;在細胞組分中,DEGs主要與細胞外基質、受體復合物和細胞膜面有關,見圖3;在分子功能上,DEGs主要涉及碳水化合物結合、酰胺鍵、金屬內肽酶活性等。KEGG通路分析顯示,DEGs主要富集cAMP信號通路、色氨酸代謝、PPAR信號通路等相關通路,見圖4~5。
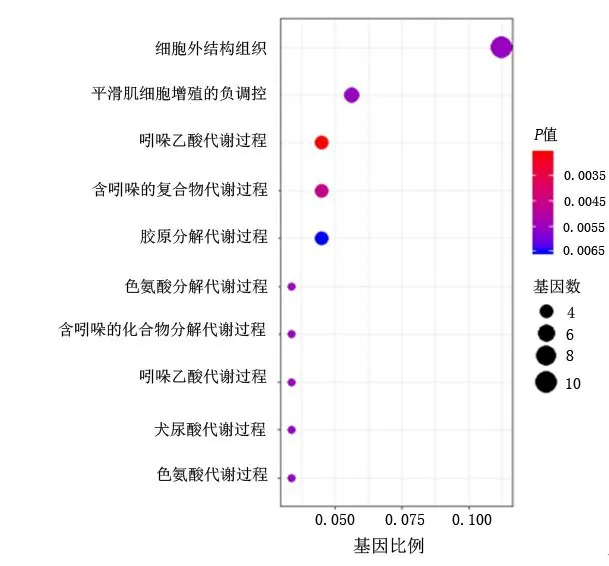
圖2 差異基因的GO注釋功能生物學過程分析Figure 2 The biological process of GO analysis
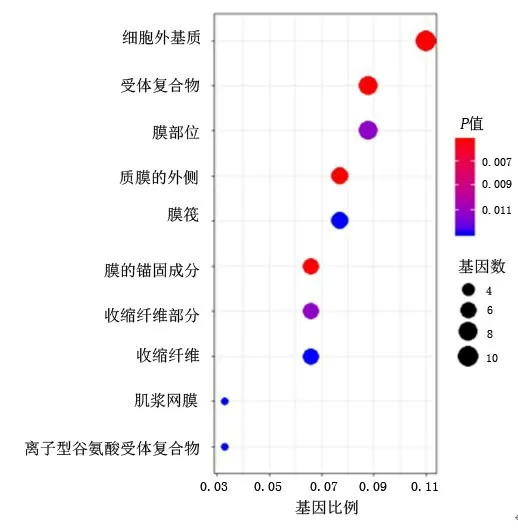
圖3 差異基因的GO注釋功能細胞組分分析Figure 3 The cellular component of GO analysis

圖4 差異基因的GO注釋功能分子功能分析Figure 4 The molecular function of GO analysis

圖5 差異基因的KEGG富集通路分析Figure 5 KEGG pathway analysis
2.3 PPl網絡構建及樞紐基因建立 將97個DEGs的String蛋白互作分析結果導入Cytoscape進行可視化,見圖6,然后在MCODE插件中找出得分最高的蛋白互作模塊,最后在cytoHubba插件中利用MCC法篩選MMP9、CXCL10、CD163和CCR1等5個樞紐基因,見圖6。
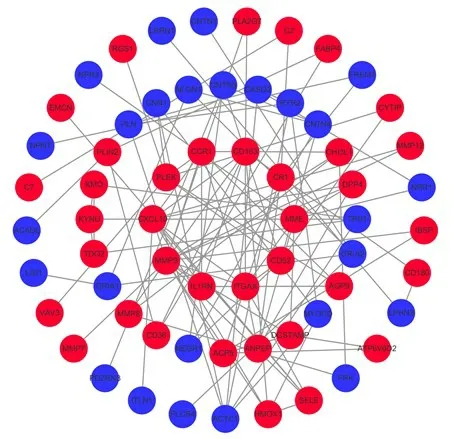
圖6 差異基因PPI網絡圖Figure 6 PPI netwolk of DEGs
3 討論
本研究利用生物信息學分析技術對頸動脈斑塊組織和斑塊旁組織進行分析,共獲得97個DEGs,其中上調基因46個,下調基因51個。DEGs可能與頸動脈斑塊的發生和發展相關[5-6]。KEGG基因富集分析發現頸動脈粥樣硬化的發生、發展可能與cAMP信號通路、色氨酸代謝、PPAR信號通路等有關[7]。PPI網絡分析篩選出CD163、MMP9、CXCL10、CCR1為樞紐基因,可能在動脈粥樣斑塊進展中發揮重要的作用[8-9]。
CD163為清道夫受體半胱氨酸富集結構域家族成員,其通常在單核巨噬細胞膜上表達,通過調控炎癥因子的表達而發揮抗炎、抗氧化作用,與清道夫的功能相關[10-11]。而清道夫是與頸動脈斑塊的危險因素。MMP9屬于基質金屬蛋白酶家族,是一種基質溶解素。大量研究表明,血清MMP-9與頸動脈粥樣硬化性斑塊形成及其穩定性密切相關[12-13]。動脈粥樣硬化初期,激活的血管內皮細胞表達CXCL10粘附分子,發揮粘性趨化炎性細胞的滲入,隨著血小板的轉移,炎性細胞隨之滲入血管壁和血管平滑肌細胞,所以在動脈粥樣硬化中至關重要[14-15]。迄今為止,動脈粥樣硬化的潛在機制未完全清楚,但其重要環節中均發現炎性細胞的局部浸潤及CXCL10的表達量增加[16-17]。CCR1即趨化因子C-C基元受體1,該基因編碼β趨化因子受體家族的成員,此受體有7個跨膜區,而其與正常T淋巴細胞的分泌、單核細胞趨化蛋白3(MCP3)以及骨髓祖細胞抑制因子-1(MPIF)均有關,影響巨噬細胞的功能[18]。
綜上所述,本研究通過生物信息學方法分析頸動脈粥樣硬化斑塊的相關通路變化,為頸動脈斑塊發生機制研究奠定基礎,本研究篩選的樞紐基因,可能成為頸動脈粥樣硬化斑塊的潛在治療靶點。

