慢病毒載體凍干制劑的制備與穩定性研究
沈鴻偉, 李明昊, 徐 南, 邵佳琪, 王 鏡, 俞 磊
(華東師范大學 化學與分子工程學院,上海 200062)
0 引 言
慢病毒載體(Lentiviral Vector, LV)是以人類免疫缺陷型病毒(HIV)為基礎發展起來的基因治療載體, 對分裂細胞和非分裂細胞均具有感染能力, 并可以在體內長期穩定地表達[1]. 目前腫瘤免疫治療兩大主流的過繼性細胞療法包括T細胞受體(T Cell Receptor, TCR)?T 細胞和嵌合抗原受體(Chimeric Antigen Receptor, CAR)?T細胞療法, 其中LV已被廣泛應用[2?3]. CAR?T細胞生產環節中包括以攜帶目的基因的慢病毒載體感染T細胞, 其中慢病毒的滴度對感染是否成功非常關鍵. 由于慢病毒載體實質是由蛋白質和核酸組成, 這就導致了其儲存條件的局限性[4]. 通常, 慢病毒載體無法在常溫及4 ℃冷藏的條件下長時間保存, 其熱穩定性較差, 同時反復凍融會降低其滴度, 甚至形成不同程度的降解物. 目前并沒有理想的慢病毒載體凍存保護液, 這就導致常規的–80 ℃條件冷凍保存或者加入甘油保護劑也不能有效防止慢病毒載體在儲存過程中滴度的降低[5?6]. 此外, 慢病毒載體在遠距離運輸時, 需要采取冷鏈運輸的方式, 增加了運輸成本; 即便使用較大量的干冰保護, 也有可能由于溫度變化導致活性降低, 無法規避運輸過程中帶來的風險.
冷凍干燥(Freeze?drying或Lyophilization), 全稱真空冷凍干燥, 簡稱凍干, 是在低溫減壓的條件下利用水的升華性能, 使藥物低溫脫水而達到干燥目的的一種技術[7]. 由于真空冷凍干燥技術在低溫、低氧環境下進行, 大多數生物反應停滯, 且處理過程無液態水存在, 水分以固體狀態直接升華, 使物料原有結構和形狀得到最大程度的保護, 最終獲得外觀和內在品質兼備的優質干燥制品[8]. 通過真空冷凍干燥方法制備得到的粉體硬團聚少、粒徑小且均勻, 已經發展成為制備生物制品(尤其是蛋白多肽類)粉針劑的一種重要方法[9?11].
目前國內外的專家學者對于慢病毒載體保存方法的研究少之又少. 有些學者對于慢病毒載體保存方法的研究主要為凍存保護液的處方優化, 欲通過添加適當的保護劑或者改變緩沖體系增強其凍存穩定性的效果[12?14]. 對于慢病毒載體凍干制劑鮮有研究, 且未取得良好的效果[15]. 針對這一研究現狀,本文以解決慢病毒載體儲存及運輸穩定性的問題為目的, 提出以下研究思路.
本文旨在利用真空冷凍干燥的方法, 結合生物制品的保存技術, 選取慢病毒載體來探索出適合病毒類載體儲存的新劑型, 同時制備得到新型的慢病毒載體凍干制劑, 通過篩選慢病毒載體凍干保護劑處方, 并以正交實驗設計(DOE)的方法進行處方優化, 制備得到外觀良好、生物滴度高的慢病毒載體凍干制劑, 使得該制劑在常溫下具有較長的保質期, 并且能夠在高溫高濕的條件下依然保持較高的生物活性.
1 實驗部分
1.1 儀器與試劑
75 cm2細胞培養瓶, 24孔細胞培養皿(Corning公司); Labconco Freezone?真空冷凍干燥機(美國Labconco公司); HR40?IIA2型生物安全柜(海爾公司), CCL?170B?8型二氧化碳恒溫培養箱(ESCO公司),蠕動泵(Thermo公司); AX224ZH/E型電子天平(奧豪斯公司); S470?K型pH計(梅特勒?托利多國際貿易有限公司); Attune NXT型流式細胞儀(Life Technologies公司); 100 kd超濾管, 0.22 μm濾膜(Millipore公司).
海藻糖(分析純, Pfanstiehl公司); DMEM細胞培養基、胎牛血清FBS購自美國Gibco公司; 氫氧化鈉、蔗糖購自Sigma公司; PBS購自Corning公司; 二水氯化鈣、無水硫酸鎂、精氨酸、甘油、甘露醇、明膠、PEG6000購自生工生物工程(上海)股份有限公司; 人血白蛋白; 右旋糖酐葡萄糖注射液;L?組氨酸、L?丙氨酸、甘氨酸購自國藥集團; 細菌內毒素檢查用水購自廈門鱟試劑生物科技股份有限公司; QPCR基因組DNA提取試劑盒購自天根生化科技(北京)有限公司.
1.2 實驗方法
1.2.1 ssCART?19質粒的構建與抽提
對本實驗所用的目的質粒ssCART?19進行構建及抽提. 目的質粒構建主要為將目的基因與工具載體進行重組、轉化挑取多個單克隆, 搖菌并小抽進行酶切鑒定, 選擇一個酶切鑒定正確的單克隆進行抽提, 得到含有anti?CD19基因的目的質粒. 質粒抽提主要使用中抽試劑盒, 通過對大腸桿菌的培養得到帶有目的基因的質粒的菌液, 通過收集菌液、裂解中和、分離醇沉得到目的質粒.
1.2.2 LV1819慢病毒載體的包裝與濃縮液制備
本實驗中采用磷酸鈣?DNA共沉淀法制備LV1819慢病毒載體[14], 具體制備過程如下.
使用75 cm2細胞培養瓶進行293T細胞貼壁培養, 待細胞狀態良好、細胞密度為70%~80%時采用四質粒系統進行293 T細胞轉染. 轉染后6 h進行換液, 24 h后進行補液, 48 h后收集病毒上清, 然后進行澄清過濾, 過濾后使用小膜包進行濃縮, 濃縮50倍得到慢病毒載體濃縮液. 在處方篩選與優化實驗過程中, 由于處方設計組數較多, 故在得到病毒上清澄清過濾后, 采用超濾的方法進行濃縮, 將各組凍干保護劑置換原有的培養基得到濃縮液.
1.2.3 LV1819慢病毒載體凍干制劑制備
配制慢病毒載體凍干保護劑溶液, 將凍干保護劑處方中的各組分按照比例的含量稱取后溶解在PBS緩沖溶液中, 用1 mol/L PB調節混合溶液的pH值至7.4. 將配制好的凍干保護劑溶液按照凍干保護劑: 慢病毒載體濃縮液為3∶2的體積比加入濃縮液中, 混合均勻后分裝置于4 ℃保存. 采用傳統的真空冷凍干燥方法, 先將制品放置于–80 ℃超低溫保存冰箱預凍2 ~ 3 h, 使制品呈固狀, 擴大表面積. 從冰箱中取出制品迅速置于真空冷凍干燥機的外掛瓶中, 等待真空度降至0.12 mbar以下, 冷阱溫度低于–45 ℃為佳. 在此條件下冷凍干燥約48 h, 得到慢病毒載體凍干制劑.
1.2.4 慢病毒載體凍干制劑預處方可行性研究
考察對慢病毒載體凍干制劑預處方的研究, 探索慢病毒載體凍干制劑制備的可行性. 通過設置對照組為HBSS, 實驗組為預處方, 具體的凍干保護劑預處方各組分及其配方比如下: 1.0%甘油、20 mg/mL蔗糖、25 mg/mL甘露醇、1 mg/mL L?精氨酸、2 mg/mL甘氨酸、2% PEG6000、1.5%明膠, 加入磷酸鹽緩沖溶液(PBS)中, 待保護劑充分溶解后, 用1 mol/L PB調節凍干保護劑預處方溶液的pH值至7.4.
1.2.5 慢病毒載體凍干保護劑處方的篩選
通過對慢病毒載體凍干保護劑5組處方的篩選, 從菌種凍干、脂質體凍干、蛋白質凍干(包括減毒活疫苗類)、其他病毒類凍干(腺病毒等)選定了5組基本的凍干保護劑處方, Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ組分別通過QPCR的方法檢測得到生物滴度[15?21].
初選5組處方, 各組處方組成如表1所示, 其中I組為對照組, 不加任何凍干保護劑作為陰性對照. 按照上述各組凍干保護劑分組的配方比要求, 加入磷酸鹽緩沖溶液(PBS)中, 待保護劑充分溶解后, 用孔徑為0.22 μm的濾膜過濾除菌.
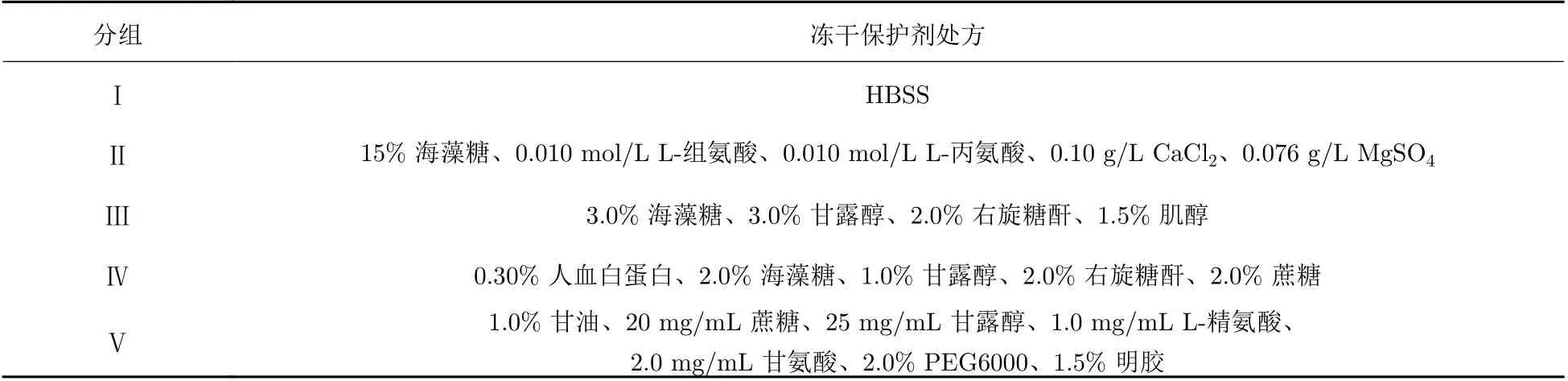
表 1 不同凍干保護劑的效果Tab. 1 Effects of different lyophilized protectants
1.2.6 慢病毒載體凍干保護劑處方的優化及用量的確定
以慢病毒載體的QPCR滴度回收率為考察指標, 以海藻糖用量及L?丙氨酸用量、L?組氨酸用量、CaCl2用量和MgSO4用量5個因素為考察因素, 用來確定凍干保護劑處方中有效成分的最佳用量, 采用正交實驗(DOE)的方法對慢病毒載體凍干保護劑處方(Ⅱ組)進行優化, 實驗因素如表2所示, 正交實驗設計如表3所示(實驗過程中用量為配制50 mL凍干保護劑溶液體系所需要的量).
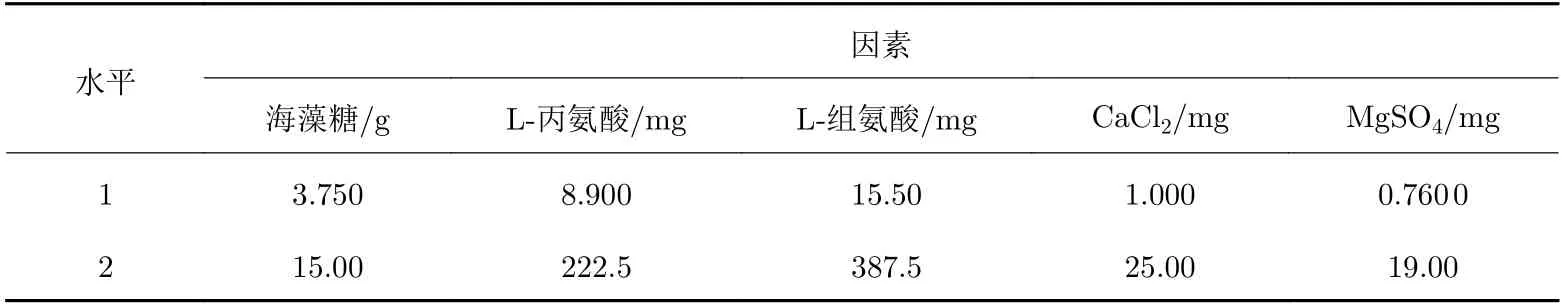
表 2 正交實驗因素水平Tab. 2 Factor level of orthogonal experiment
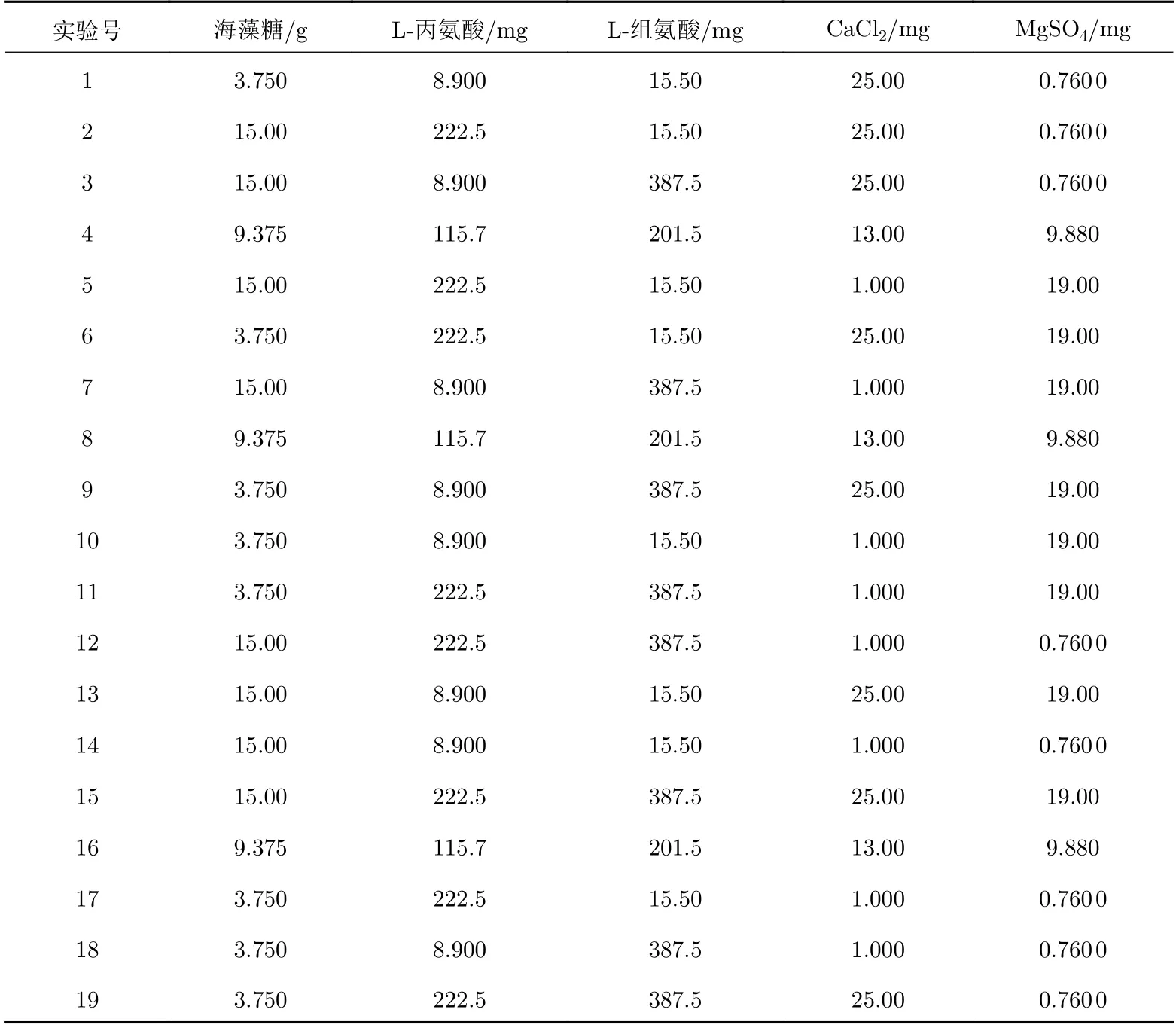
表 3 正交實驗設計表Tab. 3 Orthogonal experimental design table
1.2.7 慢病毒載體生物滴度的檢測方法
用實時熒光定量核酸擴增檢測系統(QPCR)方法進行慢病毒生物滴度測定[13,22]: 在24孔板上每孔加入293 T細胞懸液400 μL, 細胞密度為1.0 × 105個/mL. 以慢病毒載體濃縮液的滴度值為參照,10倍稀釋樣品. 取慢病毒載體凍干制劑加入500 μL細菌內毒素檢查用水復溶, 待溶解完全后加入完全培養基進行10倍稀釋, 輕柔吹打均勻后分別取100 μL、50 μL、25 μL慢病毒載體稀釋液至3個復孔中. 將孔板放置于37 ℃、5% CO2濃度的恒溫培養箱內培養24 h. 取出感染后的細胞進行細胞換液,繼續培養48 h后檢測. 將24孔板每個孔中的培養上清棄去, 加入800 μL PBS吹打細胞, 將細胞從孔板中取下, 置于1.5 mL 離心管中, 3 000 r/min離心5 min后, 棄去上清收集沉淀. 使用試劑盒提取細胞基因組DNA. 配制實時定量QPCR反應體系, 設置QPCR擴增程序為兩步法, 預變性95 ℃、15 s;然后進行變性95 ℃、15 s, 退火延伸60 ℃、36 s的40個循環.
用流式細胞術(FACS)方法進行慢病毒生物滴度測定: 細胞培養過程同上述方法, 但在加入慢病毒載體時, 輕柔吹打均勻后分別取100 μL、50 μL、25 μL、12.5 μL慢病毒載體稀釋液至4個復孔中.將孔板放置培養箱內培養24 h. 第二天細胞補液, 繼續培養24 h. 后續操作同QPCR方法, 至檢測前棄去上清收集沉淀, 加入protein L抗體進行避光孵育45 min. 待孵育結束, 加入PBS洗滌兩遍后, 使用流式細胞儀檢測.
1.2.8 慢病毒載體凍干制劑殘余水分含量測定
通過卡爾費休水分測定法, 檢測慢病毒載體凍干制劑中的殘余水分含量. 由于慢病毒載體凍干粉末吸濕性強, 按照《中國藥品檢驗標準操作規范(2010年版)》卡爾費休水分測定法測定凍干慢病毒載體含水量[23].
1.2.9 慢病毒載體凍干制劑影響因素穩定性考察
考察了儲存溫度對慢病毒載體凍干制劑穩定性的影響. 分別取適量慢病毒載體凍干制劑, 置于–20 ℃、23 ℃、4 ℃的3個不同儲存溫度條件下, 于第1、3、5、7、14、21、30天考察慢病毒載體凍干制劑的外觀、色澤、復溶性(再分散時間)和生物滴度.
1.2.10 慢病毒載體凍干制劑高溫加速實驗
為了研究慢病毒載體凍干制劑與現有工藝(液體制劑–80 ℃保存)的質量比較, 我們選擇了高溫加速實驗, 根據《中國藥典(2015年版)》“穩定性實驗指導原則”, 選擇了一個高溫加速實驗溫度(42 ℃),另一個選擇了上述指導原則規定的低溫保存生物制品的加速實驗溫度(4 ℃), 具體穩定性研究方案如下[24].
分別將慢病毒載體凍干制劑置于42 ℃和4 ℃的溫度條件下, 貯藏1 ~ 30 d, 比較其生物滴度的變化. 于第1、3、5、7、14、21、30天考察慢病毒載體凍干制劑的外觀、色澤、復溶性(再分散時間)和生物滴度. 并以4 ℃溫度條件下的慢病毒載體凍干制劑做對比.
1.2.11 慢病毒載體凍干制劑反復凍融實驗
將慢病毒載體凍干制劑與現有的凍存制劑進行對比, 考察反復凍融對不同制劑的影響. 反復凍融即反復冷凍–解凍循環, 將慢病毒凍干制劑與慢病毒凍存制品均置于–80 ℃超低溫冰箱保存, 每隔一段時間置于室溫條件下融化考察慢病毒載體凍干制劑的外觀、色澤、復溶性(再分散時間)和生物滴度. 共反復凍融6次.
1.2.12 數據分析方法
使用Minitab 19軟件對正交實驗數據進行統計學分析與處理, 通過方差分析考察各個因素的主效應及交互作用以及正態概率, 擬合回歸模型, 對實驗結果進行多響應預測.
使用GraphPad Prism軟件以及Adobe Illustrator軟件進行圖表統計與分析.
2 結果與討論
2.1 慢病毒載體凍干制劑制備可行性研究
2.1.1 理化性質評價
采用凍干保護劑預處方進行慢病毒載體凍干制劑可行性探究, 并制備得到外觀良好的慢病毒載體凍干制劑, 外觀、色澤度、復溶性(再分散時間)等理化性質指標如表4所示.

表 4 慢病毒凍干制劑的理化性質評價Tab. 4 Evaluation of physical and chemical properties of the freeze-drying preparation technique
2.1.2 生物滴度考察及回收率測定
使用流式細胞術(FACS)和實時熒光定量核酸擴增檢測系統(QPCR)的方法考察慢病毒載體的生物滴度, 實驗結果如圖1所示.
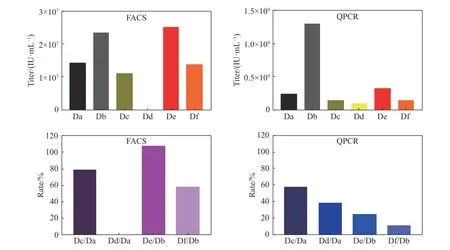
圖 1 慢病毒載體凍干前后滴度值與回收率Fig. 1 Titer value and recovery rate of lentiviral vector before and after freeze?drying
比較凍干保護劑與HBSS對于慢病毒載體在–80 ℃保存以及在凍干的過程中的影響, 同時對比凍存前后以及凍干前后對慢病毒滴度的影響. 其中Dd組最后沒有測到數據, 說明在凍干的過程中,HBSS沒有起到對慢病毒的保護作用, 導致慢病毒全部損失. 在凍干的過程中, 凍干保護劑確實能夠起到保護作用, 最終兩種檢測方法均測得滴度回收率. 通過這兩種檢測方法可以看出慢病毒載體凍干制劑制備的可行性, 即慢病毒載體可以通過真空冷凍干燥的方法進行制備得到慢病毒凍干粉.
2.2 慢病毒載體凍干保護劑處方的篩選
2.2.1 不同凍干保護劑對理化性質的影響
采用5組處方進行慢病毒載體凍干保護劑處方篩選, 以凍干產品的外觀、色澤和復溶性為指標綜合評價其理化性質, 考察了各種凍干保護劑對凍干產品的保護作用, 結果見表5.
2.2.2 不同凍干保護劑對滴度回收率的影響
篩選5組凍干保護劑處方的慢病毒載體滴度回收率結果如圖2所示.
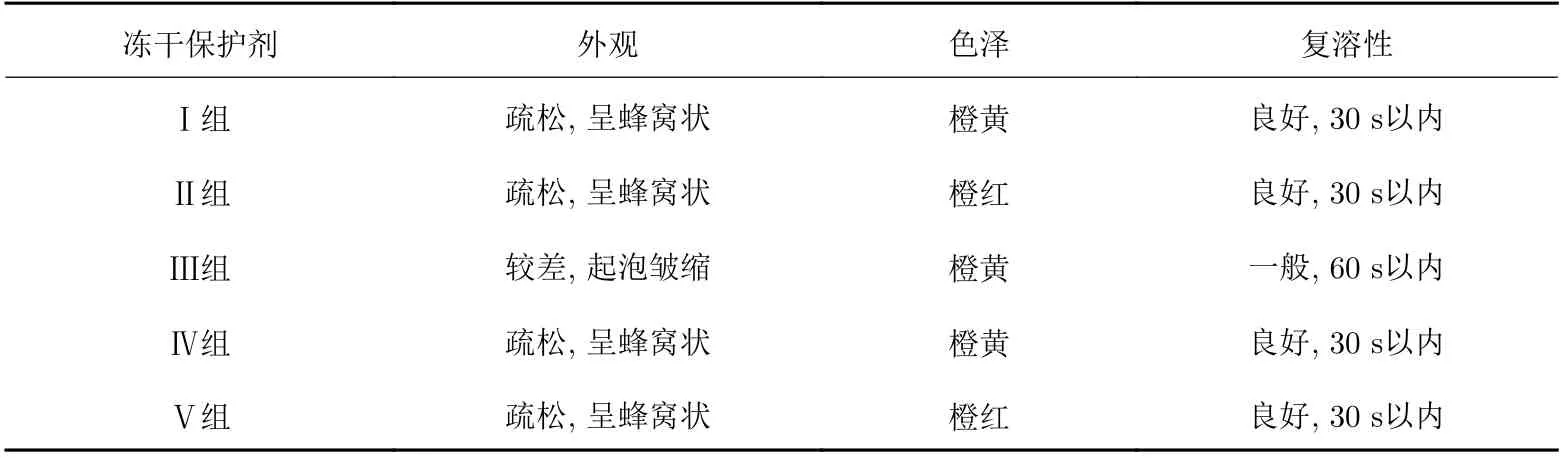
表 5 不同凍干保護劑的效果Tab. 5 Effects of different lyophilized protectants
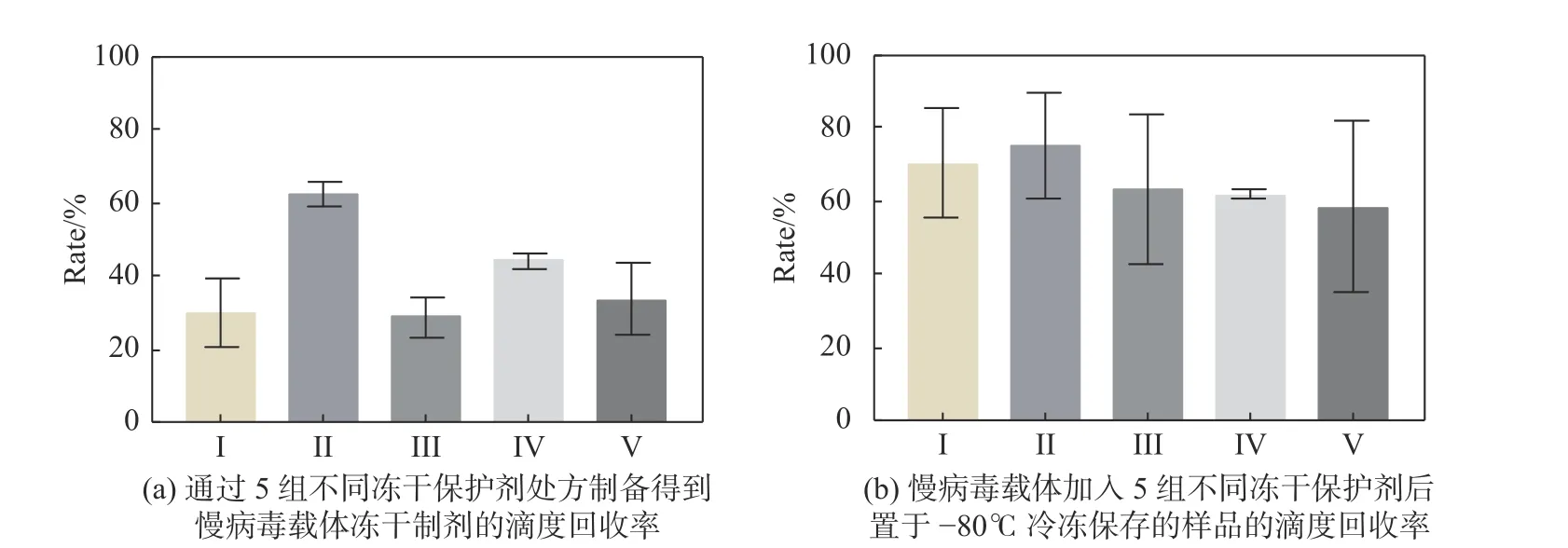
圖 2 慢病毒載體凍干制劑與凍存液滴度回收率Fig. 2 Recovery of the lyophilized lentiviral vector and cryopreservation titer
從圖2(a)中可以看出, Ⅱ組的凍干保護劑處方保護效果最佳, 加入Ⅱ組的凍干保護劑處方后制備得到的慢病毒載體凍干制劑, 感染細胞后通過QPCR的方法檢測得到的滴度值最高; 圖2(b)顯示,Ⅱ組慢病毒載體的滴度回收率最佳, 兩圖相符合, 無論在冷凍保存條件下還是在真空冷凍干燥后,Ⅱ組的凍干保護劑的效果均最好, 所以選擇II組保護劑進行優化并確定用量.
2.2.3 凍干保護劑的選擇
主要可分為以下幾類: 一般為多羥基化合物、糖類、氨基酸、蛋白質、聚合物和無機鹽等化合物[25?27].因為不但要具有保護生物制品活性的效果和結構不發生改變, 而且要具有凍干賦形作用. 糖是一種使用最廣泛的凍干保護劑, 本研究中采用的海藻糖屬于二糖, 比蔗糖具有更低的吸濕性和更高的玻璃態轉化溫度, 其羥基能替代水分子與蛋白質分子表面部分結合, 而且海藻糖分子較小, 能填充到蛋白質分子的空隙中, 有效地限制蛋白質分子內部的結構發生變化, 在凍干時可以對慢病毒的蛋白衣殼形成保護, 因此凍干制劑保護效果更好[28?29]. 氨基酸具有酸性羧基和堿性氨基, 能夠調節制品溶劑環境的pH值, 不同類別的氨基酸具有不同的親水性功能, 而親水性強的氨基酸較易與蛋白質產生氫鍵, 這對蛋白質在凍干的過程中的穩定性和活性具有重要的保護作用, 如組氨酸、丙氨酸等, 可以增加慢病毒載體包膜蛋白和組氨酸磷酸鹽緩沖液間的張力, 提高慢病毒載體包膜蛋白水化水平. 而加入二價陽離子類, 如CaCl2和MgSO4這兩種無機鹽, 可延遲海藻糖結晶, 通過和磷酸根陰離子存在下氫鍵網絡以及分子遷移率的變化抑制結晶.
2.3 慢病毒載體凍干保護劑處方的優化并確定用量
2.3.1 正交實驗結果表
將通過QPCR的方法檢測生物滴度的結果作為正交實驗的響應值, 正交實驗結果表如表6所示.
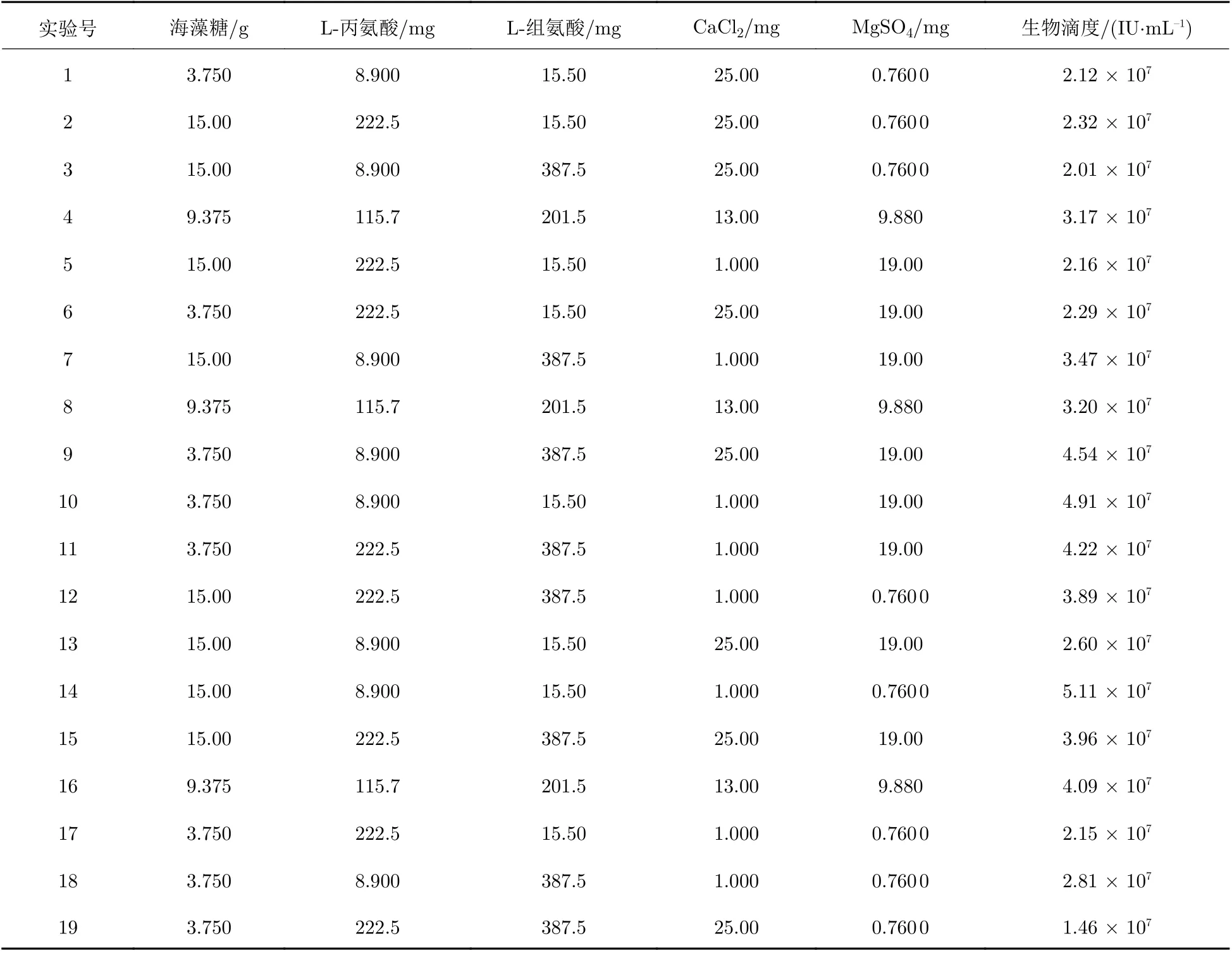
表 6 正交實驗結果表Tab. 6 Results of orthogonal experiment
2.3.2 方差分析表
結果詳見表7.
2.3.3 回歸擬合模型
結果詳見表8.
2.3.4 正交實驗優化
結果詳見圖3.
由以上的方差分析結果及圖3(a)–(c)圖, 可以看出, 該組處方中所有的組分均具有顯著效應(P<0.05), 從側面印證了該組凍干保護劑處方的有效性. 從圖3(a)中可以看出, 除L?丙氨酸和CaCl2以外, 其余組分因子均表現出正效應較強; 從圖3(b)中可以發現生物滴度的結果正態概率分布良好, 觀測值順序與運行順序無關; 從圖3(c)中明顯看出高于2.57標準線的因子項, 表現出顯著效應;從圖3(d)中可以看出處方中的相關組分之間均存在交互作用, 海藻糖與處方中其余組分間的交互作用較強. 圖3(e)和圖3(f)兩圖顯示正態概率分布良好, 滿足實驗要求. 圖3(g)顯示凍干保護劑處方各組分含量的最優的范圍; 圖3(h)通過響應器優化, 得出凍干保護劑處方用量最優的一組解.
2.3.5 多響應預測結果
結果如表9所示.
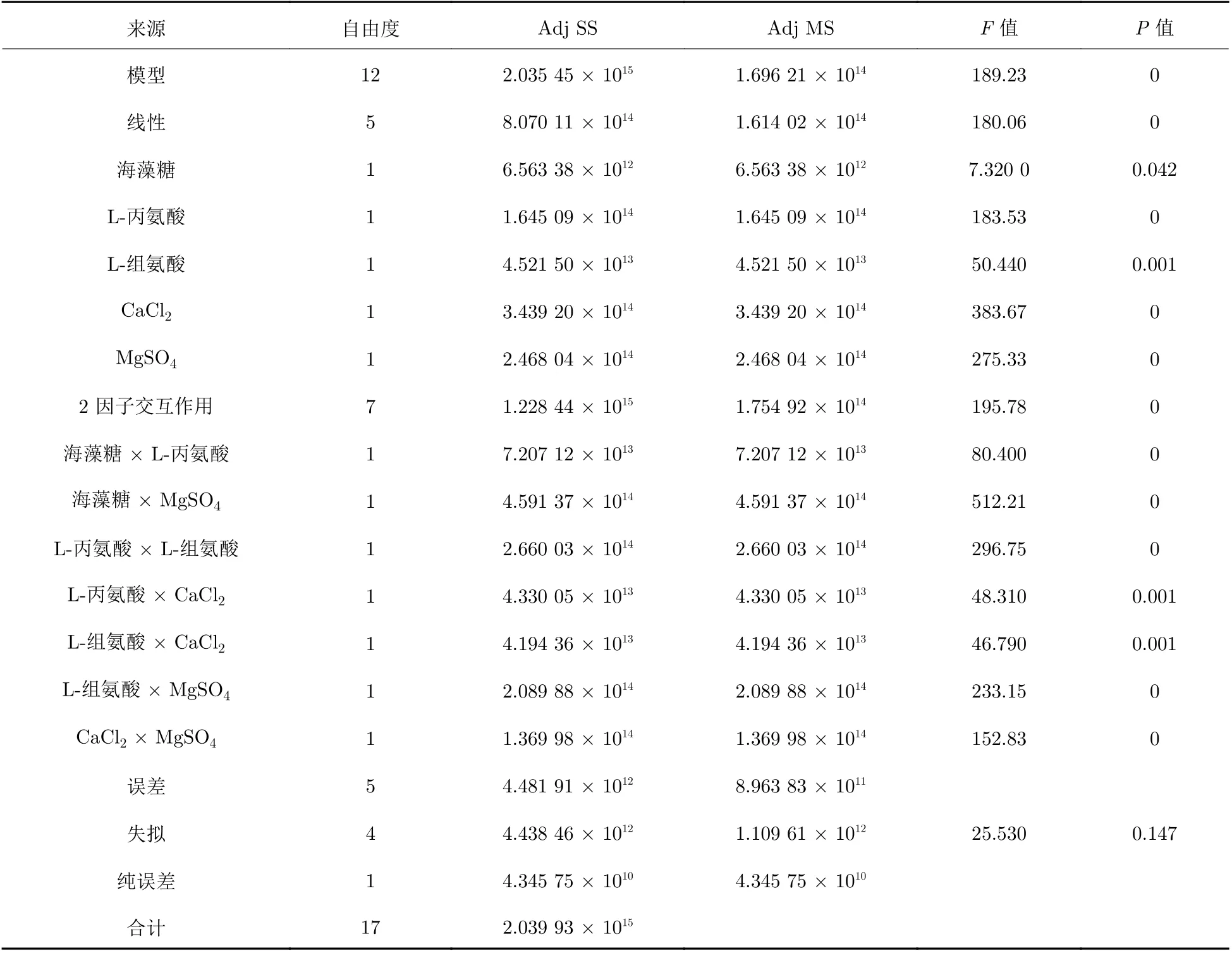
表 7 正交實驗方差分析表Tab. 7 Analysis of variance of orthogonal experiment

表 8 回歸擬合模型匯總表Tab. 8 Summary table of regression fitting model
根據多響應預測結果, 確定最優的凍干保護劑處方為15 g海藻糖、8.9 mg L?丙氨酸、15.5 mg L?組氨酸、1.0 mg CaCl2、0.76 mg MgSO4. 并根據這一處方要求的用量進行了處方驗證實驗, 驗證實驗結果表明, 在這一組凍干保護劑處方的條件下, 慢病毒載體的生物滴度可高達9.37 × 107IU/mL, 滴度回收率為50.15%. 凍干效果良好.
2.4 慢病毒載體凍干制劑殘余水分含量的測定
通過慢病毒載體凍干保護劑處方的篩選與優化, 確定了最優的一組凍干保護劑處方, 并通過3次驗證確定了該處方對于慢病毒載體凍干的過程中保護效果. 使用驗證過程中制備的慢病毒載體凍干制劑, 檢測殘余水分含量, 水分含量為(7 ± 0.05)%. 該結果滿足要求, 表明在此含水量條件下慢病毒載體凍干制劑最為穩定. 凍干后水分含量直接影響了慢病毒載體的狀態和穩定性, 維持較低的水分含量, 病毒才能維持休眠狀態, 但水分含量低于0.5%時可能會引起凍干的過程中DNA鏈的斷裂導致病毒的活性降低甚至死亡.

圖 3 正交實驗結果分析圖Fig. 3 Analysis diagram of orthogonal experiment results
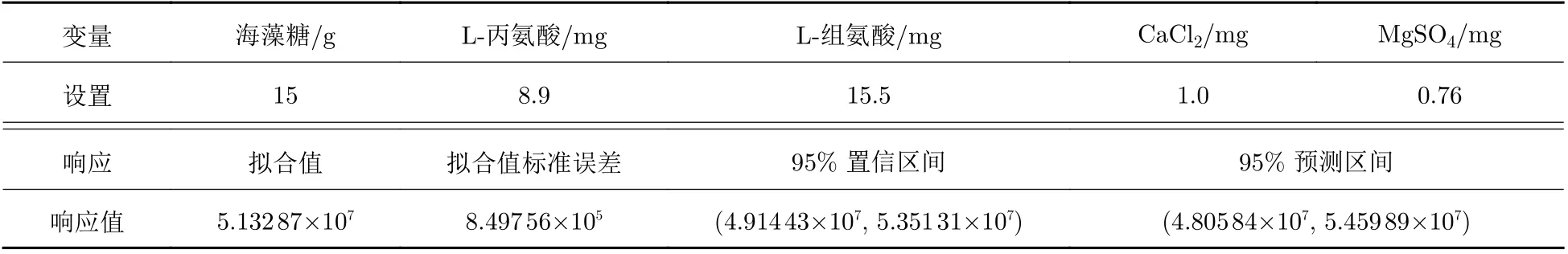
表 9 多響應預測結果Tab. 9 Results of multiple response prediction
主要考察慢病毒凍干制劑的外觀、色澤、復溶性以及生物活性. 其中外觀是凍干制品的重要質量屬性之一, 合格的凍干制品外觀應是疏松多孔、色澤均勻、質地細膩的粉末狀固體. 同時考察凍干制劑的穩定性. 慢病毒載體的初步穩定性主要考察 –20 ℃(相對濕度75%)、23 ℃(相對濕度75%)、2 ~ 8 ℃長期保存條件以及42 ℃高溫加速實驗.
2.5.1 影響因素穩定性研究
2.5.1.1 高溫加速實驗對慢病毒凍干制劑穩定性的影響
采用最優的凍干保護劑處方制備得到外觀良好的慢病毒載體凍干制劑, 進行凍干制劑穩定性研究, 考察外觀、色澤度、復溶性(再分散時間)等理化性質指標. 不同溫度對于慢病毒載體凍干制劑的儲存影響不大, 觀察4 ℃、–20 ℃以及23 ℃條件下的慢病毒載體凍干制劑, 可以看出隨著保存時間的延長, 外觀與色澤度均未發生明顯改變, 疏松并呈蜂窩狀, 橙紅色, 加水復溶后狀態良好, 考察再分散時間均在30 s以內. 但是高溫保存慢病毒載體凍干制劑, 外觀與色澤度較差, 結果如表10所示.
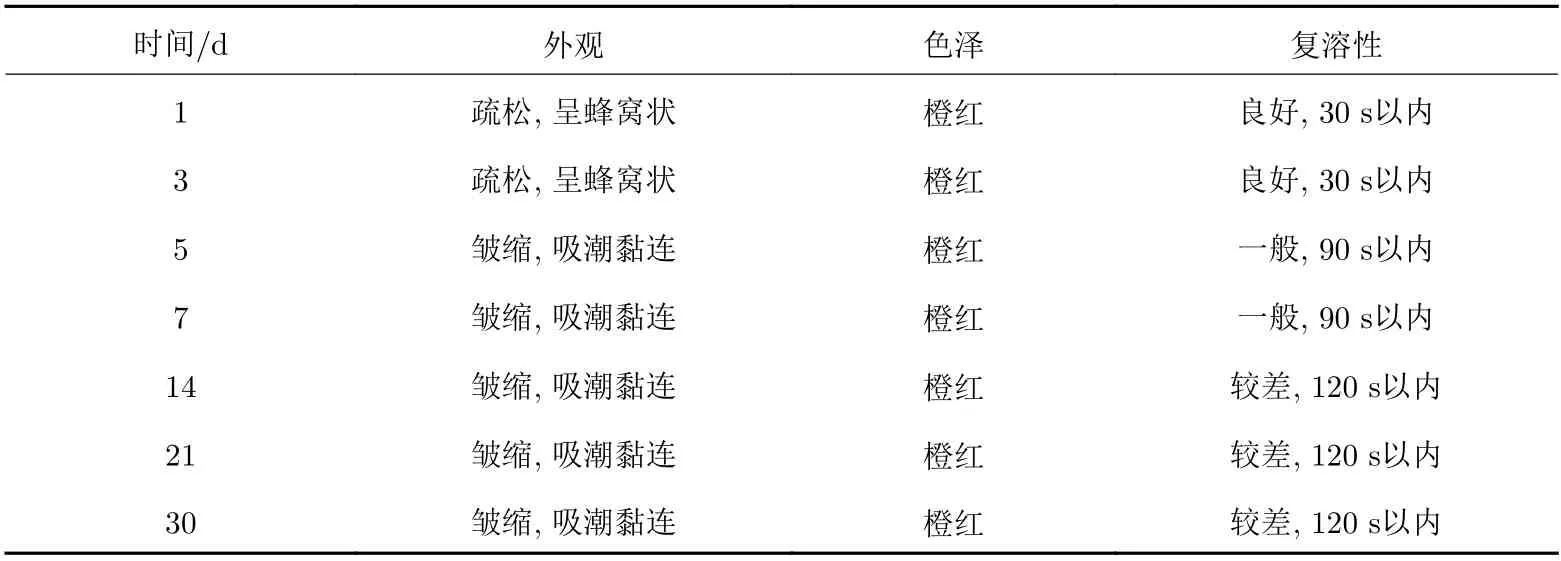
表 10 高溫加速實驗(42 ℃)條件下慢病毒凍干制劑的保存效果Tab. 10 Preservation effects of freeze-drying preparations at 42 ℃
2.5.1.2 不同溫度對慢病毒凍干制劑穩定性的影響
使用QPCR檢測慢病毒載體凍干制劑和凍存制品的生物滴度(IU/mL), 對生物滴度值取lg對數函數, 以lgT對時間t做圖, 結果可參見圖4.
由圖4可以看出, 不同溫度對于慢病毒載體凍干制劑和凍存樣品均有顯著的影響. 圖4(a)為4 ℃冷藏保存后慢病毒載體滴度結果, 由圖中的結果可以看出慢病毒載體凍干制劑有更好的保存效果, 隨著時間的增加, 滴度雖有下降但比較穩定, 冷凍干燥前的樣品置于4 ℃冷藏保存后滴度下降明顯; 從圖4(b)可以看出, 在–20 ℃條件下保存, 無論是慢病毒載體凍干還是凍存樣品, 均比較穩定; 從圖4(c)中發現, 室溫條件對于慢病毒載體凍干制劑的保存效果更好; 圖4(d)為高溫加速穩定性的結果, 高溫高濕的條件對于慢病毒凍干制劑和凍存制劑都產生了嚴重的不穩定的影響, 對于慢病毒本身產生了極大的負面效應.
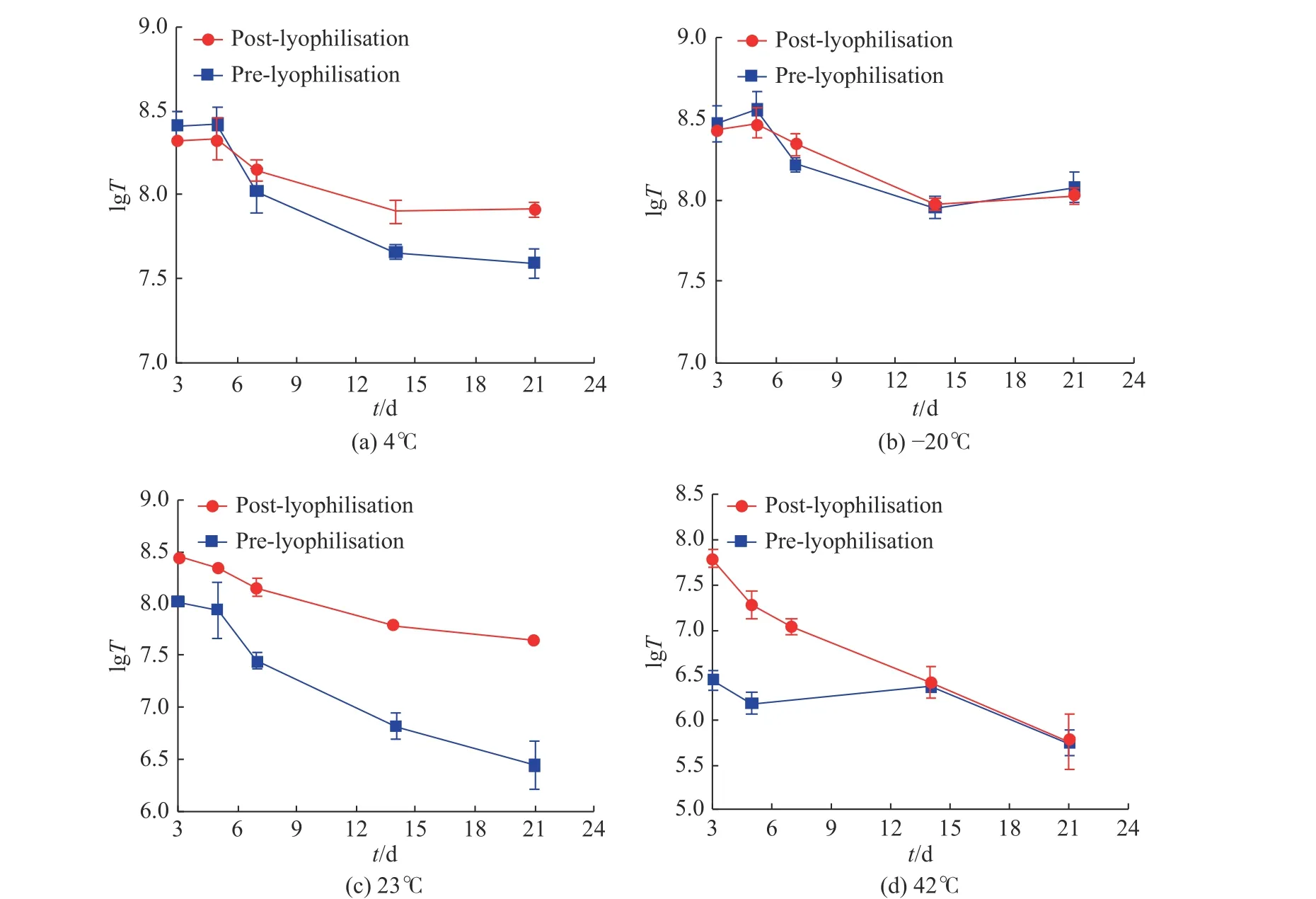
圖 4 不同溫度條件下滴度對數值結果Fig. 4 Titer log results at different temperatures
結果表明, 慢病毒載體在冷凍干燥以后可以實現較長時間的保存, 但是生物滴度值會下降, 說明在儲存時也會緩慢失活, 不同溫度下的降解速度大小為23 ℃ > 4 ℃ > –20 ℃. 但是在4 ℃保存的條件下慢病毒載體凍干制劑能更穩定, 凸顯了其儲存優勢.
2.5.2 反復凍融穩定性研究
2.5.2.1 反復凍融對慢病毒凍干制劑理化性質的影響
采用最優的凍干保護劑處方制備得到外觀良好的慢病毒載體凍干制劑, 進行凍干制劑穩定性研究, 考察外觀、色澤度、復溶性(再分散時間)等理化性質指標如表11所示.
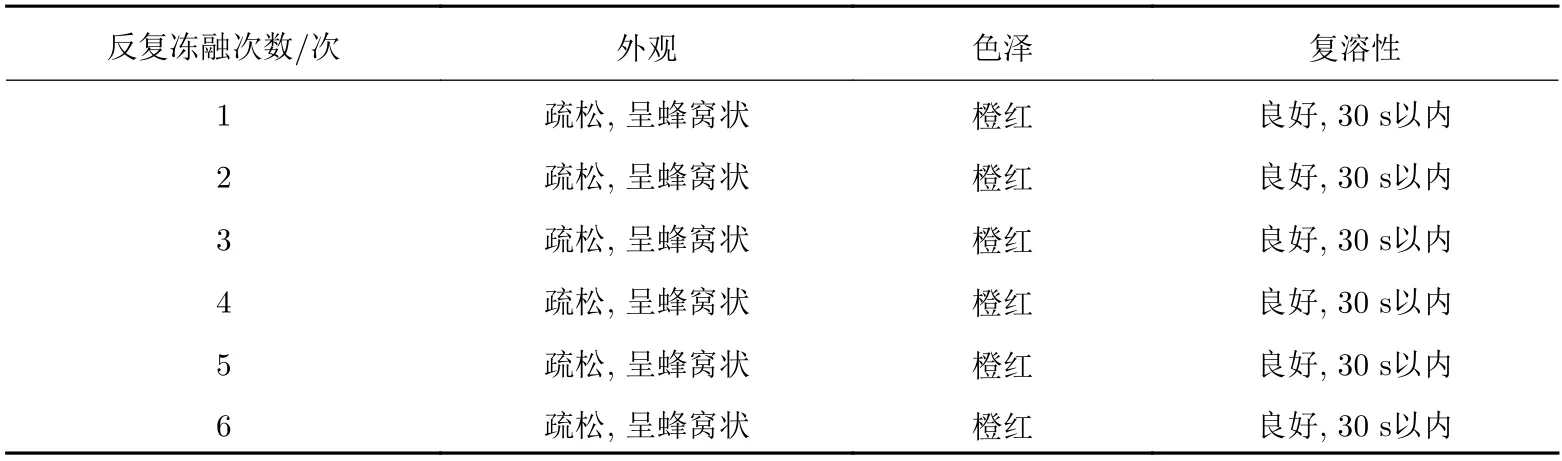
表 11 反復凍融對慢病毒凍干制劑保存效果的影響Tab. 11 Effects of repeated freeze-thaw cycles on the preservation of freeze-drying preparations
2.5.2.2 反復凍融對慢病毒凍干制劑生物滴度的影響
使用QPCR檢測慢病毒載體凍干制劑和凍存制品的生物滴度(IU/mL), 結果可參見圖5.
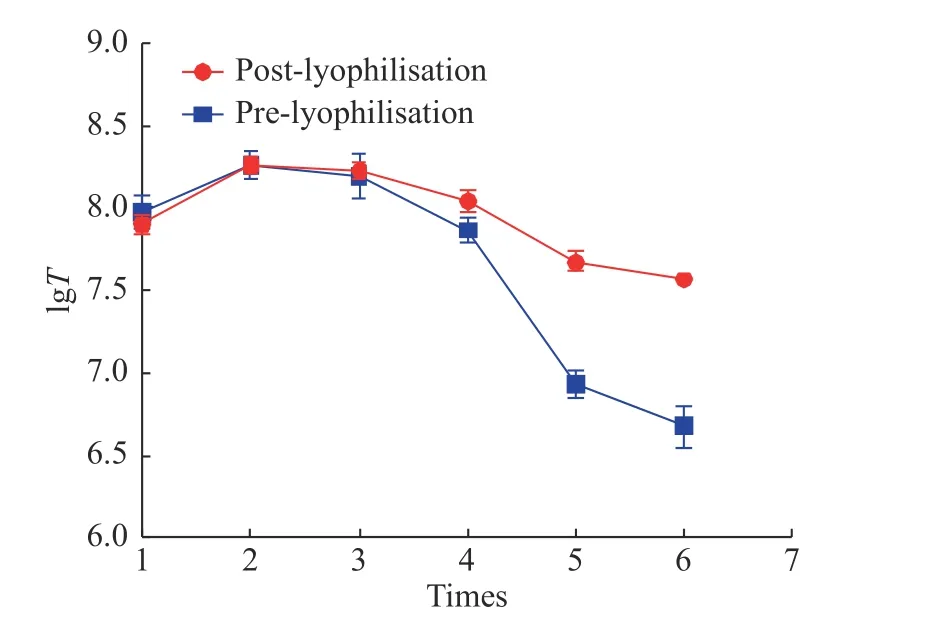
圖 5 反復凍融對于慢病毒滴度的影響Fig. 5 Effects of repeated freezing?thawing cycles on the titer of lentiviral vectors
從圖5可以看出反復凍融對于慢病毒載體凍干制劑的影響并不明顯, 隨著反復凍融次數的增加,慢病毒滴度能維持穩定, 然而對于慢病毒載體凍存制劑而言, 反復凍融的影響顯著, 尤其在第5次反復凍融時, 慢病毒活性顯著降低, 表明慢病毒凍干制劑在反復凍融的條件下更加穩定, 可以實現反復凍融5–6次, 克服了液體制劑反復凍融帶來的損失等問題.
3 結 論
本文給出了一種新型的慢病毒載體凍干制劑的制備方法. 通過研究凍干保護劑的組分篩選與優化、凍干產品的制劑學研究和穩定性研究, 表明真空冷凍干燥的方法對于慢病毒載體的儲存帶來了新的突破. 在最優凍干保護劑處方的條件下, 慢病毒載體凍干制劑能夠實現儲存時間長、運輸過程簡便、穩定性提高的優點, 為CAR?T細胞的大批量制備夯實了基礎, 為CAR?T細胞免疫治療的進一步推廣提供了技術基礎.

