羅丹明類熒光探針進行小分子信標物標記的研究進展*
成 昭,雷淑林,楊麗平
[1.西安醫學院 藥學院,陜西 西安 710021;2.西京醫院(空軍軍醫大學第一附屬醫院) 體檢中心,陜西 西安 710032]
自然界中的熒光現象與生物傳感普遍存在,生命體內源性熒光是進行分子熒光標記研究的基礎。繼20世紀50年代生命體內源性熒光分子被陸續發現以來,物理學、化學、生物學等各學科研究人員通過對生命體自發熒光與生物傳感現象進行借鑒、模仿,完成了分子標記、生物化學傳感器等領域的許多研究工作。在分子標記領域中,小分子熒光探針的出現,相比傳統檢測方法如同位素標記、原子吸收等,極大地提升了標記工作的特異性、響應性及實時成像性,得到迅速發展。其中,羅丹明類熒光探針在小分子信標物的熒光標記研究中表現良好、應用前景廣泛。
1 小分子信標物的熒光探針標記法
1.1 生物自發熒光與模擬生物傳感
1957年,Teale與Weber[1]發現一些含芳環的氨基酸,如色氨酸(tryptophan,Trp)、酪氨酸(tyrosine,Tyr)及苯丙氨酸(phenylalanine,Phe),能夠被特定波長的光激發,從而發射特征熒光信號。其中,Trp熒光性最強、對環境反應敏感,現常以Trp作為內源性熒光探針,研究蛋白質結構、構象及功能等。其他的內源性熒光分子還包括黃素腺嘌呤二核苷酸(flavin adenine dinucleotide,FAD)、黃素單核苷酸(flavin mononucleotide,FMN)、還原性煙酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH),以及負有盛名的熒光蛋白。自1962年Shimomura[2]首次發現維多利亞多管發光水母中的綠色熒光蛋白(green fluorescent protein,GFP)以來,其相關研究發展迅速,熒光蛋白成像現已作為一種臨床檢測手段、被廣泛應用于腫瘤成像中。
分子標記[3]、生物化學傳感器[4]領域的相關研究工作,在一定程度上借鑒和模仿了生命體自發熒光與生物傳感現象。通過識別體系構筑與熒光信號輸出,將發生于分子水平的探針-待標記物識別過程進行可視化呈現,使活體細胞環境的生物化學過程示蹤與小分子信標物標記研究成為可能。
1.2 化學標記技術的發展
聚焦于某種小分子信標物、進行高選擇性檢測,需要根據目標物特性進行探針的靶向設計[5],使得探針可與目標物發生特異性識別,并可通過一定的檢測技術探知這種識別作用或過程。區別于一般的檢測手段,熒光探針在識別體系構筑與熒光信號輸出方面具有諸多優勢,可基于電子轉移、化學反應或分子間弱作用進行靶向識別體系設計,還可基于光信號、磁信號、電化學信號及質量敏感信號等物理學手段輸出目標物標記信息,能夠滿足實際工作中的分析檢測要求。
化學標記是一種可應用于生物分析和化學分析的重要方法,根據標記手段和檢測技術的差別,探針被分為放射標記探針和非放射標記探針,而其中最為人們所熟悉的2種探針形式是放射同位素標記探針與熒光標記探針。放射標記探針使用放射性同位素進行目標物的標記,應用較早,但受限于檢測技術,商品化困難。非放射標記以熒光標記最為常見,常借助于在紫外-可見光區或紅外光區[8]表現光吸收與熒光性質的熒光染料分子實現標記,再輔助以各類顯微成像與熒光檢測技術,如紫外-可見光譜、熒光光譜、熒光顯微鏡、激光共聚焦熒光顯微鏡等,以實現分子水平[9-10]、細胞水平的目標物熒光標記檢測。在現階段對生命體中小分子信標物的標記研究中,熒光探針標記技術發展迅速,無論熒光檢測儀器發展或熒光探針結構構筑、新型熒光發色團合成,均取得較大進展。
2 熒光探針結構設計與羅丹明類熒光發色團
2.1 熒光探針結構設計
熒光探針設計主要基于3種結構類型,鍵合-信號輸出型、置換型、化學計量型(見圖1),也存在一定數量的反應型探針,通過化學反應、實現置換或化學計量,進而完成目標物的識別與檢測。
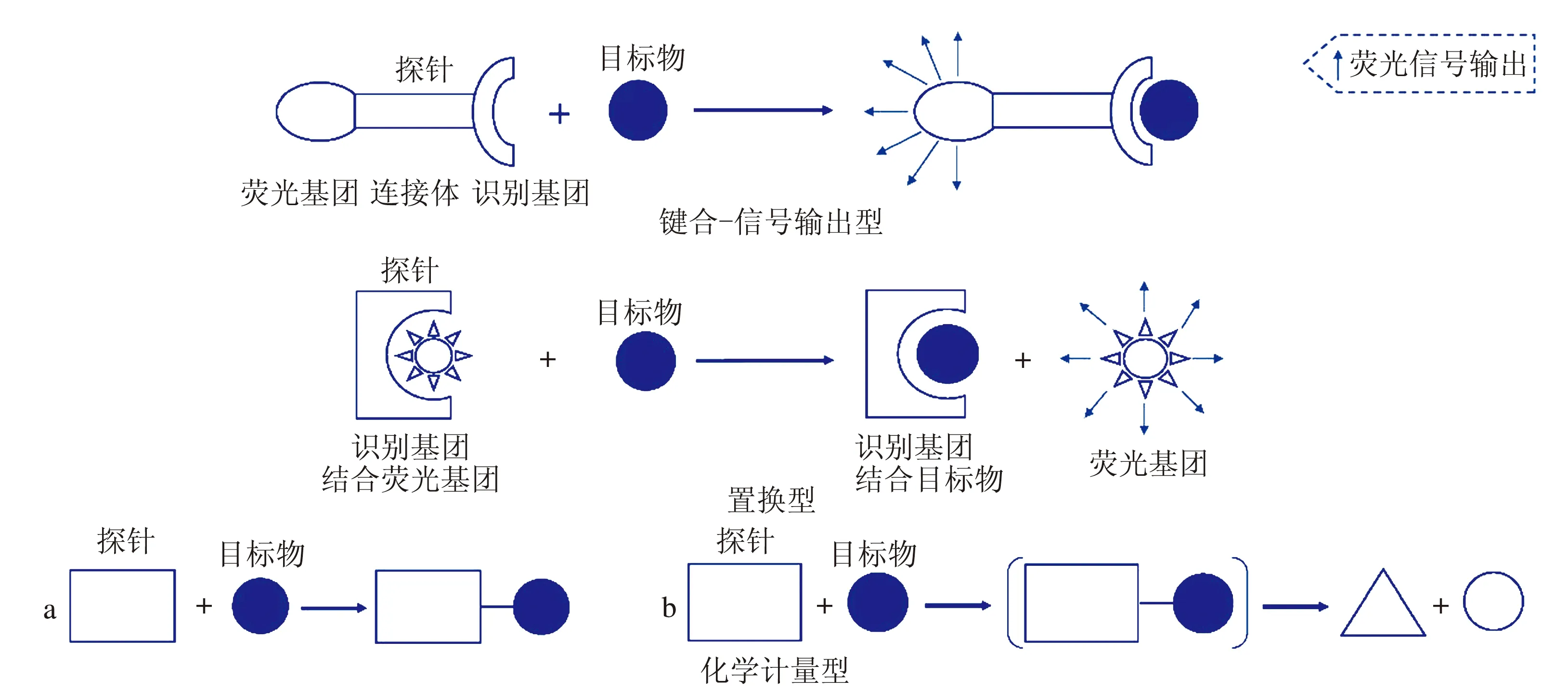
圖1 熒光探針結構設計的主要類型
2.1.1 鍵合-信號輸出型熒光探針
鍵合-信號輸出型熒光探針是應用最為廣泛的探針類型,其結構特點是通過連接體,以共價鍵連接探針結構中的熒光基團與識別基團。識別基團結合目標物后,因分子結構的改變,使熒光基團的光學信號輸出發生顯著變化,進而實現檢測。
2.1.2 置換型熒光探針
置換型熒光探針,基于識別基團對熒光基團、目標物的結合強度差別進行結構設計,一般情況下,識別基團與目標物結合能力較強,識別基團與熒光基團結合能力相對較弱,使得原本連接在識別基團上的熒光基團可被目標物置換,發生熒光信號輸出的改變,實現檢測。
2.1.3 化學計量型熒光探針
化學計量型熒光探針利用探針分子與目標物之間的特征反應或相互作用,通過探針對目標物識別作用前后、體系熒光信號的差別(如熒光激發/發射波長位移、熒光強度強弱等),實現目標物檢測。近年來,化學計量型熒光探針因其在目標物檢測中良好的定量效果以及對目標物的特異性識別作用得到關注。針對不同目標分子檢測的化學計量型熒光探針被不斷合成得到,但基于探針與目標物之間的特征反應或相互作用進行目標物檢測,探針與目標物兩者之間的結合能力往往較強、或不可逆地發生兩者間的結合作用,應用于生命體中目標物檢測時,化學計量型熒光探針具有一定局限性,對于動態變化的目標物、檢測程度有限。
2.2 羅丹明類熒光發色團
羅丹明是一種基于吡喃型氧雜蒽母體的堿性咕噸染料,因其結構中的長共軛鏈與剛性平面結構,而表現良好熒光性能[11]。其特性之一在于羅丹明是一種長波激發與發射的熒光發色團,合成之初作為染料被用于織物染色。羅丹明及其衍生物的最大熒光激發與發射波長多處于可見光區,呈現強烈熒光、光學性質穩定,進行光學性能分析時背景熒光干擾較少;另一特性在于羅丹明結構的可修飾性強、衍生物種類眾多,均基于氧雜蒽環母體、進行官能團修飾得到。氧雜蒽環母體的取代基對其光吸收及發射特性具有強烈影響,羅丹明衍生物因此具有不同的光學表現,滿足各類目標物的熒光標記與檢測需求,常見于羅丹明6G[12]、羅丹明B[13]、羅丹明123[14]、羅丹明800[15-16]、羅丹明101[17]、德克薩斯紅[18-19]等(見圖2)。
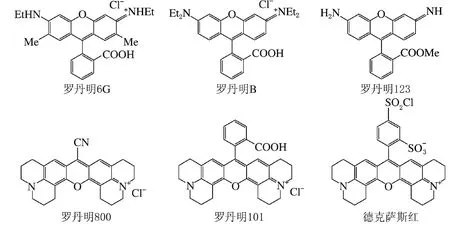
圖2 代表性的羅丹明衍生物
優化合成路線、改善水溶性、提高對目標物的鍵合能力,是進行羅丹明改性修飾及開發多種羅丹明衍生物的主要目的,從而使羅丹明衍生物能夠適用于化學、生物學、醫學等多學科領域與實際工作不同需求的熒光標記研究。例如,羅丹明6G、羅丹明123及羅丹明B是應用廣泛的熒光探針,羅丹明101常用于酶活性研究,羅丹明800和德克薩斯紅多用于生物染色分析。Horneffer等[19]還將德克薩斯紅用于基質輔助激光解吸/電離(matrix-assisted laser desorption/ionization,MALDI)蛋白質的熒光標記與定位,借助于德克薩斯紅熒光信號對pH相對穩定的特性,克服酸性檢測環境可能引發的熒光猝滅等實驗干擾。
2.3 基于長波激發/發射的羅丹明結構修飾
短波激發/發射的熒光探針,分子結構相對簡單,應用于生命體小分子信標物測定時,因其低分子量而呈現較好的膜通透性,但無法避免細胞中蛋白質、核酸等大分子的自身熒光發射和細胞的光散射干擾,影響測定結果的準確性。為了移除紫外光激發探針在實際測定時的背景干擾,可見光激發及近紅外光激發等長波激發探針發展迅速。
其中,最大吸收與發射波長均處在650~900 nm的熒光探針,在生命體小分子信標物的動態熒光成像中具有重要意義。650~900 nm可見光及近紅外光透過皮膚和組織時,僅引發微量細胞自發熒光,同時,近紅外區熒光信號散射性極低,因上述兩點造成的測定偏差幾乎可被忽略,所以近紅外區熒光探針分子具有良好應用前景[20],吸收/發射波長處于近紅外光區的羅丹明類探針近年來發展迅速,對羅丹明結構中的氧雜蒽進行修飾,已獲得一系列近紅外羅丹明類探針,探針分子1、2、3見圖3。
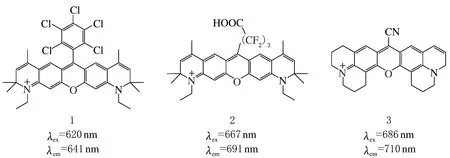
圖3 長波激發/發射的羅丹明衍生物1、2、3
Lin課題組[21]報道了一類經過結構修飾、有效增大π共軛體系的長波激發/發射羅丹明探針4(見圖4),相比羅丹明B母核,探針4的最大發射波長增幅超過150 nm,各項熒光特性參數良好,具有較大的摩爾吸光系數和熒光量子產率。引入吲哚等吸電子雜環后,9-位苯環取代物仍具有目標物識別特性、表現與羅丹明螺環結構類似的開-關環轉換,具有很好的應用前景。
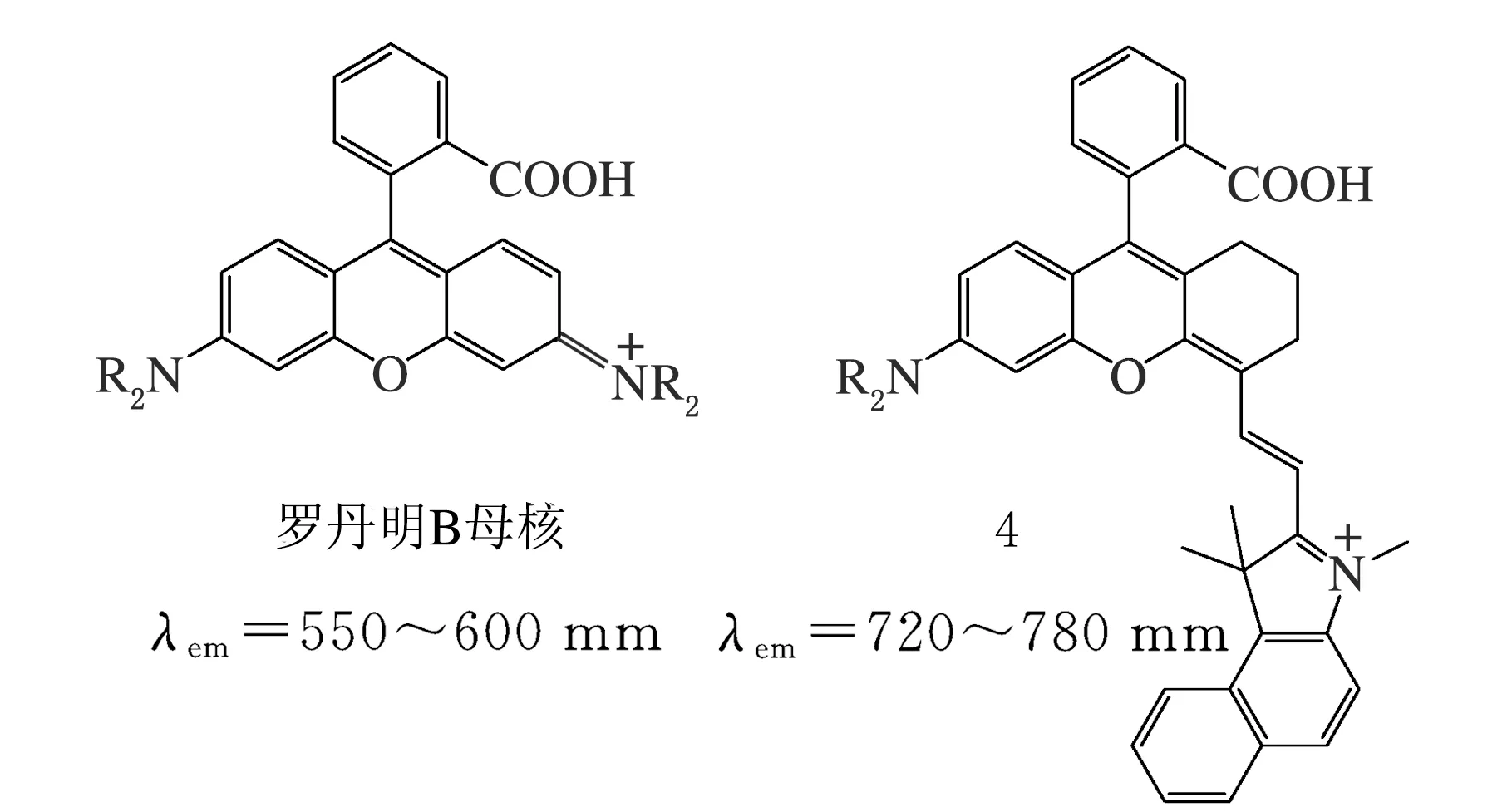
圖4 近紅外發射的羅丹明衍生物探針4
3 用于小分子信標物標記的羅丹明熒光探針
羅丹明及其衍生物作為開-關形式的熒光探針,具有熒光量子產率高、摩爾消光系數大、表現可見光區至近紅外光區長波激發/發射等特性。根據特定小分子信標物的結構特點,構筑羅丹明探針的識別體系,得到對目標物呈現特異性檢測的羅丹明熒光探針,相關研究及應用發展迅速。
3.1 用于金屬離子標記的羅丹明熒光探針
1997年,Czarnik等[22]首次利用羅丹明中螺環的開、關環機理設計了Cu2+熒光探針5(見圖5),之后相繼出現用于Hg2+、Zn2+、Ag+、Pt2+、Pd2+、Au3+、Cr3+等金屬離子信標物檢測的羅丹明類熒光探針,多基于羅丹明衍生物中螺環的開環、關環機理進行結構設計。
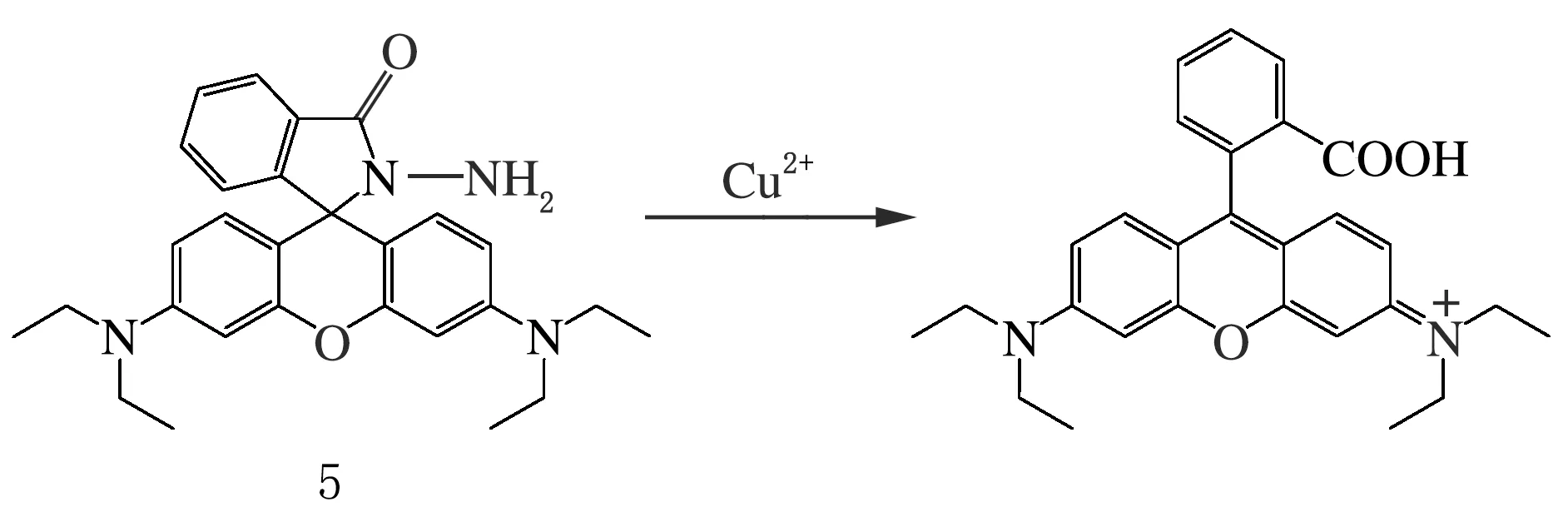
圖5 首個羅丹明Cu2+熒光探針5
3.1.1 Fe3+羅丹明熒光探針
Fe是人體中含量最高的過渡金屬。Fe在生命體中的存在形式既有Fe2+(ferrous)也有Fe3+(ferric),與生命體氧化-還原代謝水平密切相關。研究發現,隨著人年齡增長,腦部Fe含量存在尚不明確機制的積累[23-24],因此,進行人體內Fe的標記和追蹤對于其生理作用的進一步闡明具有重要意義。此外,Fe的熒光標記示蹤還需要區分Fe2+與Fe3+2種氧化態形式。多種羅丹明熒光探針對高氧化態Fe3+表現良好的識別性能。
相對于Fe3+傳統檢測方法,如基于Fe3+與[Fe(CN)6]4-反應而生成Fe7(CN)18·xH2O的普魯士藍組織染色法[25-26]、放射性同位素59Fe示蹤、以及基于57Fe的M?ssbauer光譜法[27],羅丹明熒光探針,能夠選擇性識別Fe3+,克服了傳統方法靈敏度不高、毒性大、測試干擾以及需要樣品固定等缺點,并在選擇性、光學性質以及生物相容性方面表現諸多優勢。
代表性的羅丹明Fe3+熒光探針如化合物6(見圖6),以二亞乙基三胺連接2個羅丹明骨架得到,表現內酰胺分子開-關環的可逆轉化平衡[28]。探針分子6[29]結合Fe3+后,無熒光發射的內酰胺轉化為其開環形式、發射熒光信號(λex=510 nm,λem=575 nm)。探針6在水溶液中能夠高選擇性地識別Fe3+,與Fe3+具有中等結合強度(Kd=316 μmol/L)。
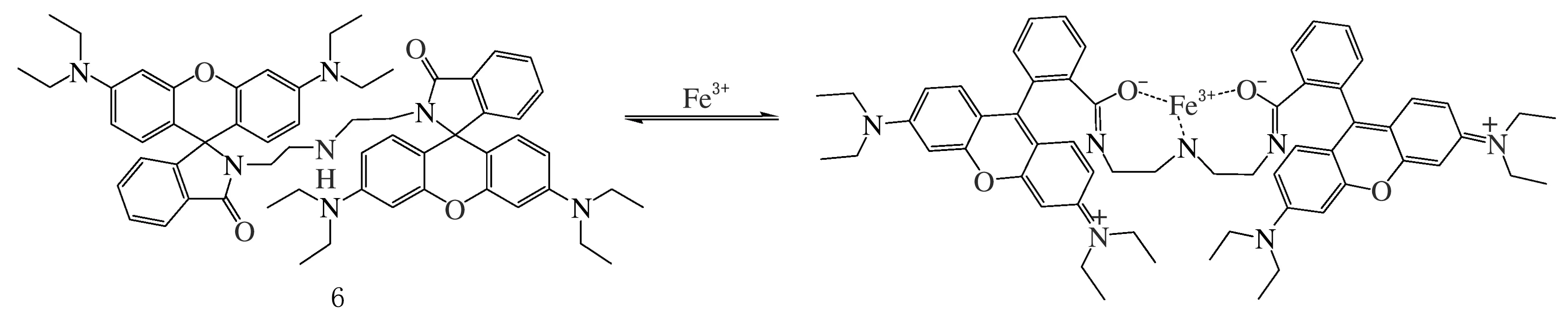
圖6 Fe3+羅丹明熒光探針6
3.1.2 Cu2+羅丹明熒光探針
Cu位于人體過渡金屬含量排序的第3位[30],類似于元素Fe,Cu也主要存在亞銅離子Cu+(cuprous)與銅離子Cu2+(cupric)2種氧化態,參與氧化還原反應、呈現動態及不均勻的分布。由于Cu的氧化還原特性,Cu是許多酶體系中不可缺少的輔因子,如細胞色素c氧化酶(cytochrome c oxidase,CcO)、Cu/Zn超氧化物歧化酶(superoxide dismutase 1,SOD1)等。
同時,由于Cu2+較強的配位能力,Cu動態平衡異常也被越來越多地證明與許多神經退化性疾病相關,如阿爾茨海默氏病(Alzheimer′s Disease,AD)、帕金森氏病(Parkinson′s Disease,PD)、肌萎縮側索硬化病(Amyotrophic Lateral Sclerosis,ALS)、門克斯病(Menkes Disease)、威爾遜病(Hepatolenticular Degeneration,HLD)等[31-33]。Cu的廣泛分布、因維持正常生理機能而具有的流動性,以及其不正常的調控作用與一系列神經退化性疾病的關系,需要從神經生理學和神經病理學的角度作以解釋。這些工作的首要前提是實現Cu的標記與追蹤,并能夠實現對其2種主要氧化態Cu+(4s23d10)與Cu2+(4s23d9)的準確區分。而傳統的67Cu同位素標記法[34]及原子吸收光譜法[35],缺乏細胞水平上的空間分辨,且無法區分Cu+和Cu2+。
Cu2+羅丹明探針7(見圖7)基于內酰胺環開-關環與相應熒光強度變化進行Cu2+響應,結合Cu2+之后,羅丹明的開環形式在這種平衡中成為主體結構,熒光強度增加了9.4倍(λex=520 nm,λem=585 nm),能夠特異性選擇Cu2+,選擇性高、結合強度中等(Kd=14 μmol/L)。結合Cu2+可以改變閉環、無熒光內酰胺形式與開環、強熒光羅丹明形式的平衡。
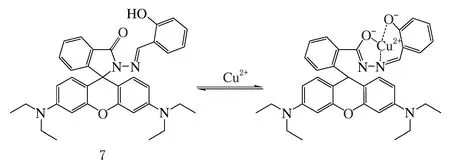
圖7 Cu2+羅丹明熒光探針7
Czarnik等設計以Cu2+作為催化劑、催化有熒光產物生成的一類不可逆水解反應,通過對該種熒光產物的特征性熒光信號檢測,間接實現Cu2+檢測(見圖8)。路線設計初期,Czarnik等嘗試以Cu2+催化水解α-氨基酸[36-37],得到羅丹明B酰肼衍生物的探針結構(化合物8)。Cu2+催化下,羅丹明母核結構快速水解,得到其酸性熒光形式[22]。在體積比為1∶4的乙腈-水體系中,探針8與Cu2+的水解反應在1 min內即可完成,且具有高靈敏度與Cu2+特異性,催化劑Cu2+濃度小于10 nmol/L時也可發生,與競爭離子共存時、探針8仍然對Cu2+具有高選擇性。其類似物為探針9(見圖8),對Cu2+表現類似的識別性能。
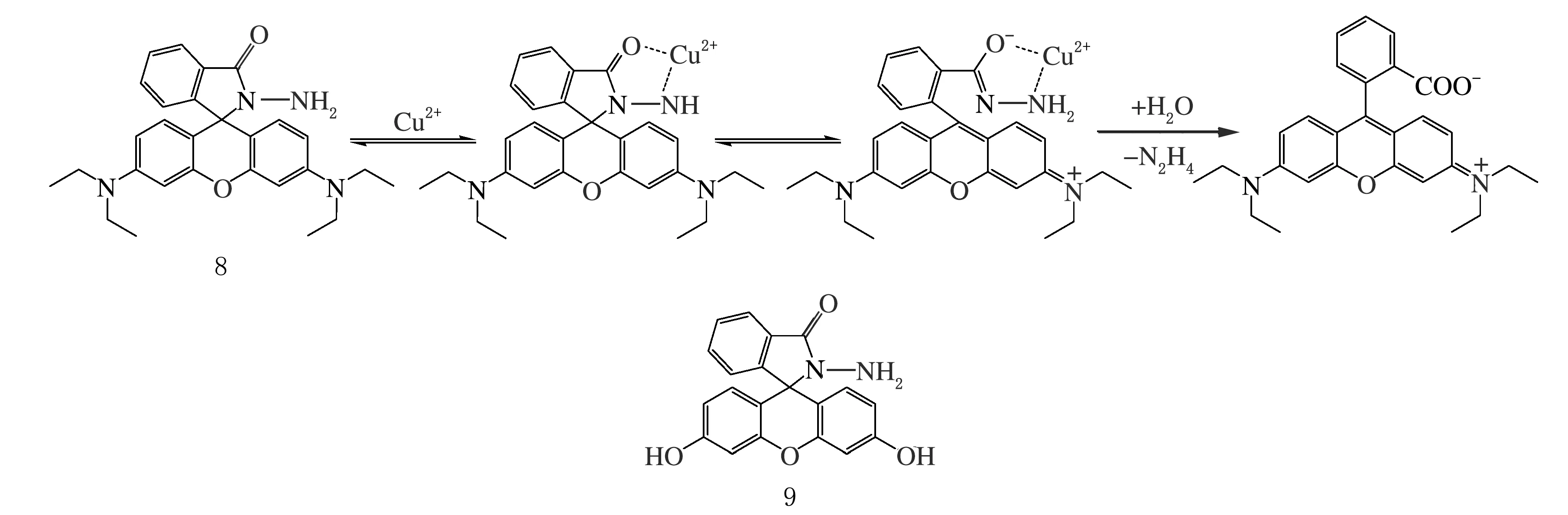
圖8 不可逆的Cu2+化學計量羅丹明熒光探針8、9
3.1.3 Hg2+探針
Hg2+熒光探針10見圖9,基于羅丹明的中位苯環修飾,Taki課題組[38]設計引入可容納金屬離子的多硫醚空腔結構,成功用于監測細胞線粒體的Hg2+濃度。
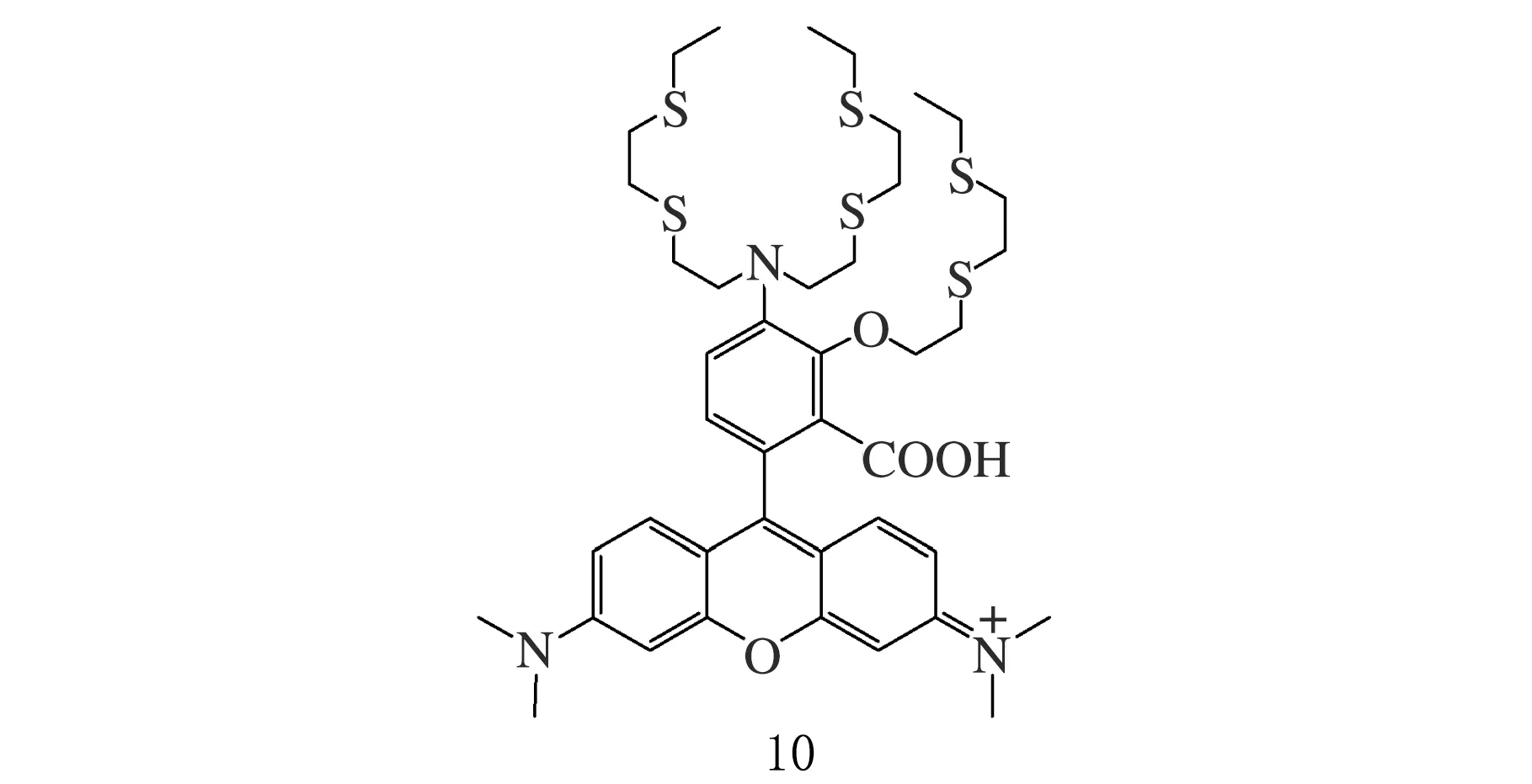
圖9 Hg2+羅丹明熒光探針10
3.2 用于陰離子標記的羅丹明熒光探針
生命體中的微量ClO-主要表現殺菌作用,一旦過量則會破壞免疫系統。Tae課題組[39]報道了基于羅丹明內酰胺衍生物的ClO-熒光探針11(見圖10),能夠完成體外活細胞環境的ClO-濃度動態監測,具有進一步用于生物體ClO-有效檢測的臨床前景。羅丹明內酰胺環呈現空間螺旋結構、具有一定的結構張力,結合ClO-后,內酰胺環的氮原子質子化、電荷密度減少,引發螺旋中心的C—N鍵開裂,同時,斷鍵后富電子螺環將進行電荷重排,形成更穩定的剛性平面大π鍵結構,表現熒光信號輸出的變化、并伴有顏色改變,實現ClO-檢測。
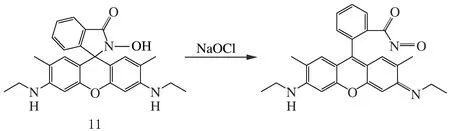
圖10 ClO-羅丹明熒光探針11
3.3 用于中性小分子標記的羅丹明熒光探針
改變3-、6-位氮原子的供電子能力,也是設計羅丹明類熒光探針的一種常見方法。唐波課題組[40]設計得到了一種含Se—N鍵、對含巰基化合物表現特征響應的熒光探針12(見圖11),成功用于細胞內硫醇的熒光成像。探針結構中,羅丹明6G母核的3-位氨基形成Se—N鍵、熒光淬滅,而硫醇(RSH)的親核進攻使Se—N鍵斷裂,在還原性谷胱甘肽(glutathione,GSH)作用下,重新釋放出表現強烈熒光信號的羅丹明6G,實現含巰基化合物的中性小分子檢測。
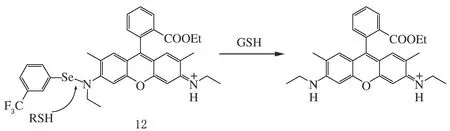
圖11 含巰基化合物的羅丹明熒光探針12
此外,還有用于自由基捕獲的羅丹明類熒光探針[41]、羅丹明類pH熒光探針[42]等,已被合成得到,并廣泛用于體外活細胞環境的標記檢測、小動物成像等領域,在小分子信標物的異常監測與分析、疾病預判等臨床實際問題中得到了初步應用。
4 結束語
熒光是一種光致發光現象,根據熒光產生機理、熒光壽命等特征光學參數可知,熒光信號發射迅速,基于熒光檢測的熒光探針技術也具有響應迅速的特性。相比生命體中小分子信標物的傳統檢測方法如同位素標記、原子吸收等,熒光探針在特異性、透膜性、低毒性、迅速響應及實時成像方面性能優良,輔助以共聚焦熒光成像技術時,探針可聚焦至亞細胞單元甚至細胞器水平的小分子信標物動態變化,進一步放大微觀信號。基于羅丹明母核結構得到兼具長波激發/發射與可視化檢測特性的熒光探針,因結構可修飾性強、衍生物種類眾多,可合成得到針對多種目標物以及適用于多種檢測要求的羅丹明衍生物探針。進行生命體中目標小分子信標物的熒光標記與檢測時,相應探針能夠特異性識別目標物,給出特征熒光信號、指示識別過程,實現生命體中小分子信標物的實時示蹤與動態變化成像。
以熒光探針技術進行小分子信標物的示蹤分析,初步實現信標分子的異常監測、指導疾病診斷等臨床實際應用問題,是目前熒光探針進行生命體中小分子信標物熒光標記及成像的主要趨勢。

