TRAP染色與免疫組化套染技術(shù)在骨組織損傷修復(fù)染色中的應(yīng)用
李 麗,陳 菲,包春娟,周琪琪,包 驥
抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphase, TRAP)是破骨細(xì)胞的特異性標(biāo)志酶,TRAP染色顯示破骨細(xì)胞胞質(zhì)中TRAP的活性,是破骨細(xì)胞的特異性染色[1]。本文首次采用TRAP染色與免疫組化套染技術(shù),幫助研究者實(shí)現(xiàn)在同一張脫鈣骨組織石蠟切片上觀察破骨細(xì)胞與血管內(nèi)皮生長(zhǎng)因子(vascular endothelial growth factor, VEGF)共表達(dá)情況,該套染技術(shù)在國(guó)內(nèi)外尚未見報(bào)道。脫鈣骨組織制片比軟組織制片過程繁瑣且易出現(xiàn)脫片、染色背景深等問題,作者經(jīng)反復(fù)摸索優(yōu)化實(shí)驗(yàn)步驟,現(xiàn)將該套染技術(shù)介紹如下。
1 材料與方法
1.1 材料(1)樣本制片:兔股骨髁骨缺損處填充直徑為7 mm的羥基磷灰石生物材料,造模后于不同時(shí)間點(diǎn)取材,離體骨組織立即用10%中性緩沖福爾馬林固定,固定后用硬組織切片機(jī)將兔股骨切成3 mm厚薄片再繼續(xù)固定48 h,用改良EDTA脫鈣液脫鈣[2],脫鈣液置于37 ℃水浴鍋,每2天更換1次脫鈣液。待骨組織脫鈣完全后行常規(guī)石蠟包埋,4 μm厚連續(xù)切片,其中1片行常規(guī)HE染色。(2)試劑:TRAP染色試劑盒購(gòu)自德國(guó)Sigma-Aldrich(387A-1KT);Rabbit anti-VEGF抗體(1 ∶100,Abcam公司,貨號(hào)ab28775);抗體稀釋液(DAKO公司,貨號(hào):S2022);Wash Buffer(DAKO公司,貨號(hào)DM831);免疫組化試劑盒REAL EnVision(DAKO公司,K5007);蘇木精染液(Thermo公司,貨號(hào)7211)。(3)耗材:Super PAP Pen超級(jí)免疫組化油筆(福州邁新公司,貨號(hào)PEN-0002)。(4)大型設(shè)備:硬組織切片機(jī)(西安藍(lán)茗醫(yī)療科技公司);全自動(dòng)封片儀(Thermo,ClearVue);WSI全數(shù)字切片掃描儀(3DHISTECH,Pannoramic SCAN)。
1.2 方法
1.2.1TRAP染色 (1)石蠟切片常規(guī)脫蠟至流水沖洗;(2)雙蒸水充分洗滌后,將裝有待染切片的雙蒸水染色盒放入37 ℃水浴鍋中靜置15 min;(3)按照TRAP染色試劑盒說明書配制TRAP孵育液,即用即配;(4)將待染切片放入37 ℃ TRAP孵育液內(nèi)避光浸染60 min;(5)37 ℃雙蒸水快洗2次,每次5 s;(6)流水沖洗5 min,雙蒸水充分洗滌。
1.2.2免疫組化染色 實(shí)驗(yàn)在TRAP的基礎(chǔ)上,再疊加免疫組化染色。(1)阻斷內(nèi)源性過氧化物酶,1.5%H2O2(甲醇配制)室溫避光封閉10 min[3];(2)流水沖洗5 min,蒸餾水充分洗滌后用免疫組化油筆在組織周圍畫圈,置入Wash Buffer液中洗滌3次,每次2 min;(3)滴加100 μL一抗VEGF工作液于組織上,4 ℃冰箱孵育過夜;(4)Wash Buffer洗滌3次后,滴加100 μL EnVision試劑盒中的A液,37 ℃孵育30 min;(5)Wash Buffer洗滌3次后DAB顯微鏡下控制顯色;(6)蘇木精復(fù)染,梯度乙醇脫水,二甲苯透明,全自動(dòng)封片儀封片,全數(shù)字切片掃描。
2 結(jié)果
大體可見兔股骨髁骨缺損處填充的生物材料與周圍宿主骨組織連接緊密,HE染色可見大量生物材料被吸收,其內(nèi)散在炎細(xì)胞、破骨樣細(xì)胞浸潤(rùn),材料內(nèi)可見較多新生骨組織形成(圖1)。TRAP單染可見兔股骨髁骨缺損處生物材料內(nèi)散在細(xì)胞胞質(zhì)暗紅色,細(xì)胞核藍(lán)色,胞體大,核數(shù)量不等的破骨細(xì)胞分布,其余細(xì)胞胞質(zhì)不顯色,TRAP染色與VEGF免疫組化套染可見兔股骨髁骨缺損處生物材料內(nèi)VEGF在新生骨組織細(xì)胞、部分破骨細(xì)胞、新生血管內(nèi)皮及部分炎細(xì)胞胞質(zhì)呈棕黃色表達(dá),破骨細(xì)胞胞質(zhì)暗紅色,胞核藍(lán)色,其余細(xì)胞胞核藍(lán)色、胞質(zhì)不顯色且背景干凈(圖2)。

圖1 A.兔股骨髁骨缺損造模后大體所見,箭頭所示類圓形區(qū)域?yàn)楣晒趋凉侨睋p處填充的生物活性材料;B.HE染色可見填充的生物材料與周圍宿主骨組織連成一片,生物材料被吸收,其內(nèi)散在炎細(xì)胞、破骨樣細(xì)胞浸潤(rùn),生物材料內(nèi)可見較多新生骨組織形成
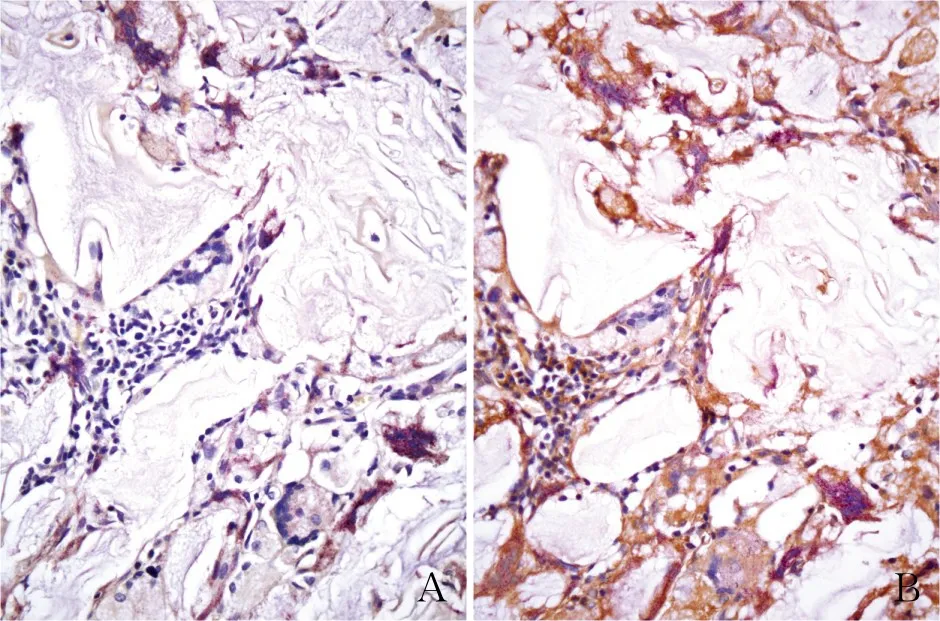
圖2 A.兔股骨髁骨缺損處生物材料內(nèi)可見細(xì)胞質(zhì)暗紅色,細(xì)胞核為藍(lán)色,胞體大,核數(shù)量不等的破骨細(xì)胞散在分布,其余細(xì)胞質(zhì)不顯色,TRAP單染;B.兔股骨髁骨缺損處生物材料內(nèi)可見VEGF在新生骨組織細(xì)胞、部分破骨細(xì)胞、新生血管內(nèi)皮及部分炎細(xì)胞胞質(zhì)呈棕黃色陽(yáng)性,破骨細(xì)胞胞質(zhì)暗紅色,胞核藍(lán)色,其余細(xì)胞核藍(lán)色、胞質(zhì)不顯色,背景干凈,TRAP+VEGF套染
3 討論
骨組織損傷修復(fù)基礎(chǔ)研究中,VEGF增強(qiáng)缺損處血管通透性,誘導(dǎo)新骨形成的同時(shí)也加速破骨細(xì)胞的骨吸收,促進(jìn)骨愈合[4]。破骨細(xì)胞起源于造血干細(xì)胞,與執(zhí)行骨形成功能的成骨細(xì)胞處于動(dòng)態(tài)平衡。研究者試圖在同一張脫鈣骨組織石蠟切片上觀察破骨細(xì)胞與VEGF的共表達(dá)。本實(shí)驗(yàn)采用TRAP染色與VEGF免疫組化套染技術(shù),經(jīng)反復(fù)實(shí)驗(yàn)發(fā)現(xiàn)該套染技術(shù)成功需要注意以下幾方面。(1)骨組織離體后處理:骨組織離體后除立即使用10%中性緩沖福爾馬林固定外[5],還使用硬組織切片機(jī)將骨組織修切成3 mm厚薄片,以便固定液充分滲透到骨組織內(nèi)部得到最佳固定效果。骨組織比軟組織致密,若不切開固定,固定液滲透慢導(dǎo)致固定欠佳,導(dǎo)致不能較好地保存骨組織內(nèi)部細(xì)胞形態(tài)結(jié)構(gòu)、TRAP酶及抗原。固定不佳的組織后續(xù)脫水處理不佳,增加組織脫片的風(fēng)險(xiǎn)。本實(shí)驗(yàn)脫鈣液選擇文獻(xiàn)報(bào)道的改良脫鈣液[2],脫鈣和固定同時(shí)進(jìn)行,脫鈣使用37 ℃水浴加快脫鈣速度,以保證在最短的時(shí)間內(nèi)脫鈣完全。組織離體后進(jìn)行該處理方法可大大降低脫片、TRAP酶及抗原丟失的風(fēng)險(xiǎn)。(2)TRAP染色:TRAP染液容易失效,每次實(shí)驗(yàn)前待染切片置于37 ℃水浴鍋中靜置15 min時(shí)即可配制TRAP孵育液,現(xiàn)用現(xiàn)配。機(jī)體離體后應(yīng)立即充分固定,盡量避免因操作不當(dāng)造成TRAP酶丟失導(dǎo)致實(shí)驗(yàn)出現(xiàn)假陰性。TRAP孵育液結(jié)束后用37 ℃雙蒸水沖洗2次,不容易出現(xiàn)脫片,且背景干凈無文獻(xiàn)里提到的顆粒沉淀[1]。為保證每張切片的染色質(zhì)量,TRAP染色不建議使用滴染,本文連續(xù)切片行TRAP染色實(shí)驗(yàn)中滴染的破骨細(xì)胞數(shù)少于浸染操作的破骨細(xì)胞數(shù)量,滴染破骨細(xì)胞胞質(zhì)內(nèi)暗紅色程度也較浸染弱。(3)VEGF免疫組化染色:本實(shí)驗(yàn)采用EnVision非生物素檢測(cè)系統(tǒng),能較好避免組織內(nèi)源性生物素干擾導(dǎo)致的非特異背景表達(dá)。然而DAB顯色系統(tǒng)不可避免內(nèi)源性過氧化物酶存在產(chǎn)生非特異背景表達(dá)。本實(shí)驗(yàn)采用1.5%H2O2(甲醇配制)室溫避光封閉10 min,能避免脫片及降低非特異背景著色[3]。石蠟切片行免疫組化染色時(shí),為最大程度暴露10%中性緩沖福爾馬林固定交聯(lián)的抗原表位,需采用最佳抗原修復(fù)條件[6]。本文采用胃酶、胰酶消化、檸檬酸水浴修復(fù)及不修復(fù)4種不同抗原修復(fù)方式,結(jié)果顯示不修復(fù)切片VEGF表達(dá)最強(qiáng)且背景最弱,脫片率最低。這與文獻(xiàn)報(bào)道的骨組織行免疫組化時(shí)如一抗選用多克隆抗體可以不經(jīng)過抗原修復(fù)結(jié)果一致[7]。黃建平等[8]也報(bào)道對(duì)大多數(shù)抗原一般提倡抗原修復(fù),但對(duì)于某些特殊抗原如HBcAg未修復(fù)的切片表達(dá)效果較好。
綜上所述,TRAP染色與VEGF免疫組化套染技術(shù)雖步驟較多,但操作簡(jiǎn)便,染色效果較好,值得推廣。

