擺位誤差對宮頸癌放療靶區和危及器官劑量分布的影響
牛利君
陜西省安康市人民醫院腫瘤放療科,陜西安康 725000
我國每年死于宮頸癌的患者約5萬例,且呈逐年上升的趨勢,嚴重威脅婦女健康。宮頸癌的主要病理類型為鱗癌[1]。放療是目前治療宮頸癌的常規手段,其中調強適形放射治療(IMRT)是三維適形放療的拓展,通過計算機制訂治療計劃,減少了靶區周圍危及器官的受照射體積,實現了三維空間上劑量分布與腫瘤形狀的一致,提高了腫瘤靶區的放療劑量及放射生物學效益,增強了放射治療效果[2-3]。但在實際應用中,腫瘤的大小與位移、機體充盈程度及體形改變、危及器官的運動都會帶來一定的擺位誤差[4]。放射治療時,實際放療靶區與計劃靶區之間的差異稱為擺位誤差。擺位誤差對放療患者治療劑量的準確性有一定影響,如果超出允許的誤差范圍,可能導致放療靶區漏照,高劑量區移位到危及器官上,影響治療效果,且會產生不良反應[5-6]。本研究利用IMRT治療宮頸癌,在放療前用千伏級錐形束CT(CBCT)進行掃描,然后與CT圖像進行對比,對擺位誤差進行分析,探討了擺位誤差對宮頸癌放療靶區和危及器官劑量分布的影響。
1 資料與方法
1.1一般資料 選取2018年8月至2020年6月在本院就診的宮頸癌患者84例納入研究。納入標準:病理確診為宮頸鱗狀細胞癌且適合進行放療的患者;簽署了知情同意書;住院前未進行過放療者;年齡20~80歲;臨床分期ⅡB~ⅢB期;無CT掃描禁忌證及碘伏醇過敏病史;生存質量卡氏評分≥80分。排除標準:有嚴重的精神疾病、認知障礙及思維障礙者;臨床資料缺乏者;合并嚴重的內科疾病者;合并其他部位惡性腫瘤者。納入研究者年齡25~78歲,平均(56.17±4.28)歲;體質量指數(BMI)為(22.47±1.37)kg/m2;病理組織學檢查:高分化49例,中分化21例,低分化14例;淋巴結轉移39例。醫院倫理委員會批準了此次研究。
1.2方法
1.2.1放療設備 GE公司的64層螺旋CT與1.5T磁共振成像(MR),華光普泰公司的碳纖維體架及熱塑成型體膜,瓦里安公司的Varian iX-5907直線加速器和機載CBCT,德國BEBIG公司的三維治療計劃系統。江蘇恒瑞醫藥股份有限公司的碘伏醇注射液(100 mL/瓶),旭東海普公司的復方泛影葡胺注射液(20 mL∶15.2 g)。
1.2.2CT圖像的采集 CT掃描前40 min囑患者排空膀胱、直腸,口服含復方泛影葡胺20 mL的溫水800 mL。患者取仰臥位,雙手交叉置額頭,采用熱塑成型體膜固定體位,然后進行CT掃描定位,將掃描所得圖像傳至放療系統。
1.2.3靶區與危及器官勾畫 所有患者均由同一醫師勾畫靶區與危及器官,并由有豐富經驗的副主任醫師確認。腫瘤區(GTV)為原發腫瘤,臨床靶區(CTV)包括GTV、亞臨床病灶及腫瘤可能侵犯的范圍和區域淋巴結。內靶區(ITV)為CTV外邊界運動的范圍。計劃靶區(PTV)為包括CTV、ITV和其他因素引起的擴大照射的組織范圍。危及器官為可能被放射野包括的正常組織或器官。
1.2.4放療計劃 計劃要求:PTV和GTV內最小劑量不能低于治療區劑量;100%的處方劑量至少包繞95%的靶區體積。危及器官的劑量體積限定:小腸V40<50%,脊髓<40 Gy,結腸V40<50%,膀胱V40<50%,直腸V40<50%,股骨V50≤5%;治療計劃放射劑量均勻度為93%~107%。
1.2.5計劃評估 利用劑量體積直方圖(DVH)評估靶區和危及器官的體積與受照射劑量情況,評估靶區的物理適形度與劑量適形度,評估危及器官受照劑量的范圍。
1.2.6CBCT圖像的獲取與配準 CBCT參數:M20準直器,F1濾線器,120 kV、80 mA,掃描角度為360°。掃描完成后使用中等分辨率重建,配準得到患者的X(左右)、Y(頭腳)、Z(腹背)三維平移誤差,然后進行實時誤差校正。
1.2.7生成模擬計劃與評估 將擺位誤差反向輸入計劃系統,在原計劃的CT圖像上進行靶區和危及器官照射劑量的重新計算。對比原計劃與模擬計劃的DVH,記錄危及器官的受照射體積、PTV的照射劑量等參數。
1.3觀察指標 (1)記錄與比較所有患者3個方向首次擺位誤差與糾正后擺位誤差。(2)記錄首次擺位誤差與糾正后擺位誤差對危及器官的影響,包括V100、直腸V40、膀胱V40、小腸V40等,V100為100%的處方劑量,各組織器官接受≥40 Gy的體積占總體積的百分比用V40表示。(3)記錄首次擺位誤差與糾正后擺位誤差對PTV1、PTV2、PTV3照射劑量的影響。
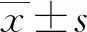
2 結 果
2.1擺位誤差糾正前后3個方向擺位誤差的比較 擺位誤差糾正后與糾正前比較,宮頸癌放療患者在X、Y、Z軸方向的擺位誤差差異均有統計學意義(P<0.05),見表1。

表1 擺位誤差糾正前后宮頸癌放療患者擺位誤差的比較
2.2擺位誤差糾正前后危及器官劑量分布的比較 擺位誤差糾正后,V100、直腸V40、膀胱V40均低于擺位誤差糾正前(P<0.05),小腸V40、結腸V40與擺位誤差糾正前比較,差異無統計學意義(P>0.05),見表2。

表2 宮頸癌放療患者擺位誤差糾正前后危及器官劑量分布的比較
2.3擺位誤差糾正前后PTV照射劑量的比較 宮頸癌放療患者擺位誤差糾正后的PTV1、PTV2、PTV3均低于擺位誤差糾正前(P<0.05),見表3。

表3 宮頸癌放療患者擺位誤差糾正前后PTV照射劑量的比較
3 討 論
宮頸癌的發病率一直位居所有婦科腫瘤的前列,我國每年約有15萬新發宮頸癌患者。宮頸癌患者早期無明顯癥狀,隨著疾病的發展,可出現陰道流血和(或)下體惡臭味,可有淋巴結轉移、血行轉移等[7]。放療為中晚期宮頸癌患者的主要治療方法,隨著影像學技術與放射物理學技術的飛速發展,已經逐步實現精確三維放療。宮頸癌放療的要求為提高腫瘤的局部控制率,顯著降低危及器官的受照射劑量,降低放射治療相關并發癥的發生率,促進患者康復[8]。但是放療基本都是以靜態CT圖像為基礎,治療中不同技術人員擺位標準的差異、患者腸管蠕動、腫瘤位移、膀胱充盈程度、患者體質量減輕等都會引起靶區的移位和變形,從而造成擺位誤差[9]。本研究顯示,擺位誤差糾正后在X、Y、Z軸方向的擺位誤差少于擺位誤差糾正前。原因分析:在Y軸方向的誤差最大,可能與宮頸癌患者多為腹型肥胖婦女、皮膚牽拉改變較大等有關;不同技術員擺位的個體差異也會引起該項誤差。在放療過程中通過CBCT影像系統實時校正擺位誤差,可實現精確放療[10-11]。
IMRT在治療過程中利用加載的CBCT系統實時采集圖像信息,考慮了各種誤差導致的照射野對治療靶區的偏離問題,可糾正存在的誤差[12]。特別是在每次放療前,CBCT掃描得到靶區周圍組織器官的三維圖像,與原計劃圖像配準,可計算得出擺位誤差,并實時校正,從而降低危及器官的受照射體積及劑量[13]。本研究顯示,擺位誤差糾正后V100、直腸V40、膀胱V40值低于擺位誤差糾正前,小腸V40、結腸V40糾正前后比較無明顯差異,表明誤差的校正降低了膀胱和直腸的受照射劑量,能保證患者安全、有效地進行放射治療。
IMRT用于宮頸癌的治療具有良好的劑量分布特性,在保證靶區劑量的同時可限制正常組織的受照射量[14]。本研究顯示擺位誤差糾正后PTV1、PTV2、PTV3的照射劑量都低于擺位誤差糾正前。原因分析:CBCT能夠獲得患者每次放療的圖像和進行在線校正,有助于分辨盆腔器官結構和軟組織器官的邊界,從而保證放療精確性[15]。本研究也存在一定的不足,PTV邊界的確定還需要進行詳細探討,同時在放療中保證危及器官的狀態恒定也比較重要。
綜上所述,宮頸癌患者放療時在X、Y、Z軸方向均存在一定的擺位誤差,糾正擺位誤差有助于降低危及器官劑量分布與減少PTV照射劑量。

