乳腺浸潤性微乳頭狀癌23例臨床病理分析
武 慧,汪 鋒
(內蒙古自治區人民醫院 病理科,內蒙古 呼和浩特010017)
乳腺浸潤性微乳頭狀癌(IMPC)是2003年WHO乳腺和女性生殖系統腫瘤病理學與遺傳學分類中新增加的一種腫瘤類型,具有獨特的病理形態及免疫組化表達特征,IMPC淋巴結轉移率高,淋巴管侵襲性強,容易局部復發,與非特殊類型乳腺癌相比,更具有侵襲轉移特性[1]。隨著對該病的重視,國內近年來對IMPC的研究越來越深入,本文收集內蒙古自治區人民醫院收治的23例IMPC病例,通過分析其臨床資料、病理特征及生物學行為,旨在提高對該腫瘤的認識,從而利于臨床診治及預后評估。
1 材料與方法
1.1 材料收集2014年1月至2019年8月在內蒙古自治區人民醫院就診并接受治療、經病理學檢查診斷為IMPC的病例23例,均為女性,年齡32-96歲,中位年齡64歲。
1.2 方法組織標本經10%甲醛固定,石蠟包埋,4-5 μm厚切片,常規HE染色,光鏡觀察。免疫組化染色采用Envision兩步法,DAB顯色,所選用的抗體ER、PR、Her-2、EMA、E-cadherin、CD31、Ki-67及試劑盒均購自福州邁新生物技術開發有限公司。
1.3 免疫組織化學評估腫瘤細胞核染色陽性率≥1%為ER、PR陽性,<1%為ER、PR陰性[2];H er-2染色判定:0或(+)者為陰性,因未行熒光原位雜交法(FISH)檢測,故(++)和(+++)者均定義為陽性。
2 結果
2.1 臨床資料本組23例患者,均為女性,年齡32-96(平均64)歲。腫瘤直徑1.2-9.0 cm(平均直徑5.1 cm),其中2例可見兩處病灶,余21例均為單一病灶。左乳9例,右乳13例,雙乳癌1例(左乳為IMPC伴浸潤性導管癌,右乳為非特殊類型浸潤性導管癌)。其中1例侵犯乳頭。行改良根治術17例(其中16例腋窩淋巴結轉移),單純乳腺切除6例(其中1例送檢前哨淋巴結轉移)。
2.2 病理檢查大體腫瘤多呈結節狀,向周圍呈浸潤性生長,切面顆粒狀,灰白灰黃質脆。單純型2例(8.7%),混合型21例(91.3%),混合型中IMPC伴非特殊類型浸潤性導管癌15例,IMPC伴黏液癌1例,IMPC伴浸潤性導管癌及黏液癌2例,IMPC伴導管原位癌3例。鏡下腫瘤細胞簇呈微乳頭或小管腺泡狀,位于類似于脈管的間質裂隙(圖1、圖2),乳頭缺乏纖維血管軸心,間質空隙無內皮襯覆,微乳頭中的細胞呈“極性反轉”的排列方式,細胞呈柱狀或立方狀,核輕中度異型,核仁偶見,胞漿多少不等,淡染至強嗜伊紅。間質內含豐富脈管,其間有大量淋巴細胞浸潤[3]。
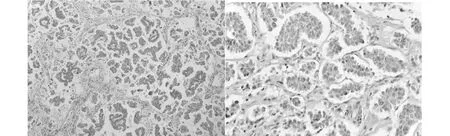
圖1 腫瘤細胞呈微乳頭狀排列,纖細的纖維分隔,形成主間質分離 HE×200 圖2 腫瘤細胞簇呈微乳頭或小管腺泡狀,位于類似于脈管的間質裂隙 HE×400
2.3 免疫表型EMA與E-cadherin在23例均陽性表達(100%),EMA陽性表達于微乳頭外側緣及腔隙內側緣(圖3),E-cadherin陽性表達于微乳頭腫瘤細胞之間的連接面(圖4),CD31標記顯示微乳頭中央缺乏血管軸心,ER、PR、Her-2陽性率分別為82.6%、73.9%、60.9%;Ki-67標記顯示腫瘤細胞生長指數為5%-55%。
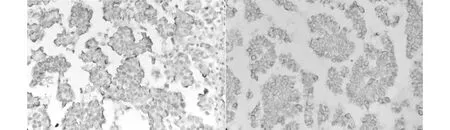
圖3 EMA陽性表達于微乳頭外側緣及腔隙內側緣Envision×400 圖4 E-cadherin陽性表達于微乳頭腫瘤細胞之間的連接面 Envision×400
3 討論
IMPC是浸潤性乳腺癌中一種少見的特殊類型,其發生率低,約占所有乳腺癌的3%-6%[4]。好發于中老年女性,發病年齡36-76歲,中位年齡52歲[1]。本研究中23例IMPC患者均為女性,年齡32-96歲,中位年齡64歲,比上述報道年齡偏大。IMPC分單純型和混合型,單純型比較少見[5],常常表現為合并浸潤性導管癌或黏液癌、導管內癌等,本研究中,單純型僅占8.7%,IMPC伴黏液癌占4.3%,IMPC伴浸潤性導管癌及黏液癌占8.7%,IMPC伴導管原位癌占13%,IMPC伴非特殊類型浸潤性導管癌占65.2%。對于微乳頭狀癌的成分究竟占多少比例才能診斷IMPC,WHO分類中并沒有明確規定。付麗等[6]認為只要腫瘤中含有IMPC成分就應該診斷為IMPC,并同時注明IMPC和其他組織學類型分別所占的比例。Gokce 等[7]研究表明IMPC單純型和混合型在腫瘤分期、淋巴結轉移、局部復發及遠處轉移和總生存率等方面均無統計學差異。
與一般的浸潤性導管癌相比,IMPC在發病年齡、發生部位以及大體等方面并無明顯差異,診斷依靠其特征性形態學表現。鏡下腫瘤細胞呈微乳頭狀或假腺管狀,位于類似于脈管的間質裂隙中,乳頭缺乏纖維血管軸心,微乳頭中的細胞呈“極性反轉”的排列方式,外緣毛糙呈鋸齒狀或毛刺樣改變,瘤細胞呈多角形或立方形,胞漿多少不等,淡染至強嗜酸性,細胞核輕中度異型,核仁偶見,少見腫瘤性壞死。IMPC獨特的微乳頭結構使其在免疫組化方面也有特殊的改變。微乳頭中的瘤細胞“極性反轉”的排列方式使EMA強陽性表達于微乳頭外側緣及腔隙內側緣,E-cadherin強陽性表達于微乳頭腫瘤細胞之間的連接面,CD31標記顯示微乳頭中央缺乏血管軸心,而腫瘤間質中可見豐富的小血管。
通常來說,乳腺癌中ER、PR陰性多提示腫瘤預后較差,Gui等[4]研究認為,在非特殊類型乳腺癌中,ER、PR陽性提示良好的預后,但對于IMPC來說卻是個例外。在IMPC中,ER、PR及Her-2多表達陽性,柳林等報道IMPC中ER陽性率為53.3%-93.1%[8]。但也有文獻認為,IMPC激素受體多呈陰性,而Her-2呈過表達[7]。本研究中ER、PR、Her-2陽性率分別為82.6%、73.9%、60.9%;Ki-67標記顯示腫瘤細胞生長指數為5%-55%。
日常診斷工作中,IMPC需與以下病變相鑒別:(1)乳腺黏液癌:典型病例腫瘤細胞呈小簇狀彌漫分布于細胞外黏液池內,后者由含薄壁血管的纖細纖維分隔。偶爾細胞排列成腺樣、梁索狀、乳頭樣或微乳頭狀。黏液癌瘤細胞團周邊平滑,腋窩淋巴結轉移率很低。近年來,一種乳腺黏液癌的新亞型——乳腺微乳頭狀黏液癌逐漸引起人們的關注,其癌細胞的排列方式與IMPC類似,但與其不同之處在于前者的癌巢為大量黏液所包繞;(2)乳腺浸潤性乳頭狀癌:浸潤性細胞巢含有真性乳頭結構,缺乏IMPC無軸心的特征性微乳頭狀結構;(3)脈管內癌栓:癌栓一般形態不規則,且脈管間的距離常較大,免疫組化血管標記(如CD34、CD31、FactorVIII)或淋巴管標記(D2-40)為陽性,IMPC腫瘤周腔隙無內皮細胞襯覆;(4)乳腺轉移性微乳頭狀癌:卵巢、肺、膀胱等均可發生微乳頭狀癌,發生乳腺轉移時需結合臨床病史及免疫組化予以鑒別,轉移性微乳頭狀癌無導管原位癌成分;(5)制片假象:制片過程中由于組織收縮,造成瘤細胞巢和周圍纖維間質分離,形成細胞巢周圍腔隙,但瘤細胞巢呈多形性,且異型性顯著,外緣通常沒有鋸齒狀或毛刺狀結構,免疫組化EMA可予以鑒別。
乳腺IMPC成分所占的比例與預后的關系尚存在爭議。Kim等[9]認為乳腺IMPC成分不論比例高低,均表現出較強侵襲性,而Gokce等[7]認為乳腺IMPC成分的多少與腫瘤的臨床病理特征并無直接相關性。
除乳腺外,其他器官如肺、卵巢、膀胱、結腸等也可發生“極性反轉”的微乳頭狀癌,“極性反轉”這一特殊的組織學特征與腫瘤的淋巴結轉移有關[10],目前已有多篇文獻報道了胃腸道、肺等器官IMPC淋巴結轉移率顯著高于無“極性反轉”的非IMPC,預后也較差[11-12]。有研究認為乳腺IMPC腋窩淋巴結轉移率高達52.9%-90.5%[13]。本研究23例患者腋窩淋巴結轉移率73.9%。
對于乳腺IMPC,目前推薦的治療方法是全乳切除及腋窩淋巴結清掃,由于其在腋窩及鎖骨上更易轉移和復發,建議患者行腋窩及鎖骨上區放療[14]。賈宏琴等[15]回顧性分析顯示乳腺IMPC患者行新輔助化療后獲益較小,并可增加遠處轉移的風險,此外,化療藥物本身也會降低機體免疫力,誘導癌細胞重新定位并形成轉移病灶,從而影響患者的預后。本組23例患者中,16例行術后化療,10例行術后放療,3例行靶向治療,經隨訪,1例因年齡較大并發生骨轉移于術后26個月死亡,2例于術后15個月、24個月出現局部復發(同側胸壁、鎖骨上)。因本研究病例數較少,因此還不能準確評估治療方案和預后,還需不斷積累病例數并延長隨訪時間。
綜上所述,IMPC是乳腺癌中一種侵襲力強,淋巴結轉移率高且預后不良的類型,在病理外檢中,檢測和報告乳腺癌標本中是否存在微乳頭成分及有無淋巴管血管侵犯非常重要,同時臨床醫師也應該全面認識并高度重視IMPC,尤其是在術式選擇、術后輔助治療方案選擇及預后評估等方面均應將其作為一項重要的參考因素。

