人胃癌耐藥細胞的建立方法及意義
劉玉俠,齊 紅,段北野,付 堯,夏 莉,于 鴻,王 斌*
(1.吉林省腫瘤防治研究所,吉林 長春130012;2.吉林省腫瘤醫院;3.吉林省人民醫院)
胃癌是消化道惡性腫瘤之一,在我國發病率和死亡率均較高[1-2]。目前胃癌的治療還是以手術為主,輔以術后化療及靶向治療。在化療過程中,很多人會對化療藥物產生耐藥,從而影響治療效果。為了探求腫瘤細胞的耐藥機制以及為耐藥腫瘤治療的研究提供實驗模型,本實驗采用順鉑反復沖擊的方法建立人胃癌細胞SGC-7901耐藥細胞模型,為研究化療耐藥機制及治療等奠定基礎。
1 材料與方法
1.1 試劑及器材IMDM培養基,Gibco產品;DMEM培養基,Hyclon產品;MTT(噻唑藍),Sigma產品;胎牛血清,天津TB公司;DMSO(二甲基亞砜),Sigma產品;順鉑,江蘇豪森藥業股份有限公司;瓊脂糖,DNA標準品,寶泰克公司產品;低溫低速離心機,SORVALL RTT USA;全自動酶標儀,Labsystems Dragon;電泳儀,上海天能。
1.2人胃癌細胞株SGC-7901,吉林省腫瘤防治研究所保存。
1.3 實驗方法
1.3.1培養人胃癌細胞株SGC-7901 將液氮凍存的SGC-7901細胞取出復蘇后,離心洗滌,加入含10%FCS的DMEM培養液的培養瓶中,置于37℃,5%CO2培養箱飽和濕度下培養。
1.3.2誘導SGC-7901細胞耐藥 SGC-7901細胞培養至指數生長期,加入終濃度為50 μmol/L順鉑,沖擊1 h后棄去含順鉑培養基,更換為新鮮配制的含10%FCS的DMDM培養液繼續培養,每天觀察細胞生長狀態,待細胞長滿時,用0.25%胰酶消化傳代。傳代后細胞長滿瓶底時用同樣濃度的順鉑同樣方法沖擊.如此反復,體外連續培養、沖擊、傳代,并反復凍存,復蘇,觀察細胞株生長穩定性,同時進行抗藥性檢測。
1.3.3細胞抗藥性(抑制率)檢測 用MTT法將培養的人胃癌細胞株SGC-7901和經過順鉑沖擊處理4次和6次的SGC-7901細胞培養至對數生長期,0.25%胰酶消化后,洗滌、計數、重懸于10%FCS的DMDM培養液,調整細胞密度為5×104/mL,加入96孔培養板,100 μL/孔,37℃,5%CO2培養箱過夜培養,細胞貼壁后加入順鉑,終濃度分別為100、50、25、12.5、6.25 μmol/L,同時設陰性對照(等體積的生理鹽水)和空白對照(無細胞)。各組設6復孔。37℃,5%CO2培養箱繼續培養48 h,培養結束前4 h加入MTT(5 mg/mL),20 μL/孔待培養結束,小心吸棄培養上清,每孔加入DMSO,150 μL,震蕩溶解后,用全自動酶標儀檢測各孔吸光度值(A),波長為492 nm。根據檢測結果計算耐藥性(抑制率)及IC50(50%細胞生長抑制所需的藥物濃度),計算方法:抑制率=[1-(實驗組均值/陰性對照組均值)]×100%,應用SPSS17.0軟件計算。
1.3.4SGC-7901細胞(對照組及實驗組)DNA提取 見參考文獻[3]。
1.3.5SGC-7901細胞(對照組及實驗組)多藥耐藥基因(MDR)及特異性基因片段擴增及檢測 (1)MDR基因全長擴增、檢測:取1.3.4提取的DNA,采用PCR擴增、瓊脂糖電泳法檢測MDR全長序列(約4.7 kb)的表達。引物設計:上游引物 ATGGATCTTGAAGGGGACCGCAATGGAGG,下游引物CATCTCATACAGTCAGAGTTCACTGGCGC。擴增方法和條件:在離心管內加入下列物質:10x bf,2.5 μL;MgCl2,2.5 μL;DNTP(2 mM),1.0 μL;Primers,1.0 μL(each);DDW,16.0 μL;Target,1.0 μL;95℃,5 min;Tag,0.5 μL;94℃,60 s;55℃,80 s;72℃,150 s;共30個循環,72℃延伸10 min。用0.8%的瓊脂糖進行凝膠電泳。(2)MDR特異基因片段(約162 bp)檢測:DNA提取方法同上。引物設計:上游引物CCC ATC ATT GCA ATA GCA GG,下游引物:GTT CAA ACT TCT GCT CCT GA。擴增方法:在離心管內加入下列內容物:10x bf 2.5 μL,MgCl2 2.5 μL,DNTP(2 mM)2.5 μL,Primers 1.0 μL(each),DDW 14.0 μL,Target 2.0 μL,95℃,5 min;Tag 0.5 μL,94℃ 30 s,55℃ 60 s,72℃ 70 s,共30個循環,每個循環增加1 s,720C延伸10 min。用1.5%的瓊脂糖進行凝膠電泳。
1.4 統計分析應用SPSS17.0統計學軟件進行分析,計量數據采用Mean±SD表示,組間比較采用方差分析及t檢驗進行分析。P<0.05為差異有統計學意義。
2 結果
2.1 不同次數順鉑沖擊后細胞耐藥性檢測及IC50測定結果
2.1.150 μmol/L順鉑沖擊4次后不同濃度順鉑對親本細胞和耐藥誘導細胞的生長抑制情況及IC50結果,見表1。
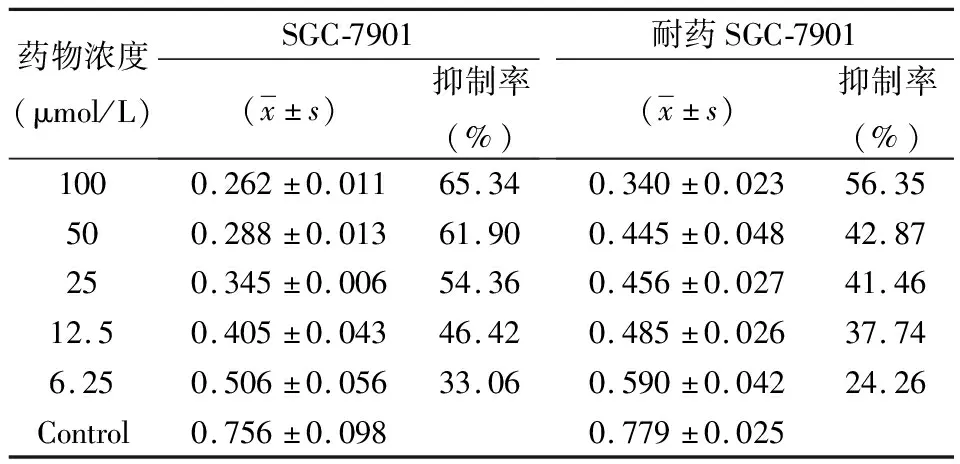
表1 正常SGC-7901細胞和經5 0 μmol/L順鉑沖擊4次后SGC-7901細胞的耐藥檢測
2.1.250 μmol/L順鉑沖擊6次后不同濃度順鉑對親本細胞和耐藥誘導細胞的生長抑制情況及IC50結果,見表2。
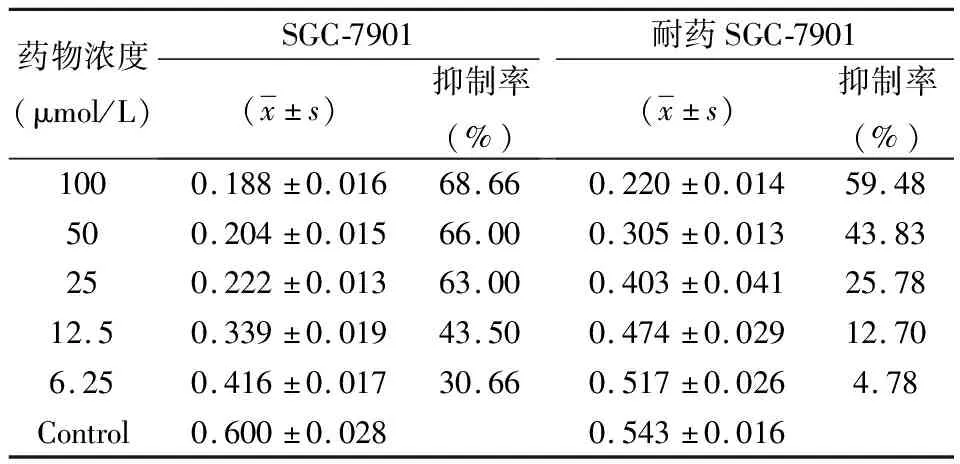
表2 正常SGC-7901細胞和經5 0 μmol/L順鉑沖擊6次后SGC-7901細胞的耐藥檢測
2.2 耐藥SGC-7901細胞MDR及特異性片段表達檢測
MDR1全長大約4.7 kb,從圖1可以看出,在此位置上可見一泳帶,證明提取胃癌細胞SGC-7901順鉑耐藥細胞有MDR1基因的表達,而親本SGC-7901細胞沒有表達。
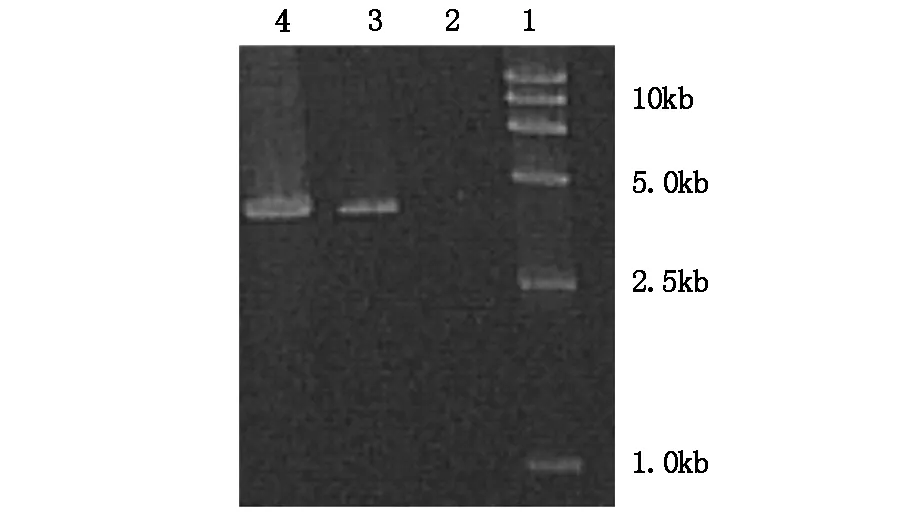
圖1 耐藥SGC-7901細胞MDR表達
MDR1特異片段大約167 bp,從圖2電泳結果可見,在誘導4次和6次的耐藥SGC-7901在167 bp附近有1條泳帶,而親本細胞沒有表達。
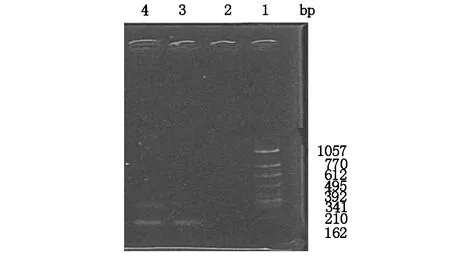
圖2 耐藥SGC-7901細胞特異性片段表達
3 討論
腫瘤細胞耐藥是影響治療效果的重要原因之一。腫瘤耐藥的產生有多種原因,其中有原藥耐藥和多藥耐藥。原藥耐藥是指腫瘤細胞對已經用過的藥物產生的耐藥,而MDR是指腫瘤細胞對1種藥物產生耐藥后,對其他結構和功能以及作用機制不同的多種藥物都產生了耐藥。多藥耐藥大部分發生于單用高劑量給藥或聯合用藥后存活下來的部分細胞[4-5],也就是腫瘤干細胞(CSCs)。CSCs雖然僅占腫瘤細胞的一小部分,但它卻有強大的自我更新能力,形成與親代細胞完全相同的腫瘤細胞,是腫瘤復發的根源[6-7]。
目前,鉑類藥物是最常用的周期非特異性抗腫瘤藥物,它是多種腫瘤治療藥物的首選。其中,順鉑(DDP)是使用廣泛的化療藥物之一[8]。但是由于鉑類抗腫瘤藥物結構上的相似,使其很容易產生原藥耐藥或交叉耐藥,造成化療治療的失敗[9]。根據這一現象,本實驗用順鉑誘導人胃癌細胞SGC-7901產生耐藥性,建立人胃癌細胞SGC-7901順鉑耐藥模型,為耐藥細胞的治療等研究提供實驗基礎。
本研究經過反復實驗,最后選擇用50 μmol/L順鉑對人胃癌細胞SGC-7901進行反復沖擊的方法,誘導SGC-7901細胞耐藥,并對沖擊第4次和第6次的細胞以及親本細胞分別做了耐藥抑制率和耐藥基因檢測,以確認耐藥相關,結果證明,經4次和6次沖擊后,人胃癌細胞SGC-7901對順鉑具有較強的耐受力,IC50分別為63.98 μmol/L和66.34 μmol/L,而親本細胞SGC-7901則分別為20.55 μmol/L和18.22 μmol/L,4次和6次沖擊結果比較無論是對照組還是實驗組沒有明顯差異,而同次間的比較有顯著差異(P<0.01),同時誘導4次和6次的SGC-7901細胞均有MDR和特異片段表達。因此,本實驗建立了SGC-7901/DDP耐藥細胞株。該細胞株通過反復凍存、復蘇后,仍對順鉑有較高的耐藥性及MDR的表達。

