副豬嗜血桿菌sodA基因的表達及其理化性質
胡基雄,王 席,李國攀,榮 俊
(1.長江大學生命科學學院,湖北 荊州 434025;2.荊州長新生物有限公司,湖北 荊州 434025)
副豬嗜血桿菌sodA基因編碼的金屬錳依賴的超氧化物歧化酶是一種防御蛋白質[1,2]。超氧化物歧化酶(SOD)廣泛存在于動物、植物、微生物中。1938年,Keilin和Mann在血液中發現了一種蛋白質——血銅蛋白。1969年,Mc Cord和Fridovich發現該蛋白質具有酶活性,并正式命名其為超氧化物歧化酶[3]。超氧化物歧化酶根據其結合的金屬離子不同主要分為Mn SOD、Fe SOD、Cu/Zn SOD以及Ni SOD 4類,分別由sodA、sodB、sodC以及sodN基因編碼[4,5]。超氧陰離子自由基(O2-)是生物體生理反應的中間產物,具有極強的氧化能力,是生物氧毒害重要因素之一[6]。SOD是機體內天然存在的超氧自由基清除因子,對維持生物體內動態平衡具有重要作用。缺失SOD的嗜血桿菌菌株比野生型更容易被細胞外超氧化物殺死[7]。Yesilkaya等[8]通過突變肺炎鏈球菌sodA基因使其Mn SOD失活,突變株在有氧條件下生長速度低于野生型。SOD在細菌預防侵染過程中宿主免疫細胞的氧化殺傷中可能發揮重要作用[9]。本研究以副豬嗜血桿菌sodA基因為研究對象,通過大腸桿菌原核表達系統表達重組HPSSOD蛋白質,利用鄰苯三酚自氧化法檢測其活性,獲得具有活性的重組HPSSOD蛋白質,為研究SOD在HPS細菌生理代謝中的作用奠定基礎。
1 材料與方法
1.1 質粒與菌株
血清5型副豬嗜血桿菌、pET28a(+)載體以及E.coliBL21(DE3)菌種來源于長江大學生物醫藥研究所。
1.2 試劑與儀器
瓊脂糖凝膠DNA回收試劑盒購自天根生化科技(北京)有限公司;快速質粒DNA小提試劑盒購自Sigma公司;BamHⅠ、XhoⅠ限制性內切酶購自NEB公司;金牌Mix(green)Golden Star T6 Super Mix購自北京擎科生物科技有限公司;鄰苯三酚購自上海麥克林生化科技有限公司;Tris購自賽國生物科技有限公司;分析純試劑磷酸氫二鈉、磷酸二氫鈉、氯化鈉以及濃鹽酸均購自國藥集團化學試劑有限公司。
Gel Doc EZ凝膠成像儀、Trans-Blot Turbo轉膜儀均購自Bio-Rad公司;UV 2450紫外可見分光光度計購自島津公司;美國1200高效液相色譜儀購自安捷倫公司;TAS-990型火焰原子化法原子吸收光譜儀購自北京普析通用儀器有限責任公司。
1.3 HPS SOD重組表達載體的構建
根據GenBank上發布的HPSsodA基因序列(ACCESSION:CP041334),設計1對引物sod F和sod R(表1),以血清5型副豬嗜血桿菌煮沸法粗提的基因組DNA作為模板,PCR擴增一段長度為629 bp的SOD序列,PCR反應程序為:98℃預變性2 min;98℃變性10 s,58℃退火10 s,72℃延伸20 s,30個循環;72℃最終延伸3 min;4℃保存。PCR擴增產物經1.5%的瓊脂糖凝膠電泳進行分析并切膠回收。將回收的PCR產物以及pET28a(+)載體用BamHⅠ和XhoⅠ限制性內切酶進行雙酶切,用T4DNA連接酶將酶切后的PCR產物連接至pET28a(+)載體中。將連接的產物轉化至E.coliBL21(DE3)化學感受態中,經PCR鑒定以及測序鑒定后,將測序正確的菌種保存,命名為E.coliBL21(DE3)/pET28a-HPS-SOD。

表1 引物序列
1.4 重組HPS SOD蛋白質的表達
將E.coliBL21(DE3)/pET28a-HPS-SOD工程菌種接種至含50μg/mL卡那霉素的LB培養基中37℃培養8 h,1∶100接種至含50μg/mL卡那霉素的LB培養基中37℃培養,至OD600nm為0.8,經終濃度30 mmol/Lα-乳糖在32℃誘導表達10 h。收集菌體沉淀,用磷酸鹽緩沖液(20 mmol/L PB,15 mmol/L NaCl,pH 7.4)將菌體按照1∶10(m∶V)重懸,超聲破碎后,12 000 r/min離心10 min,收集上清液進行SDSPAGE檢測。
1.5 重組HPS SOD蛋白質的純化
將上清液進行硫酸銨分級沉淀,收集飽和度40%~60%的沉淀蛋白質,用PB緩沖液重懸沉淀并利用0.22μm濾器過濾。用3倍柱體積的PB緩沖液(pH 7.4)平衡Sephacryl S-300層析柱及系統,將預處理的蛋白液注入純化儀,流速3 mL/min,分管收集所有UV 280 nm出現吸收峰的溶液,電泳后將目的蛋白質含量較高的收集液進行混合。用5倍柱體積的緩沖液A(pH 7.4 PB)平衡DEAE Sepharose Fast Flow陰離子交換層析柱及系統,以1 mL/min的流速將上一步混合液注入純化儀,上樣完成后用緩沖液A淋洗層析柱5個柱體積,然后通過緩沖液A和緩沖液B(pH 7.4 PB,1 mol/L NaCl)調整比例以形成離子強度梯度,以3 mL/min流速進行梯度洗脫,分管收集所有UV 280 nm出現吸收峰的溶液,將純化后的蛋白用SDS-PAGE進行檢測,用Bio-Rad凝膠成像儀Image Lab軟件進行純度分析,同時采用Bradford法對純化后蛋白質進行檢測。
1.6 重組HPS SOD蛋白質的Western Blotting鑒定
將純化后的目的蛋白質進行SDS-PAGE電泳,然后將目的蛋白質轉移至NC纖維膜上,以5%脫脂奶粉在37℃孵育1 h,以6×His Tag Mouse Monoclonal antibody作為一抗(1∶8 000),37℃孵育1 h,用1×PBST洗滌NC膜3次,10 min/次。以HRP標記的羊抗小鼠二抗IgG(H+L)作為二抗(1∶20 000),37℃孵育1 h,用1×PBST洗滌NC膜3次,10 min/次。加入ECL超敏化學顯色液(A液+B液)孵育30 s,用Gel Doc XRS凝膠成像儀進行化學發光成影拍照。
1.7 鄰苯三酚自氧化法的建立
1.7.1 鄰苯三酚自氧化最大波長的選擇 依次加入25℃預熱的100 mmol/L Tris-HCl(含1 mmol/L EDTA-2Na,pH 8.2)、20 mmol/L PB緩沖液(pH 7.4)和4.5 mmol/L鄰苯三酚(表2),迅速搖勻,分光光度計掃描300~600 nm波長范圍內鄰苯三酚自氧化產物的吸收峰。
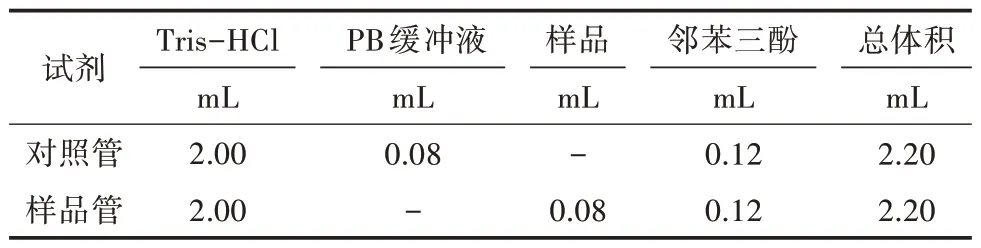
表2 鄰苯三酚自氧化法測定
1.7.2 鄰苯三酚自氧化速率的測定 依次加入25℃預 熱的100 mmol/L Tris-HCl(pH 8.2)和20 mmol/L PB緩沖液(pH 7.4),4.5 mmol/L鄰苯三酚,迅速搖勻,檢測前3 min鄰苯三酚自氧化產物在最大吸收峰處吸收值的變化。
1.7.3 酶活力的計算 調節待測樣品至其對鄰苯三酚氧化抑制率接近50%進行酶活測定最佳,

式中,?A1為鄰苯三酚自氧化速率;?A0為樣液抑制鄰苯三酚自氧化速率;V為樣液體積,單位為mL;n為樣液稀釋倍數;C為樣品濃度,單位為mg/mL。
1.8 Mn元素含量的測定
用固體硫酸錳配制成錳的濃度為100 mg/mL的儲存溶液,介質為2%的稀鹽酸,然后將錳儲存液稀釋成系列梯度的標準品,標準品系列質量濃度見表3。用TAS-990原子吸收分光光度計進行Mn元素的檢測,檢測波長279.48 nm對應樣品的吸光度,繪制Mn的標準工作曲線。同法測定濃縮后純化的HPSSOD蛋白質中Mn原子吸收值,并根據標準曲線擬合的方程計算樣品中Mn元素含量。
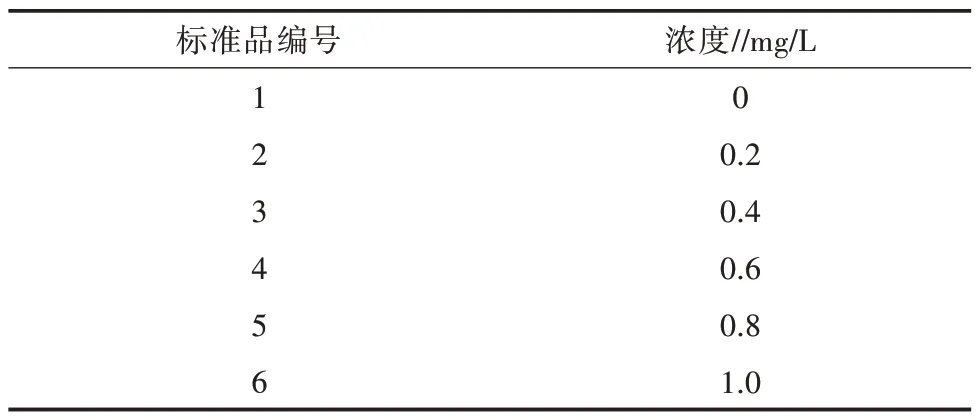
表3 Mn原子吸收標準系列質量濃度
1.9 HPS SOD聚合形式的初步鑒定
利用0.1μm濾膜過濾后的流動相(50 mmol/L PBS,pH 7.4)沖洗高效液相色譜系統,將純化后的重組HPSSOD樣品以及3個相對分子質量標準品:牛血清白蛋白二聚體(132.8 ku)、胰蛋白酶單體(23.8 ku)、豬尿酸氧化酶四聚體(132.0 ku)分別經0.1μm濾器過濾后上樣至高效液相色譜柱(Agilent Bio SEC-5)中,以1 mL/min流速進行淋洗,檢測280 nm處樣品吸收峰,記錄保留時間。以各標準品的log10(標準品分子質量)作為橫坐標,保留時間作為縱坐標擬合線性回歸方程,根據重組HPSSOD的保留時間,利用線性回歸方程計算其分子質量。
2 結果與分析
2.1 HPS SOD重組表達載體的鑒定
對構建的重組表達菌株E.coliBL21(DE3)/pET 28a-HPS-SOD進行菌液PCR鑒定,經過1.5%的瓊脂糖凝膠電泳檢測鑒定,結果表明,在600 bp處擴增到了特異性條帶(圖1),與預期大小相符,表明E.coliBL21(DE3)/pET28a-HPS-SOD重組表達菌株構建成功。
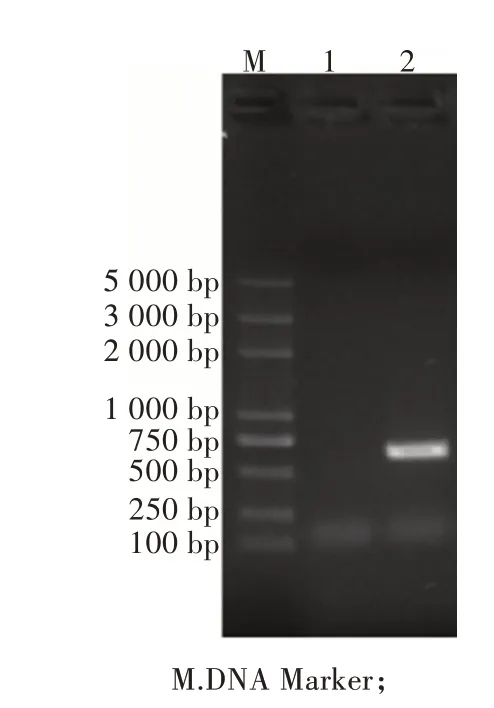
圖1 菌液PCR鑒定結果
2.2 HPS SOD重組蛋白質的表達與純化
E.coliBL21(DE3)/pET28a-HPS-SOD工程菌誘導表達產物經SDS-PAGE檢測。結果表明,表達的重組HPSSOD蛋白質分子質量為26.0 ku,與預期大小相同,表達產物主要以可溶性形式存在于上清中(圖2)。表達的重組HPSSOD蛋白質經過硫酸銨分級沉淀,Sephacryl S-300過濾層析以及DEAESepha?rose Fast Flow陰離子交換層析等方法純化后,經SDS-PAGE電泳分析,得到的純度為95%的重組HPSSOD蛋白質(圖2)。
2.3 HPS SOD重組蛋白質的鑒定
將純化后的重組HPSSOD蛋白質進行Western Blotting檢測,在26 ku處有明顯特異性反應(圖3),與重組的HPSSOD蛋白質分子質量大小一致,陰性對照與6×His Tag多克隆抗體無明顯特異性反應,表明重組HPSSOD蛋白質表達成功。

圖2 SDS-PAGE檢測結果
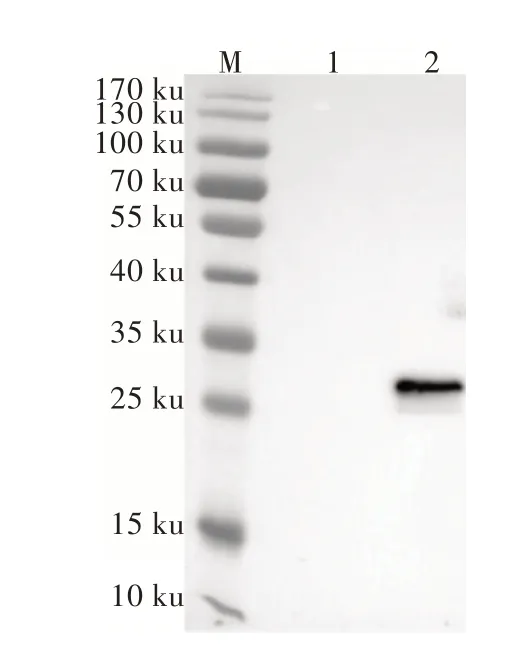
圖3 Western Blotting檢測結果
2.4 HPS SOD重組蛋白的酶活
2.4.1 鄰苯三酚自氧化最大吸收波長選擇 如圖4所示,在波長300~600 nm,每隔3 min掃描1次,鄰苯三酚自氧化產物最大吸收峰為318 nm,故選擇318 nm進行酶活性測定。
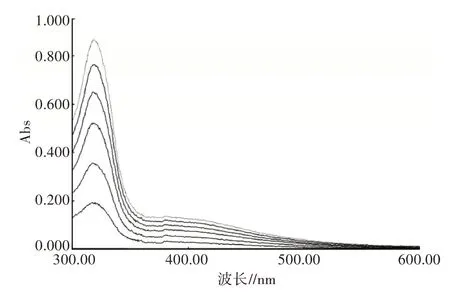
圖4 鄰苯三酚自氧化產物在不同時間的吸收掃描光譜
2.4.2 重組HPSSOD酶活的測定 采用建立的鄰苯三酚自氧化法來檢測純化的重組HPSSOD的酶活性,檢測得到重組HPSSOD酶活性為215.9 U/mg,表明重組HPSSOD具有較好的活性。
2.5 重組HPS SOD蛋白質中Mn元素的含量
根據測定的錳標準品不同含量對應的吸收值,繪制出標準曲線(圖5),得出計算方程C=0.568 7A2+2.847 6A+0.002 4(C為濃度mg/L,A為吸光度),相關系數為0.999 94,表明Mn質量濃度在0~1.0 mg/L內相關性較好。測得純化的重組SOD樣品對應的平均吸收值為0.24(SD為0.000 2,RSD為0.513%),對應純化的重組SOD樣品中Mn元素平均含量為0.71 mg/L,加標量為0.20 mg/L,測得總量為0.89 mg/L,回收率為90%,表明該方法所測的純化后HPSSOD中Mn濃度具有較好的準確度。

圖5 Mn元素標準工作曲線
2.6 重組HPS SOD蛋白質表觀分子質量的檢測
經HPSEC檢測,純化后的HPSSOD保留時間為8.171 min。分子質量標準品保留時間見表4。根據標準品擬合的線性方程為保留時間(min)=-1.248 9×log1(0分子質量)+10.72,相關系數為0.989 3,將重組HPSSOD的保留時間代入方程計算得出純化的重組HPSSOD蛋白質表觀分子質量為109.8 ku。變性電泳顯示重組HPSSOD單亞基的分子質量為26 ku,由此推測該重組蛋白質是4聚體蛋白質。

表4 HPSEC檢測數據表
3 小結與討論
副豬嗜血桿菌病又稱格拉澤氏病,由副豬嗜血桿菌引起的豬全身性炎癥反應[10]。超氧化物歧化酶作為治療全身炎癥性疾病的一個潛在靶點,有學者發現接種了副豬嗜血桿菌亞單位疫苗SOD的小鼠對HPSSH0165和MD0322具有較好的免疫保護作用,表明HPSSOD是潛在的具有高效免疫原性的重組蛋白之一[11,12]。目前,從鼠傷寒沙門菌、金黃色葡萄球菌、熒光假單胞菌等中均克隆并表達出了活性SOD[13-15]。但關于副豬嗜血桿菌sodA編碼的Mn-SOD的酶活性以及相關理化性質的研究未見報道,本研究通過克隆副豬嗜血桿菌的sodA基因,表達出了具有活性的重組HPSSOD。
生物體內存在兩類抗氧化系統,其中一類為酶抗氧化系統,包括過氧化氫酶(CAT)、超氧化物歧化酶(SOD)、谷胱甘肽過氧化物酶(GSH-Px)等[16]。超氧化物歧化酶在清除活性氧系統中作為第一道防線,是機體應激反應的重要監測指標[17,18]。目前獲得超氧化物歧化酶的傳統途徑是從植物、動物、微生物等提取,動物血液中提取SOD存在交叉感染等風險已被國內外禁止,植物中SOD含量較少,提取純化工藝復雜、生產成本較高,雖然微生物發酵法提取高產菌株的SOD產量較高成本較低但獲得高產菌株的來源有限,微生物中SOD基因的表達與其生長階段以及營養條件有關[19]。一般的動植物和微生物中提取的天然SOD穩定性較差。利用大腸桿菌原核表達系統表達異源蛋白,因其具有產出快、產量高的特點成為獲取SOD的有效途徑[20]。Shi等[21]通過克隆蠶的BmSOD3基因,利用原核表達系統獲得Cu/Zn-SOD,在體外顯示出對大腸桿菌的抗菌活性,還有克隆黃瓜Cu/Zn-SOD基因獲取有活性的SOD[22]。而大多數采用的IPTG作為誘導劑進行誘導表達,IPTG具有毒性作用,在應用方面有較大限制[23],因此本研究通過α-乳糖作為誘導劑,誘導大腸桿菌工程菌進行表達,獲得高表達量的可溶性異源HPSSOD蛋白質,測得純化后的HPSSOD酶活力為215.9 U/mg,同樣具有較好的活性。SOD在食品、臨床、日化等方向應用廣泛[24]。獲得高純度有活性的超氧化物歧化酶產物顯得尤為重要,傳統從動植物微生物中提取純化天然SOD的方法是破碎提取法,然后經過有機溶劑、鹽沉淀、層析柱分離出SOD[25,26]。本研究采用硫酸銨沉淀、過濾層析、離子交換層析等系列的方法得到純度為95%較高純度的重組HPSSOD蛋白質,在實際大規模生產用于人類醫療保健中具有較大的優勢。
不同SOD其結合的金屬離子不同。通過原子吸收分光光度法檢測水樣[27]、人血白蛋白[28]中金屬含量已有報道。本研究采用火焰原子吸收光度法檢測到濃縮后的純化的HPSSOD樣品中Mn元素含量為0.71 mg/L,回收率為90%,檢測準確度較好。Mn-SOD主要以二聚體或四聚體的形式存在,不同來源的Mn-SOD亞基分子分子質量在20 ku左右,分子質量在40~80 ku[29,30],真核生物線粒體中的Mn-SOD是一種四聚體蛋白[31]。有學者通過測定雙孢蘑菇SOD酶亞基分子質量以及全酶分子質量推測其聚合形式為二聚體[30]。目前,通過HPSEC法分析可有效獲得蛋白表觀分子質量[32,33],本研究通過HPSEC法檢測計算得到重組的HPSSOD分子質量為109.8 ku,與其4個亞基形成的聚合體分子質量相近,推測重組HPSSOD可能是由4個相同亞基組成的多聚體。
綜上所述,本研究成功地將副豬嗜血桿菌的sodA基因克隆到pET28a(+)表達載體中,通過大腸桿菌原核表達系統獲得了重組HPSSOD蛋白質。重組HPSSOD蛋白質為可溶性蛋白質,為多聚體,酶活性較好,為研究HPSSOD的抗氧化機理以及開發利用提供了依據。

