近零磁場下東方黏蟲轉錄組分析
閆蒙蒙 張蕾 程云霞 江幸福


摘要 :為進一步探究黏蟲的磁感應機制,明確磁場強度變化對黏蟲相關基因表達的影響及相應的分子機制,本研究利用亥姆霍茲線圈裝置產生近零磁場,使用Illumina技術,分別對近零磁場(小于500 nT)和地磁場(約54 000 nT)下飼養的黏蟲雌蛾和雄蛾進行轉錄組測序分析。結果表明:相對于地磁場,近零磁場下雌、雄蛾分別鑒定出1 670和1 401個差異表達基因,其中雌蛾鑒定出614個上調基因,1 056個下調基因;雄蛾鑒定出545個上調基因,856個下調基因;雌、雄蛾共同差異表達基因274個。GO功能分析和pathway結果顯示近零磁場脅迫與離子結合、催化和代謝等關鍵過程密切相關。對選取的10個差異基因進行熒光定量PCR驗證,證明了轉錄組測序分析結果準確可靠。本試驗為深入探究遷飛性昆蟲的地磁定向機制提供了理論基礎。
關鍵詞 :近零磁場; 地磁場; 黏蟲; 轉錄組
中圖分類號:
S 433.4
文獻標識碼: A
DOI: 10.16688/j.zwbh.2020013
Transcriptome analysis of the oriental armyworm Mythimna separata in
a near-zero magnetic field
YAN Mengmeng, ZHANG Lei, CHENG Yunxia, JIANG Xingfu*
(State Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193, China)
Abstract
In order to further explore the mechanism of magnetoreception of Mythimna separata and clarify the effects of magnetic field changes on the expression of related genes, transcriptome analysis of M.separata in a near-zero magnetic field was carried out. In this study, Helmhortz coils were used to generate a near-zero magnetic field, and the Illumina technology was used to sequence the transcriptome of M.separata moths (female and male) raised in near-zero magnetic field (less than 500 nT) and normal geomagnetic field (about 54 000 nT). The results showed that compared with geomagnetic field, 1 670 and 1 401 differentially expressed genes were identified in female and male adults under near-zero magnetic field, respectively, among which 614 up-regulated genes and 1 056 down-regulated genes were identified in female adults, and 545 up-regulated genes and 856 down-regulated genes were identified in male adults. There were 274 common differentially expressed genes in male and female adults. The gene ontology (GO) functional annotation and pathway enrichment analysis results showed that near-zero magnetic field was related to key biological processes, such as ion binding, catalysis activity and metabolism process. The results of qRT-PCR showed that the transcriptome was accurate and reliable. Our study provided a theoretical fundament for further study of the mechanism of magnetoreception in migratory insects.
Key words
near-zero magnetic field; geomagnetic field; Mythimna separata; transcriptome
與溫濕度、紫外線、CO2濃度一樣,磁場同樣是影響昆蟲生存的非生物因素之一[1],然而卻極易被人們忽略。地磁場作為地球上最基本的物理因素,時刻影響著地球上生物的發育與進化[2]。地磁場強度從赤道的約30 μT向兩極逐漸遞增到約65 μT,且其強度隨著時間和空間的變化而不斷變化。許多動物如魚類、鳥類、昆蟲等動物可依賴地球磁場進行洄游及飛行定向[35]。磁場的極性、強度和傾角都可以幫助昆蟲確定目的地的地理位置進而幫助昆蟲保持恒定航向[6]。磁場變化不僅會影響昆蟲的定向行為,還會對昆蟲生長發育產生影響,如磁場強度降低會延長棉鈴蟲Helicoverpa armigera和褐飛虱Nilaparvata lugens生長發育歷期,降低褐飛虱產卵量,影響其翅型分化等[78]。盡管近年來開展了許多磁感應研究,然而關于生物磁效應機制目前尚不明確[9]。
黏蟲Mythimna separata是我國重要的農業害蟲之一,每年在我國南北往返季節性遷飛[1011]。其遷飛過程中,不僅濕度和溫度在逐漸變化,地磁場強度和方向也在不斷變化。前人研究表明,黏蟲雌、雄蛾在人工模擬的強磁場、近零磁場下均沒有顯著的群體共同定向行為,且野外不同地區遷飛性黏蟲的定向方向不同,表明黏蟲可能根據磁場進行遷飛定向[1214]。因此,明確磁場變化對黏蟲的影響及黏蟲的地磁定向機制對黏蟲發生的預測預報具有重要意義。
近零磁場又稱為亞磁場,即屏蔽地磁場后產生的磁場強度接近零的磁場。近零磁場可用于揭示磁場強度降低對生物產生的影響及地磁場對生物的重要性[1516]。本研究通過直流電型亥姆霍茲線圈屏蔽地磁場,利用轉錄組測序技術探索黏蟲對近零磁場的分子響應機制,進一步挖掘磁感受相關基因,以期為深入研究遷飛性昆蟲的地磁定向機制提供理論依據。
1 材料與方法
1.1 供試蟲源及飼養條件
以本實驗室連續繁殖多代的黏蟲為供試蟲源,室內飼養條件為溫度(26±1)℃,相對濕度(70±10)%,光周期L∥D=14 h∥10 h,幼蟲飼養密度為10頭/罐(罐直徑9 cm,高13 cm),以人工飼料飼喂,幼蟲老熟后置于含水量為15%的土壤中化蛹,成蟲羽化后飼喂5%的蜂蜜水,取羽化后48 h的雌、雄蛾供試,并設置3次重復。
1.2 磁場發生裝置
磁場發生裝置由亥姆霍茲線圈和相連的兩個電源箱組成(中國科學院電工所制),亥姆霍茲線圈為正方體形,線框直徑為1 m,通過調節電源箱電流可在線圈中心區域(20 cm×20 cm×20 cm)內產生低于500 nT的磁場(近零磁場)。兩個磁場發生裝置放置在同一房間內(間隔3 m),一個用來產生近零磁場,另一個用來做假暴露以避免裝置帶來的誤差。每次試驗前及過程中均使用磁強計(CH-330F,北京翠海科技有限公司)檢測磁場強度。
1.3 黏蟲成蟲RNA提取
供試黏蟲從卵至成蟲分別放置在近零磁場和正常地磁場中飼養。分別收集正常地磁場下和近零磁場下羽化48 h的雌、雄蛾蟲體。不同磁場下每個性別各3個重復,共12個樣品。每個樣品由3頭黏蟲混合組成,液氮處理后儲存在-80℃超低溫冰箱中。以地磁場下黏蟲雌、雄蛾為對照,近零磁場下雌、雄蛾為處理組進行轉錄組測序,地磁場下雌、雄蛾樣品分別編號為GF1、GF2、GF3和GM1、GM2、GM3,近零磁場雌、雄蛾樣品分別編號為OF1、OF2、OF3和OM1、OM2、OM3。采用TRIzol法提取不同處理組樣品總RNA。1%的瓊脂糖凝膠電泳檢測RNA是否降解或污染,超微量紫外分光光度計(凱奧,K5500)檢測RNA的純度,使用安捷倫2100 RNA Nano 6000 Assay Kit(Agilent Technologies,CA, USA)檢測RNA樣品的完整性和濃度。
1.4 轉錄組測序及信息注釋
檢測合格的RNA樣品在北京安諾優達公司進行cDNA文庫構建以及Illumina平臺測序。測序完成后,通過去除低質量序列、去接頭等過程完成數據處理,得到高質量序列進行組裝。選取| log2Ratio |≥1和q<0.05的基因作為差異顯著表達基因。
1.5 GO功能分析
根據Gene Ontology數據庫(http:∥www.geneontology.org/),使用GO功能來分析差異基因(DEG)的主要功能。計算每個GO條目的差異基因數目,應用超幾何檢驗,找出與整個基因組背景相比,在差異表達基因中顯著富集的GO條目。其計算公式為P=∑m-1i=0(Mi)(n-Mn-i)(Nn),其中N為所有基因中具GO功能注釋的基因數目;n為N中差異表達基因的數目;M為所有基因中注釋到某特定GO條目的基因數目;m為注釋到某特定GO條目的差異表達基因數目。計算得到的P值經過校正后,以P<0.05為閾值,滿足P<0.05的GO條目為差異表達基因中顯著富集的GO條目。
1.6 pathway 富集分析
根據京都基因和基因組百科全書(KEGG)(http:∥www.genome.jp/kegg/),使用pathway分析確定差異表達基因的主要通路。以P<0.05為標準,對KEGG中每個pathway應用超幾何檢驗進行富集分析,找出差異表達基因中顯著富集的pathway。
1.7 qPCR定量分析
為驗證轉錄組測序的準確性,從測序結果中隨機選擇10個差異表達基因采用熒光定量PCR進行驗證。使用Beacon Designer設計基因特異性引物(表1),并由生工生物工程(上海)有限公司合成,以β-actin和18S rRNA為內參基因。將提取的RNA反轉錄合成cDNA第一條鏈;以合成的cDNA為模板,在Bio Rad 儀器上進行實時熒光定量PCR:35個循環,95℃變性15 s,60℃退火30 s,72℃延伸30 s。繪制熔解曲線,采用2-ΔΔCt法計算相對表達量。
1.8 數據統計
每個試驗用重復3次的樣品進行qPCR分析。文中數據均為平均值±標準誤(SE)。均值用單因素方差分析作比較。當P<0.05時為差異顯著。
2 結果與分析
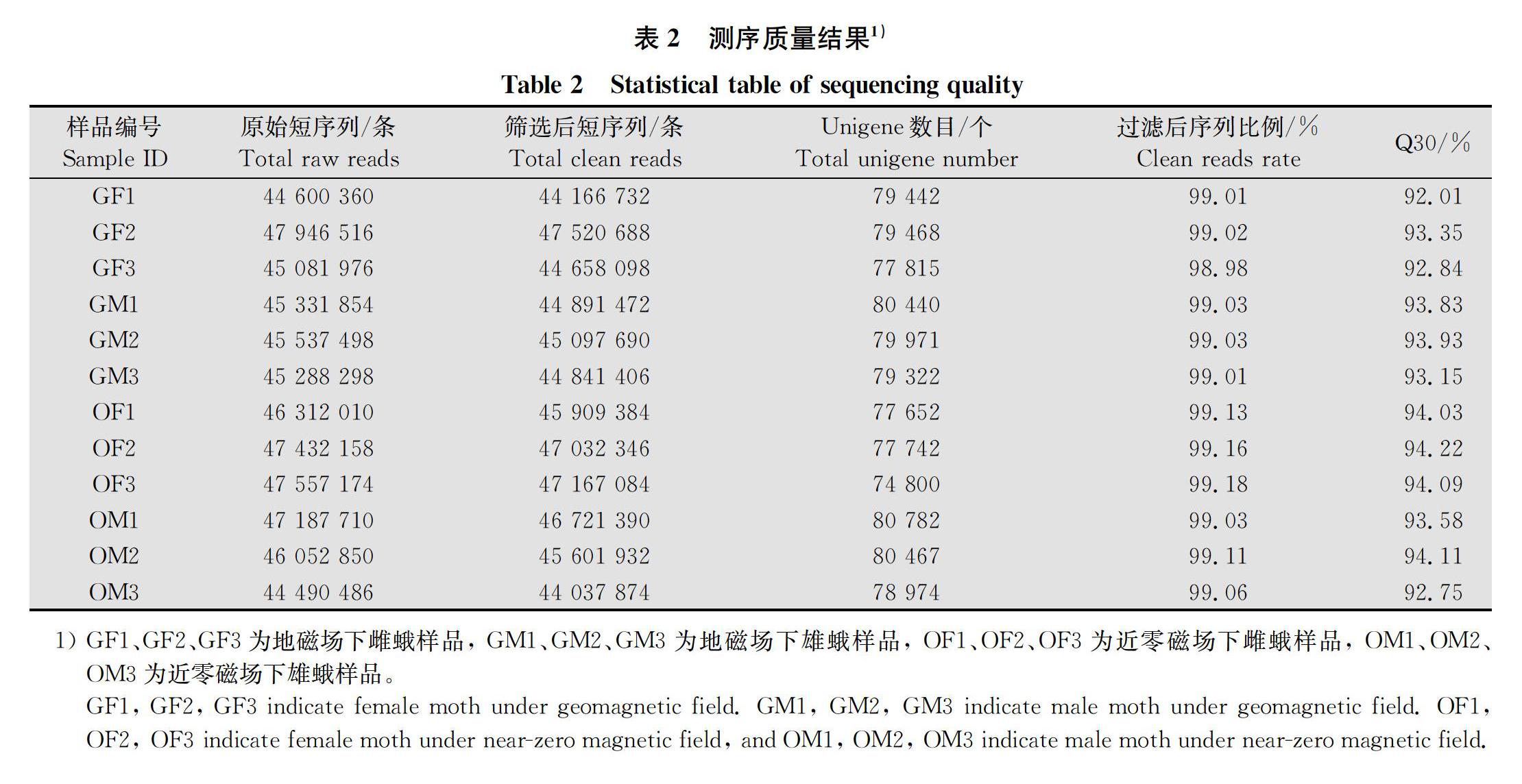
2.1 轉錄組組裝結果與質量評估
經檢測,樣品總RNA均滿足后續試驗分析要求。不同磁場下雌、雄蛾共12個樣本轉錄組測序數據統計結果見表2。過濾后的reads數占總數的98%
以上。各樣本的Q30(序列中質量大于30即錯誤率小于0.1%的堿基數的比例)均在92%以上,各樣本GC含量均在40%左右,測序結果準確度較高,可用于后續分析。
1) GF1、GF2、GF3為地磁場下雌蛾樣品, GM1、GM2、GM3為地磁場下雄蛾樣品, OF1、OF2、OF3為近零磁場下雌蛾樣品, OM1、OM2、OM3為近零磁場下雄蛾樣品。
GF1, GF2, GF3 indicate female moth under geomagnetic field. GM1, GM2, GM3 indicate male moth under geomagnetic field. OF1, OF2, OF3 indicate female moth under near-zero magnetic field, and OM1, OM2, OM3 indicate male moth under near-zero magnetic field.
2.2 差異表達基因分析
相對于地磁場,近零磁場下雌、雄蛾分別鑒定出1 670個和1 401個差異表達基因,其中雌、雄蛾分別鑒定出614、545個上調基因和1 056、856個下調基因(圖1~2)。其中雌、雄蛾共同差異表達基因274個。大部分差異表達基因的差異倍數分布在1倍~10倍之間,少部分差異倍數達到10倍以上。
2.3 GO功能分析
GO功能分析結果顯示(圖3),生物過程中,不同磁場下黏蟲雌雄蛾差異基因主要集中在催化、合成和代謝過程;在分子功能中雌、雄蛾分別有53個和24個顯著富集條目,大多為聚合酶、內切酶、水解酶、合成酶、核酸酶、還原酶和肽酶活性等;細胞組分中差異基因主要集中在細胞內和細胞質組分。
2.4 KEGG通路分析
在pathway分析中,除人類疾病外,雌蛾中細胞黏附分子通路富集到的差異基因最多,其次為AMPK信號通路、脂肪酸合成通路、細胞外基質受體交互作用通路、PI3K-Akt信號通路、嘌呤代謝、脂肪酸代謝、碳代謝、膽固醇代謝、神經活性配體—受體相互作用途徑。雄蛾中雷帕霉素信號通路富集到的差異基因最多,其次為脂肪酸代謝、甘氨酸、絲氨酸和蘇氨酸代謝、AMPK信號通路、細胞凋亡、自噬、脂肪酸合成,神經活性配體—受體相互作用途徑。
2.5 qRT-PCR驗證
從轉錄組中隨機挑選了10個差異表達基因進行熒光定量PCR驗證。結果表明差異基因定量表達結果與轉錄組測序結果一致(圖4),其中7個基因表現為一致下調,3個基因表現為一致上調。說明轉錄組測序具有較高的準確性和可靠性。
3 討論
自趨磁細菌發現以來,越來越多的國內外學者關注磁場的磁生物學效應。地磁定向是遠距離遷飛昆蟲的重要定向機制之一,也是目前生物磁效應研究熱點[17]。目前,廣泛認可的磁感應機制有兩種,即依賴光的自由基對假說和磁顆粒假說,兩種假說之間并不矛盾,兩者可能同時存在于生物體內[1819]。
在依賴光的自由基對假說中,藍光受體隱花色素CRYs被認為是最可能的磁感應受體。CRYs是紫外光和藍色光感受器,存在于植物和動物中,含有黃素腺嘌呤二核苷酸(FAD)發色團,在光活化后形成自由基對[2021]。磁場還被認為是一種授時因子[2126],CRY作為核心生物鐘基因,被認為參與了磁場影響果蠅晝夜節律的過程[27],同時CRY還參與介導磁場對果蠅趨地性、趨光性,交配行為等的影響過程[2829]。Mo等對近零磁場下培養的人神經瘤母細胞進行轉錄組測序,篩選到CRY2在近零磁場下差異表達[30],而在灰飛虱Laodelphax striatellus雌成蟲的轉錄組測序結果中,CRYs在地磁場和近零磁場下并不存在顯著差異表達[31]。在黏蟲雌雄蛾轉錄組測序結果中也未篩選到CRYs基因在地磁場和近零磁場下差異表達,這可能與CRYs的調控時間和作用位置有關。萬貴鈞研究表明白背飛虱Sogatella furcifera體內CRY1和CRY2對近零磁場的響應存在時間特異性,可能是CRYs的生物鐘功能和磁感受功能交互作用引起的[32]。
磁顆粒假說認為磁鐵礦物晶體存在于生物體內,外界磁場對生物體內鐵磁顆粒產生磁矩進而改變生物膜上的離子通道開關影響神經系統[19]。遷飛性昆蟲褐飛虱、鱗翅目昆蟲黑脈金斑蝶 Danaus plexippus體內均已發現鐵磁性物質[3334]。而黏蟲體內尚未發現存在鐵磁性物質。Fitak等通過轉錄組測序開展了虹鱒魚在基因水平對脈沖磁場的響應研究,發現與鐵吸收和轉運相關的ferritin基因參與虹鱒魚的磁感受過程[35]。對近零磁場下培養的灰飛虱雌蟲的轉錄組測序發現,與鐵吸收相關的MVL基因在灰飛虱雌成蟲中差異表達[31]。本研究發現黏蟲雄蛾體內與Fe轉運蛋白和鐵硫結合相關基因差異表達,雌、雄蛾中分別篩選到17個和8個與鐵離子轉運結合相關的差異表達基因,推測磁顆粒感受機制可能在黏蟲的磁響應過程中發揮作用。
在GO功能分析中,不同磁場下黏蟲雌、雄蛾差異表達基因大多富集在離子結合、代謝和酶活過程,表明近零磁場對黏蟲的生長發育也存在一定影響。這與前期研究發現近零磁場對黏蟲的生長發育存在負面影響一致(未發表數據)。本試驗中,近零磁場下黏蟲雌、雄蛾下調基因數量都多于上調基因,與人神經瘤母細胞的測序結果[30]相似,而近零磁場下的灰飛虱雌蟲轉錄測序得到數量相近的下調基因和上調基因[31],這可能是由于不同物種對近零磁場的響應存在特異性差異。近零磁場下雌、雄蛾轉錄組中,雌蛾比雄蛾多出269個差異基因,雌、雄蛾共同差異表達基因共274個,在GO功能分析的生物過程中,雌、雄蛾差異表達基因顯著富集到的生物途徑也有所不同,不同性別黏蟲可能對近零磁場的敏感性不同。
昆蟲的地磁定向機制是一個復雜的過程,不僅與地磁場強度有關,還可能與磁場的極性和磁傾角相關,而本試驗僅考慮了磁場強度,并未涉及磁傾角的變化。昆蟲的地磁定向機制應結合生物物理學、生態學、分子生物學、解剖學等多學科做進一步研究。
參考文獻
[1] MARKOV M S. Electromagnetic fields—A new ecological factor [M]∥MARKO M, MARTIN 13. Electromagnetic fields and biomembranes. Springer US, 1988.
[2] OCCHIPINTI A, DE SANTS A, MAFFEI M E. Magnetoreception: an unavoidable step for plant evolution? [J]. Trends in Plant Science, 2014, 19(1): 14.
[3] QUINN T P. Evidence for celestial and magnetic compass orientation in lake migrating sockeye salmon fry [J]. Journal of Comparative Physiology, 1980, 137(3): 243248.
[4] QUINN T P, BRANNON E L. The use of celestial and magnetic cues by orienting sockeye salmon smolts [J]. Journal of Comparative Physiology, 1982, 147(4): 547552.
[5] WILTSCHKO W, WILTSCHKO R. Magnetic orientation in birds [J]. The Journal of Experimental Biology, 1996, 199(1): 2938.
[6] LOHMANN K J, LOHMANN C M F, PUTMAN N F. Magnetic maps in animals: natures GPS [J]. The Journal of Experimental Biology, 2007, 210(21): 36973705.
[7] WAN Guijun, JIANG Shoulin, ZHAO Zongchao, et al. Bio-effects of near-zero magnetic fields on the growth, development and reproduction of small brown plant hopper, Laodelphax striatellus and brown plant hopper, Nilaparvata lugens [J]. Journal of Insect Physiology, 2014, 68: 715.
[8] 董兆克, 戈峰. 磁場對棉鈴蟲生長發育及繁殖的影響[J]. 生態學雜志, 2013, 32(5): 12651268.
[9] NORDMANN G C, HOCHSTOEGER T, KEAYS D A. Unsolved mysteries: Magnetoreception-a sense without a receptor [J/OL]. PLoS Biology, 2017, 15(10): e2003234. DOI:10.1371/journal.pbio.2003234.
[10]李光博. 我國黏蟲研究概況及主要進展[J]. 植物保護, 1993, 19(4): 24.
[11]江幸福, 張蕾, 程云霞, 等. 我國黏蟲發生危害新特點及趨勢分析[J]. 應用昆蟲學報, 2014, 51(6): 14441449.
[12]王偉弘, 張蕾, 程云霞, 等. 黏蟲飛行定向行為與不同磁場環境的關系[J]. 應用昆蟲學報, 2018, 55(5): 2835.
[13]高月波, 胡高, 翟保平. 磁場變化對黏蟲飛行定向行為的影響 [J]. 應用昆蟲學報, 2014, 51(4): 899905.
[14]謝殿杰. 粘蟲的定向行為及相關基因Cry2、MagR的功能驗證[D]. 北京: 中國農業科學院, 2018.
[15]BINHI V N, SARIMOY R M. Zero magnetic field effect observed in human cognitive processes [J]. Electromagnetic Biology and Medicine, 2009, 28(3): 310315.
[16]ZHANG Bin, LU Huimin, WANG Xi, et al. Exposure to hypomagnetic field space for multiple generations causes amnesia in Drosophila melanogaster [J]. Neuroscience Letters, 2004, 371(2/3): 190195.
[17]賀靜瀾, 萬貴鈞, 張明, 等. 生物地磁響應研究進展[J]. 生物化學與生物物理進展, 2018, 45(7): 689704.
[18]RITZ T, ADEM S, SCHULTEN K. A model for photoreceptor-based magnetoreception in birds [J]. Biophysical Journal, 2000, 78(2): 707718.
[19]FLEISSNER G, STAHL B, THALAU P, et al. A novel concept of Fe-mineral-based magnetoreception: histological and physicochemical data from the upper beak of homing pigeons [J]. Naturwissenschaften, 2007, 94(8): 631642.
[20]CASHMORE A R, JARILLO J A, WU Yingjie, et al. Cryptochromes: blue light receptors for plants and animals [J]. Science, 1999, 284(5415): 760765.
[21]GIOVANI B, BYRDIN M, AHMAD M, et al. Light-induced electron transfer in a cryptochrome blue-light photoreceptor [J]. Nature Structural Biology, 2003, 10(6): 489490.
[22]WEVER R. Influence of weak electromagnetic fields on the circadian periodicity of humans [J]. The Science of Nature, 1968, 55(1): 2932.
[23]BLISS V L, HHEPPNER F H. Circadian activity rhythm influenced by near zero magnetic field [J]. Nature, 1976, 261(5559): 411412.
[24]MURAVEIKO V M, STEPANYUK I A, ZENZEROV V S. The response of the crab Paralithodes camtschaticus (Tilesius, 1815) to geomagnetic storms [J]. Doklady Biological Sciences, 2013, 448(1): 1012.
[25]MARTIN H, KORALLl H, FRSTER B. Magnetic field effects on activity and ageing in honeybees [J]. Journal of Comparative Physiology A: Sensory Neural and Behavioral Physiology, 1989, 164(4): 423431.
[26]MO Weichuan, FU Jinpeng, DING Huimin, et al. Hypomagnetic field alters circadian rhythm and increases algesia in adult male mice [J]. Progress in Biochemistry and Biophysics, 2015, 42(7): 639646.
[27]YOSHII T, AHMAD M, HELFRICH, F C, et al. Cryptochrome mediates light-dependent magnetosensitivity of Drosophilas circadian clock [J/OL]. PLoS Biology, 2009, 7(4): e1000086. DOI:10.1371/journal.pbio.1000086.
[28]BAE J E, BANG S, MIN S, et al. Positive geotactic behaviors induced by geomagnetic field in Drosophila [J]. Molecular Brain, 2016, 9(1): 5567.
[29]FEDELE G, GREEN E W, ROSATA E, et al. An electromagnetic field disrupts negative geotaxis in Drosophila via a CRY-dependent pathway [J/OL]. Nature Communications, 2014, 5: 4391.DOI:10.1038/ncomms5391.
[30]MO Weichuan, LIU Ying, BARTLETT P F, et al. Transcriptome profile of human neuroblastoma cells in the hypomagnetic field [J]. Science China Life Sciences, 2014, 57(4): 448461.
[31]劉凡奇. 近零磁場下灰飛虱的生長發育表型與轉錄組學分析研究[D]. 南京: 南京農業大學, 2017.
[32]萬貴鈞. 病毒和磁場對稻飛虱發育、生殖及行為的影響研究[D]. 南京: 南京農業大學, 2015.
[33]解春蘭, 李志毅, 隋賀, 等. 褐飛虱成蟲體內磁性物質檢測[J]. 昆蟲學報, 2011, 54(10): 11891193.
[34]JONE D S, MACFADDEN B J. Induced magnetization in the monarch butterfly, Danaus plexippus (Insecta, Lepidoptera) [J]. Journal of Experimental Biology, 1982, 96: 19.
[35]FITAK R R, WHEELER B R, ERNST D A. et al. Candidate genes mediating magnetoreception in rainbow trout (Oncorhynchus mykiss) [J/OL]. Biology Letters, 2017, 13(4): 20170142.DOI:10.1098/rsbl.2017.0142.
(責任編輯:楊明麗)

