羅伊氏乳桿菌葡萄糖基轉(zhuǎn)移酶的生化特性及催化行為初探
趙新崎,繆銘
(食品科學(xué)與技術(shù)國家重點(diǎn)實(shí)驗(yàn)室(江南大學(xué)),江蘇無錫,214122)
膳食纖維是一類不被小腸中內(nèi)源性酶水解,但在結(jié)腸內(nèi)可被微生物發(fā)酵利用的碳水化合物,包括天然及合成兩類[1]。它具有調(diào)節(jié)血清中的血脂[2]、控制血糖濃度[3]、降低結(jié)腸癌發(fā)病率及改善免疫調(diào)節(jié)等諸多優(yōu)點(diǎn)[4-6]。近年來,膳食纖維的制備方法主要是化學(xué)法,TRITHAVISUP等[7]通過鹽酸水解及干燥等工藝制備木薯抗性糊精,MUDGIL等[8]采用纖維素酶酶解結(jié)合檸檬酸水解的方法制備部分水解的瓜爾豆膠,但這些方法存在成本高、得率低、安全性差以及易造成環(huán)境問題等缺點(diǎn)。酶法合成具有工藝簡(jiǎn)單、轉(zhuǎn)化率高及安全環(huán)保等優(yōu)點(diǎn),現(xiàn)已成為膳食纖維的研究熱點(diǎn)。
葡萄糖基轉(zhuǎn)移酶(glucosyltransferase,GTase)是一類對(duì)淀粉及其水解產(chǎn)物具有轉(zhuǎn)葡萄糖基作用的酶,GTase最初是在乳桿菌中被鑒定出來并被歸類于糖苷水解酶70家族(glucoside hydrolases 70,GH70)中1個(gè)新的亞家族。近年來,隨著研究的不斷深入,在西伯利亞桿菌、黃曲霉固氮菌及嗜熱鏈球菌中也發(fā)現(xiàn)了GTase的存在。GTase可以通過轉(zhuǎn)糖苷作用合成新的糖苷鍵如α-1,2糖苷鍵、α-1,3糖苷鍵及α-1,6糖苷鍵等[9],進(jìn)而提高不消化營(yíng)養(yǎng)片段的含量。本實(shí)驗(yàn)室前期研究得到了1株產(chǎn)GTase的羅伊氏乳桿菌,在此基礎(chǔ)上,本文對(duì)GTase的酶學(xué)性質(zhì)及其催化行為進(jìn)行了初步探究。以期為淀粉新型衍生物的創(chuàng)制及營(yíng)養(yǎng)健康產(chǎn)業(yè)的發(fā)展提供理論指導(dǎo)和技術(shù)支撐。
1 材料與方法
1.1 實(shí)驗(yàn)材料與試劑
羅伊氏乳桿菌,實(shí)驗(yàn)室保藏菌種;EscherichiacoliBL21 (DE3)、質(zhì)粒、胰蛋白胨、酵母提取物、氨芐青霉素、異丙基-β-D-硫代半乳糖糖苷,上海生工生物有限公司;馬鈴薯直鏈淀粉、糖化酶、豬胰腺α-淀粉酶,美國Sigma公司;麥芽糊精(DE12),上海羅蓋特公司;β-淀粉酶、異淀粉酶、異普魯蘭酶、葡萄糖試劑盒,愛爾蘭Megazyme公司。
1.2 實(shí)驗(yàn)儀器
Delta pH計(jì)(320 s型),美國Mettler-Toledo公司;電熱恒溫水槽(DK-8D型),上海森信實(shí)驗(yàn)儀器有限公司;紫外-可見光譜儀(722E型),上海翱藝有限公司;多角度激光散射系統(tǒng)(DAWN HELEOS-Ⅱ型),美國Watty公司;全數(shù)字化核磁共振波譜儀(Avance Ⅲ 400 MHZ型),美國Brucker公司;離子色譜儀(ICS 5000型),美國戴安公司。
1.3 實(shí)驗(yàn)方法
1.3.1 GTase的制備及純化
將已構(gòu)建的重組質(zhì)粒轉(zhuǎn)入E.coliBL21中表達(dá),然后將重組菌接種至含氨芐的LB液體培養(yǎng)基中,37 ℃過夜培養(yǎng)。然后吸取2%(體積分?jǐn)?shù))的接種液進(jìn)行下一步擴(kuò)大培養(yǎng),當(dāng)培養(yǎng)到適宜階段(OD660值0.4~0.5)時(shí),添加異丙基-β-D-1-硫代吡喃半乳糖苷誘導(dǎo)蛋白表達(dá)(18 ℃,24 h),最后于4 ℃離心(8 000 r/min,15 min)收取沉淀部分。經(jīng)蛋白復(fù)性、Ni2+親和色譜柱純化及冰浴透析得到脫鹽后的目的純酶液。SDS-PAGE實(shí)驗(yàn)中,上層膠的質(zhì)量濃度為120 g/L,下層膠的質(zhì)量濃度為40 g/L,采用的染色液為考馬斯亮藍(lán),脫色液為5%(體積分?jǐn)?shù))的乙醇和10%(體積分?jǐn)?shù))的乙酸溶液的混合物。
1.3.2 GTase酶活力測(cè)定
以0.25%(質(zhì)量分?jǐn)?shù))的馬鈴薯直鏈淀粉為底物,在乙酸鈉緩沖液(pH 5.0)中加入0.3 g/L的GTase進(jìn)行酶反應(yīng)(40 ℃,10 min),沸水浴滅酶10 min后將混合物離心(12 000 r/min,10 min)取上清液測(cè)定OD660值。
單位酶活力(U)定義為1 min消耗1 mg的直鏈淀粉所需的酶量[10]。
1.3.3 GTase酶學(xué)性質(zhì)
(1)為確定GTase的最適pH,在25 mmol/L的不同緩沖體系中,包括乙酸鈉緩沖液(pH 4.0~6.0)、Tris-HCl緩沖液(pH 6.0~8.0)和的甘氨酸-NaOH緩沖液(pH 8.0~11.0)于40 ℃進(jìn)行酶反應(yīng),以最高酶活力為100%。
(2)為研究pH對(duì)酶穩(wěn)定性的影響,將純酶液于不同緩沖液中在4 ℃下保存12 h后,于40 ℃下進(jìn)行酶反應(yīng),以相對(duì)初始酶活力為100%。
(3)為確定GTase的最適溫度,在不同溫度范圍(20~80 ℃)內(nèi)于pH 5.0的乙酸鈉(NaAC-HAC)緩沖液中進(jìn)行酶反應(yīng),以最高酶活力為100%。
(4)為研究溫度對(duì)GTase穩(wěn)定性的影響,將純酶液于恒溫水浴鍋(30~50 ℃)中保溫不同時(shí)間后進(jìn)行酶反應(yīng),緩沖體系為pH 5.0的NaAC-HAC緩沖液,以相對(duì)初始酶活力為100%。
(5)為確定各種金屬離子(Li+、Co3+、Pb2+、Ni+、Na+、Fe3+、K+、Al3+、Ba2+、Mn2+、Ca2+、Mg2+、Cu2+)對(duì)酶活的影響,分別添加不同金屬離子進(jìn)行酶反應(yīng)(pH 5.0,40 ℃)確保其終濃度為1 mmol/L,為確定Ca2+對(duì)GTase活力的影響,在添加終濃度為0~1.4 mmol/L Ca2+的條件下進(jìn)行酶反應(yīng),以未添加金屬離子時(shí)酶活力為100%。
(6)為研究GTase的動(dòng)力學(xué)參數(shù),以不同濃度的麥芽糊精(0.4~2 g/L)作為底物進(jìn)行酶反應(yīng)(40 ℃,pH 5.0),采用非線性回歸方法計(jì)算Michaelis-Menten常數(shù)(Km)和反應(yīng)的最大速度(vmax)。
1.3.4 GTase催化產(chǎn)物的合成
將麥芽糊精(DE12)以10 g/L的添加量置于乙酸鈉緩沖液(50 mmol/L,pH 5.0)中,使用高壓滅菌鍋(121 ℃,30 min)進(jìn)行糊化,然后將溶液轉(zhuǎn)移至恒溫循環(huán)水?dāng)嚢柩b置中冷卻至40 ℃后保溫。加入4 U/mL的GTase反應(yīng)72 h后,加入3倍體積的無水乙醇醇沉產(chǎn)物,離心并將乙醇揮發(fā)除去后冷凍干燥備用。
1.3.5 產(chǎn)物結(jié)構(gòu)解析
(1)高效尺寸排阻色譜-多角度激光散射-示差折光聯(lián)用(HPSEC-MALL-RI)分析。樣品用去離子水配制成5 g/L的溶液,用0.22 μm針頭式濾膜過濾,測(cè)試條件:采用Shodex OH-pak SB-804凝膠柱;流動(dòng)相為0.1 mol/L的NaNO3溶液;流速為0.5 mL/min[11]。
(2)核磁共振氫譜分析。準(zhǔn)確稱取30 mg樣品于核磁管中,加入0.5 mL D2O,加熱使樣品溶解。探針型號(hào):5 mm PABBO-BB,脈沖序列:zg30,測(cè)試溫度70 ℃。
(3)酶指紋圖譜法分析。采用的不同酶組合,組合Ⅰ:異淀粉酶;組合Ⅱ:異淀粉酶和β-淀粉酶;組合Ⅲ:異淀粉酶、β-淀粉酶和異普魯蘭酶,酶解樣品。用25 mmol/L的NaAC-HAC緩沖液(pH 4.0)將樣品配制成5 mg/mL的溶液,各組合中每種酶的添加量均為0.4 U,然后于40 ℃反應(yīng)24 h,沸水浴滅酶(10 min),離心(120 000 r/min,10 min),取上清液過0.22 μm針頭式濾膜。測(cè)試條件:采用CarboPacPA200型色譜柱;洗脫液A為NaOH溶液(150 mmol/L),洗脫液B為乙酸鈉溶液(50 mmol/L)與NaOH溶液(150 mmol/L)的混合液;測(cè)試溫度25 ℃。
1.3.6 產(chǎn)物消化性能分析
分別稱取麥芽糊精(DE12)及產(chǎn)物各0.1 g,分別溶于NaAC-HAC(50 mmol/L,pH 5.2)緩沖溶液中,加入豬胰腺α-淀粉酶(2 900 U)和糖化酶(150 U)后進(jìn)行酶反應(yīng)(37 ℃,160 r/min)。在反應(yīng)0、20及120 min取樣。吸取0.2 mL樣品后立即于1 mL無水乙醇中滅酶。采用葡萄糖試劑盒測(cè)定葡萄糖含量,具體操作可見說明書。其中易消化淀粉(rapidly digestible starch,RAS)、慢消化淀粉(slowly digested starch,SDS)和抗性淀粉(resistant starch,RS)含量的分別按公式(1)(2)(3)計(jì)算:
(1)
(2)
RS/%=100-RDS-SDS
(3)
式中:G20,水解20 min時(shí)葡萄糖的釋放質(zhì)量,mg;G120,水解120 min時(shí)葡萄糖的釋放質(zhì)量,mg;FG,游離葡萄糖的質(zhì)量,mg;TS,底物的葡萄糖總質(zhì)量,mg。
1.3.7 數(shù)據(jù)處理
各部分實(shí)驗(yàn)均重復(fù)3次,利用Origin 8.5軟件對(duì)實(shí)驗(yàn)數(shù)據(jù)進(jìn)行統(tǒng)計(jì)分析并作圖。
2 結(jié)果與討論
2.1 GTase分子質(zhì)量
為確定GTase的分子質(zhì)量,以標(biāo)準(zhǔn)蛋白的分子質(zhì)量的對(duì)數(shù)值為縱坐標(biāo),以標(biāo)準(zhǔn)蛋白在SDS-PAGE上的相對(duì)遷移率為橫坐標(biāo),得到標(biāo)準(zhǔn)曲線方程為:y2=-0.64x+5.27(r2=0.978)。
圖1為GTase的SDS-PAGE的電泳分析圖。在電泳圖中,GTase的的相對(duì)遷移量為1.22 cm,通過標(biāo)準(zhǔn)曲線方程計(jì)算出GTase的分子質(zhì)量為105 kDa。實(shí)驗(yàn)測(cè)得粗酶比酶活力為(0.15± 0.02)U/mL,純化后的比酶活力為(0.85± 0.03) U/mL。
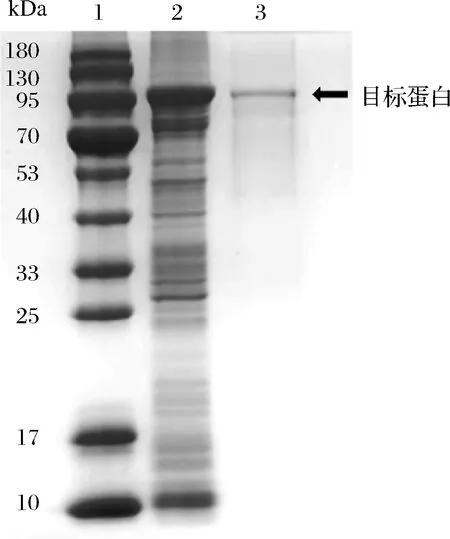
1-標(biāo)樣;2-粗酶;3-純酶圖1 葡萄糖基轉(zhuǎn)移酶的SDS-PAGE分析圖Fig.1 SDS-PAGE analysis of glucanotransferase
2.2 GTase酶學(xué)性質(zhì)研究
2.2.1 pH對(duì)GTase酶活力及穩(wěn)定性的影響
如圖2-a所示,40 ℃下GTase的最適pH為5.0;在pH 5.0~6.0,GTase能夠保持70%以上的酶活力;pH>8.0后,酶活迅速下降;當(dāng)pH為11.0時(shí),酶活僅剩20%。GTase與來源于Staphylothermusmarinus和LactobacillusgasseriATCC 33323的GTase具有相同的最適pH,溫和的酸性條件(5.0~6.0)有利于麥芽糊精的轉(zhuǎn)化[12-14]。目前為止報(bào)道的大多數(shù)GTase的最適pH為6.0~7.0[15-17],相比而言GTase較低的最適pH可能更適合應(yīng)用于淀粉工業(yè)。

圖2 pH對(duì)葡萄糖基轉(zhuǎn)移酶活力(a)及穩(wěn)定性(b)的影響Fig.2 Effect of pH on glucosyltransferase of activity(a)and stability(b)
如圖2-b所示,GTase在pH 7.0~8.5的環(huán)境中于4 ℃保存12 h后,仍具有80%以上的殘余酶活力。在pH 3.5~6.0及pH 9.0~11.0時(shí)酶活受到較強(qiáng)的抑制。由此可知,GTase的最佳保存pH為8.0,在該條件下保存12 h酶活力幾乎不變。
2.2.2 溫度對(duì)GTase酶活力及穩(wěn)定性的影響
如圖3-a所示,GTase的最適溫度為40 ℃,在35~45 ℃,酶活力仍保持在70%以上。在50 ℃后酶活力開始迅速下降,在80 ℃時(shí)幾乎為0。這可能是由于隨著溫度的升高,酶的結(jié)構(gòu)受到破壞導(dǎo)致的。
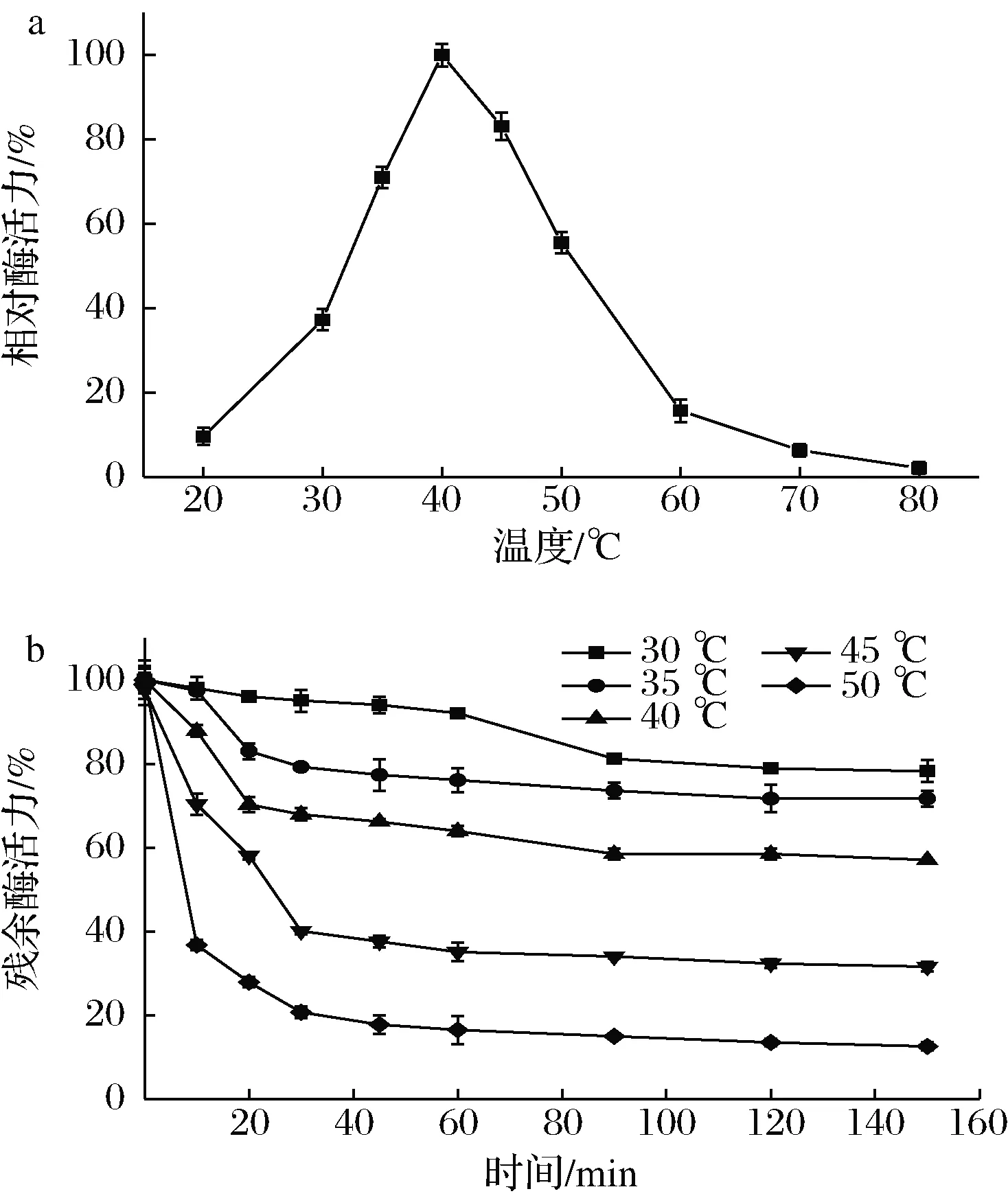
圖3 溫度對(duì)葡萄糖基轉(zhuǎn)移酶活力(a)及穩(wěn)定性(b)的影響Fig.3 Effect of temperature on glucosyltransferase of activity (a) and stability (b)
如圖3-b所示,在30~35 ℃下保存150 min,GTase殘余酶活力均在75%以上,當(dāng)溫度達(dá)40 ℃后,酶穩(wěn)定性迅速下降,在45 ℃下保存30 min后酶活力損失近60%,由此可知,該酶在30~40 ℃下熱穩(wěn)定性較好,可在此條件下實(shí)現(xiàn)麥芽糊精的轉(zhuǎn)化。
2.2.3 金屬離子對(duì)GTase酶活及穩(wěn)定性的影響
如圖4-a所示,Pb2+、Ba2+、Cu2+、Fe3+、Co3+和Al3+對(duì)酶活力具有不同程度的抑制作用,其中Fe3+對(duì)酶活力的抑制作用最強(qiáng),殘余酶活力僅剩30%。Na+和Ni2+對(duì)酶活力無明顯影響,Mn2+、Ca2+、Mg2+、Li+和K+對(duì)酶活力具有不同程度的促進(jìn)作用。其中Ca2+對(duì)酶活力的促進(jìn)作用最強(qiáng),可使酶活力達(dá)到210%,相比對(duì)照組提高了1倍多。來源于羅伊氏乳桿菌的SK24.003葡聚糖蔗糖酶也有類似的性質(zhì),在反應(yīng)中添加Ca2+后可使酶活力增加到原來的4倍[18]。這可能是由于它們的結(jié)構(gòu)中能夠形成與Ca2+結(jié)合的配體,從而激活了供/受體底物與酶的結(jié)合[19]。
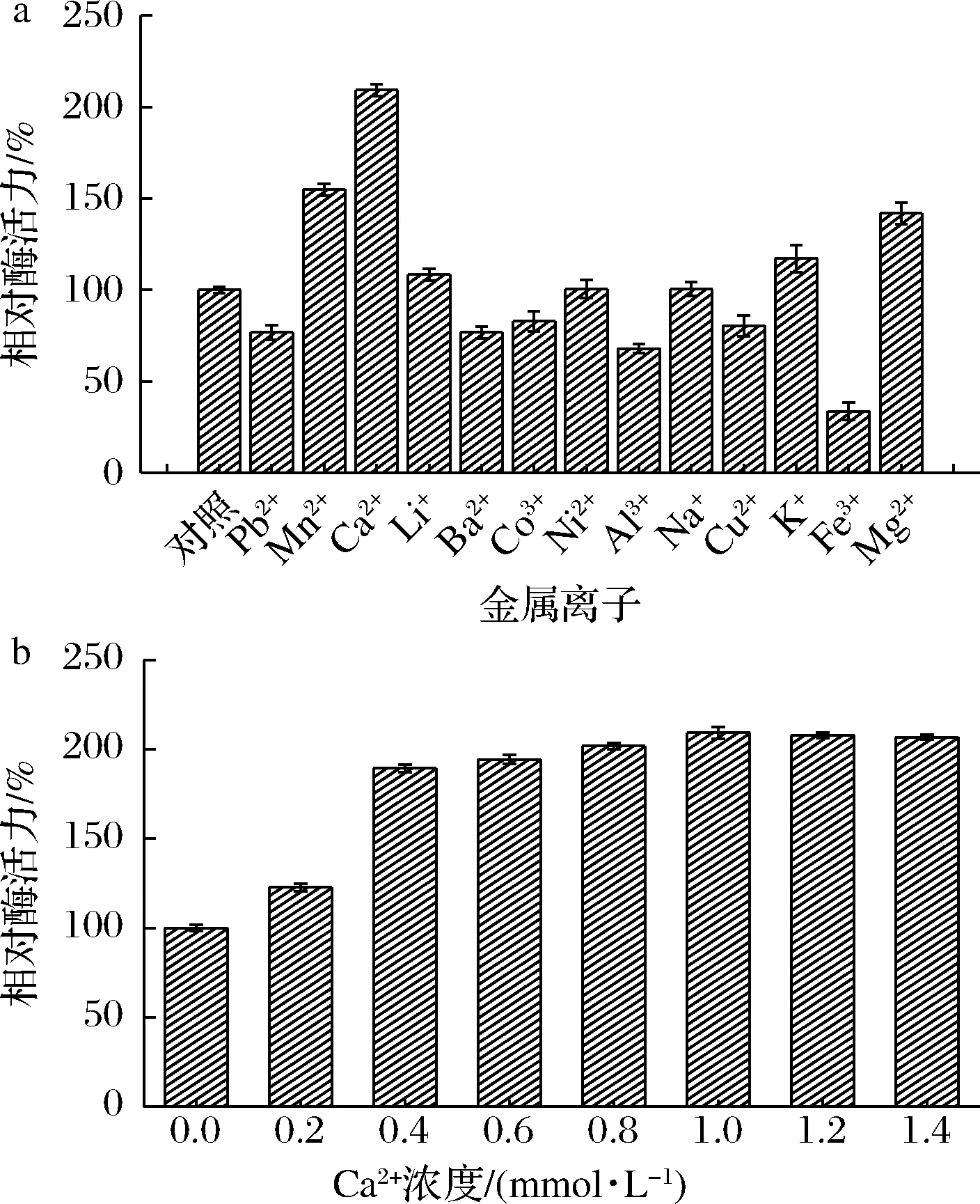
圖4 金屬離子(a)及Ca2+濃度(b)對(duì)葡萄糖基轉(zhuǎn)移酶活力的影響Fig.4 Effects of metal ion (a) and Ca2+ concentration (b) on the activity of glucosyltransferase
由圖4-b可知,當(dāng)Ca2+濃度在0~1.4 mmol/L,GTase酶活力隨著Ca2+濃度的增加而增加;當(dāng)Ca2+濃度>1 mmol/L時(shí),對(duì)酶的促進(jìn)作用不再增加。由此可知,Ca2+的濃度為1 mmol/L時(shí)對(duì)酶的激活作用最顯著,其原因可能是濃度高于1 mmol/L時(shí),該酶和Ca2+的結(jié)合達(dá)到飽和狀態(tài)。
2.2.4 酶反應(yīng)動(dòng)力學(xué)
底物濃度與酶促反應(yīng)速率之間的關(guān)系可以由Michaelis-Menten方程表示。Km值是酶的特征常數(shù)之一,它可以近似地反應(yīng)出酶與底物的親和力大小,通常來說Km值越小,親和力越大。以麥芽糊精(DE12)為底物,GTase的Km為(1.18±0.21)g/L,Vmax為2.6 μg/s,轉(zhuǎn)化率(Kcat)和催化效率(Kcat/Km)分別為(4.72±1.4)s-1和(3.97±3.2)L/(g·s),說明GTase對(duì)麥芽糊精(DE12)具有較高的親和力。
2.3 產(chǎn)物結(jié)構(gòu)
麥芽糊精(DE12)及其產(chǎn)物的核磁共振氫譜圖如圖5所示,樣品中α-1,6糖苷鍵的出峰位置在δ4.97 ppm,α-1,4糖苷鍵的出峰位置在δ 5.38 ppm,對(duì)峰面積進(jìn)行積分處理后得出2種糖苷鍵的比例。發(fā)現(xiàn)經(jīng)GTase反應(yīng)72 h后,α-1,6糖苷鍵的比例由(3.4±0.08)%增加至(41.8±0.12)%,提高了約12倍,說明GTase具有轉(zhuǎn)苷活性,可以很好的作用于麥芽糊精,并將其結(jié)構(gòu)中的α-1,4糖苷鍵轉(zhuǎn)化為α-1,6糖苷鍵。

圖5 麥芽糊精(DE12)(a)及其產(chǎn)物(b)的核磁共振氫譜圖Fig.5 1H NMR profiles of maltodextrin(DE12) (a) and its product (b)
GANGOITI等[20]曾報(bào)道過,利用來源于L.fermentumNCC2970的糖基轉(zhuǎn)移酶對(duì)淀粉進(jìn)行改性,產(chǎn)物中的α-1,3糖苷鍵可達(dá)40%,其主要是合成了α-1,4糖苷鍵與α-1,3糖苷鍵交替連接的結(jié)構(gòu)。
如圖6所示,麥芽糊精(DE12)的保留時(shí)間在14.1 min左右,經(jīng)GTase改性后的產(chǎn)物的保留時(shí)間有所滯后,大概在14.9 min,重均分子質(zhì)量由(1.16±0.07)×105g/mol降為(6.78±0.14)×104g/mol,這是由于GTase將麥芽糊精(DE12)水解成了相對(duì)分子質(zhì)量較小的產(chǎn)物。此外,產(chǎn)物的洗脫曲線分布范圍變窄,分子質(zhì)量分布曲線范圍變小,說明經(jīng)由GTase的改性產(chǎn)物相對(duì)分子質(zhì)量的分布更加均一。
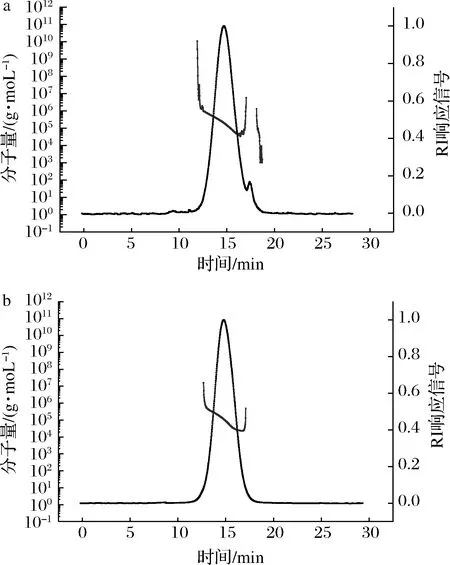
圖6 麥芽糊精(DE12)(a)及產(chǎn)物(b)的HPSEC-MALL-RI圖Fig.6 HPSEC-MALL-RI profiles of maltodextrin(DE12) (a) and product (b)
采用不同酶組合(Ⅰ、Ⅱ、Ⅲ)對(duì)產(chǎn)物進(jìn)行水解,其中異淀粉酶專一性切割α-1-4,6分支點(diǎn)處的α-1,6糖苷鍵;β-淀粉酶專一性切割線性α-1,4糖苷鍵,并將其水解為麥芽糖;異普魯蘭專一性切割α-1,6-葡萄糖-α-1,4結(jié)構(gòu)中的α-1,4糖苷鍵[21]。如圖7所示,在異淀粉酶(Ⅰ)的作用下,主要產(chǎn)生了2種片段:被α-1,6-葡萄糖-α-1,4結(jié)構(gòu)屏蔽了非還原性末端的糖鏈和未被屏蔽非還原性末端的糖鏈。這2種片段的分布范圍較寬,在1~12.5 min均有不同聚合度的片段被洗脫下來。在異淀粉酶和β-淀粉酶共同水解的作用下(Ⅱ),主要產(chǎn)生2種片段:麥芽糖和被α-1,6-葡萄糖-α-1,4結(jié)構(gòu)屏蔽了非還原性末端的糖鏈。在DP 2處有大量的麥芽糖被洗脫下來,在2.5 ~7.5 min,12.5~21 min被洗脫下來的片段為被α-1,6-葡萄糖-α-1,4結(jié)構(gòu)屏蔽非還原性末端,其聚合度主要分布在DP 2~DP 6,也有少數(shù)分布在DP 7~DP 12。異普魯蘭酶專一性切割α-1,6-葡萄糖-α-1,4結(jié)構(gòu)中的α-1,4糖苷鍵,這使得被α-1,6-葡萄糖-α-1,4結(jié)構(gòu)屏蔽非還原性末端的糖鏈重新暴露出來,因而可被β-淀粉酶水解。在異淀粉酶,β-淀粉酶和異普魯蘭酶的共同作用下,被洗脫下來的片段主要分布在DP 6以內(nèi)。從而解析出產(chǎn)物結(jié)構(gòu)中α-1,6糖苷鍵的主要存在形式有以分支點(diǎn)形式存在的α-1,6-葡萄糖-α-1,4結(jié)構(gòu)和α-1-4,6分支點(diǎn)及線性α-1,6糖苷鍵。
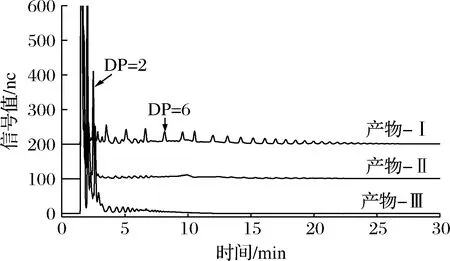
圖7 產(chǎn)物離子色譜圖Fig.7 HPAEC profiles of product
2.4 產(chǎn)物消化性能
根據(jù)淀粉的消化率和消化程度,淀粉可分為RDS、SDS和RS[22]。其中,SDS和RS在體內(nèi)能夠被緩慢吸收并持續(xù)釋放出能量,對(duì)人體健康有著積極的作用。經(jīng)GTase改性后產(chǎn)物中RDS的含量由83.95%降為57.99%,SDS和RS的含量均有不同程度的增加,其中SDS的含量提高了約8.73倍,RS的含量由14.89%提高至32.53%(表1),該結(jié)果與核磁共振氫譜分析得到的結(jié)果相一致,并驗(yàn)證了通過GTase的改性作用不僅可以改變產(chǎn)物營(yíng)養(yǎng)片段的組成,同時(shí)還能夠提高產(chǎn)物中不消化營(yíng)養(yǎng)片段的含量。據(jù)報(bào)道,利用α-D-葡聚糖支化酶對(duì)木薯淀粉改性10 h后,其產(chǎn)物中α-1,6糖苷鍵的比例增加了11.5%,SDS和RS的含量分別增加了47.3%和13.5%[23]。

表1 麥芽糊精(DE12)及其改性產(chǎn)物中不同營(yíng)養(yǎng)片段的含量Table 1 The content of different nutrition fractions in maltodextrin (DE12) and product
3 結(jié)論
本文對(duì)來源于羅伊氏乳桿菌的GTase的酶學(xué)性質(zhì)及催化行為進(jìn)行了初步的探究。GTase的最適溫度為40 ℃,最適pH為5.0,在pH為8.0的Tris-HCL緩沖液的穩(wěn)定性最好,可實(shí)現(xiàn)短期儲(chǔ)存。在研究的13種金屬離子中,Mn2+、Ca2+及Mg2+能夠促進(jìn)酶活,而Ba2+、Fe3+、Pb2+則會(huì)抑制酶活力。GTase同時(shí)具有轉(zhuǎn)苷及水解作用,其轉(zhuǎn)苷作用主要是引入了α-1,6-葡萄糖-α-1,4結(jié)構(gòu)及線性α-1,6糖苷鍵兩種結(jié)構(gòu)。麥芽糊精(DE12)經(jīng)GTase改性72 h后,α-1,6糖苷鍵的含量可達(dá)41.8%,RAS含量降低了25.96%,SDS及RS的含量分別提高了8.97%和17.76%。

