高效液相色譜-柱后光化學衍生法測定變性淀粉中黃曲霉毒素含量的研究
楊 娟
上海工微所科技有限公司,上海 200233
黃曲霉毒素(aflatoxins,AFT)是一種天然毒素,在很多食品中普遍存在,它毒性大,致癌性強,對人類健康危害極大[1]。目前常見的黃曲霉毒素有G2、G1、B2和B1。由于其結構穩定,在食物加工過程中不易被破壞,如不慎食用,對人體傷害極大,為了保障食品安全,我國國家標準GB 2761—2017《食品國家安全標準食品中真菌毒素限量》[2]中規定了黃曲霉毒素B1的最高限量,但未列出B2、G1和G2的限量要求,因此有必要建立一種快速簡便、穩定可靠的檢測黃曲霉毒素含量的方法,為食品中黃曲霉毒素的限量標準提供科學依據。
目前檢測黃曲霉毒素的方法很多,如液相色譜-質譜聯用法,液相色譜-柱前柱后衍生法,酶聯免疫法,薄層色譜法等[3],其中高效液相法/熒光檢測是較為常見的一種檢測方法,然而由于熒光檢測器對黃曲霉毒素具有選擇性,即對AFTB1和AFTG1的檢測靈敏度較低,所以需要通過柱前或柱后衍生增強其熒光性,提高檢測靈敏度[4]。而高效液相色譜-光化學衍生法是在高效液相色譜儀上連接光化學衍生器,利用環狀化合物在紫外光照射下能產生熒光這一特性[5],實現了對黃曲霉毒素的在線衍生和檢測,大大增強黃曲霉B1和G1的熒光強度,有效地提高了檢測效率[6]。
本試驗采用高效液相色譜-光化學柱后衍生法檢測變性淀粉中黃曲霉毒素G2、G1、B2和B1含量。變性淀粉使用乙腈-水溶液(84∶16,v/v)提取,提取液經免疫親和柱或多功能凈化柱凈化處理,用HPLC光化學衍生-熒光檢測器檢測樣品中黃曲霉毒素G2、G1、B2和B1含量,快速可靠。
1 材料與方法
1.1 材料與試劑
樣品:市售羥丙基二淀粉磷酸酯。
美國Beacon黃曲霉毒素總量免疫親和柱(上海安譜實驗科技股份有限公司);MycoSep 226多功能凈化柱(Romer國際貿易(北京)有限公司);黃曲霉標準品(G1:1.00 μg/mL;G2:0.300 μg/mL;B1:1.00 μg/mL;B2:0.300 μg/mL;上海安譜實驗科技股份有限公司);甲醇,乙腈(色譜純,DIKMA);氯化鈉,磷酸氫二鈉,磷酸二氫鉀,氯化鉀(分析純,上海凌峰化學試劑有限公司);吐溫-20,分析純(分析純,上海凌峰化學試劑有限公司)
1.2 儀器與設備
高效液相色譜儀配熒光檢測器(U3000,賽默飛世爾科技公司),柱后衍生裝置(SSIAllChrom Derivatization Unit柱后光衍生系統FCR-1,美國科學系統公司),電子天平(MS204TS,梅特勒-托利多儀器上海有限公司),超聲波清洗器(KQ-100,昆山市超聲儀器有限公司),離心機(TDL-5A,上海安亭科學儀器廠),固相萃取儀(Supelco SPE),漩渦混勻器(IKA VORTEX 3,德國IKA公司),隔膜真空泵(LH-95D,臨海市永昊真空設備有限公司),EFTT-DC12 防腐氮吹儀(上海安譜實驗科技股份有限公司),超純水機(RiOs Essential默克化工技術(上海)有限公司)。
1.3 實驗方法
1.3.1色譜條件
色譜柱:ZORBAX Eclipse XDB-C18;Analytical 4.6×250 mm 5-Micron.
流動相:乙腈∶甲醇∶水=10∶30∶60(v/v);
流速:1.0 mL/min;柱溫:40 ℃;進樣量:75.0 μL
熒光檢測器檢測波長:激發波長360 nm,發射波長440 nm;
1.3.2標準溶液的配制
用乙腈將標準品稀釋100倍,至黃曲霉毒素G2、G1、B2和B1濃度分別為3.00 μg/L、10.0 μg/L、3.00 μg/L和10.0 μg/L,再將儲備液逐步稀釋,即得標準系列溶液,見表1。
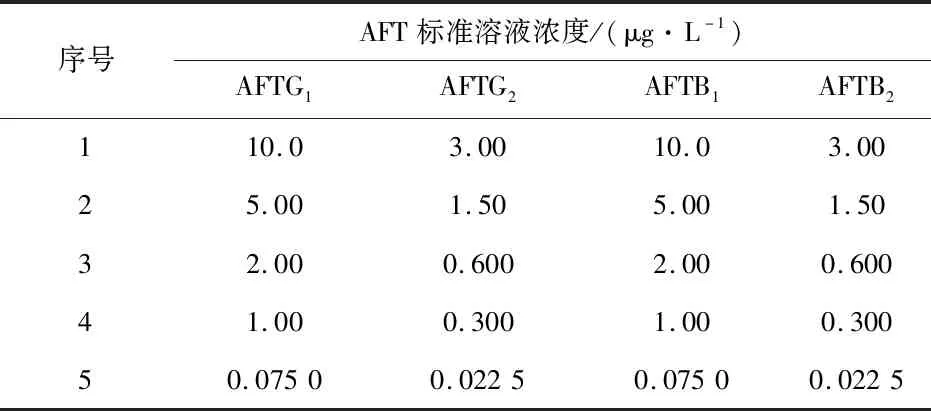
表1 黃曲霉毒素標準系列溶液濃度
1.3.3樣品處理
提取:稱取變性淀粉樣品5.00 g于50 mL離心管中,加入20.0 mL乙腈-水溶液(84∶16,v/v)提取,震蕩搖勻。超聲20 min,4 000 r/min離心5 min,過濾,備用。
免疫親和柱凈化:移取4.00 mL提取液,加入46 mL 1%吐溫-20的磷酸鹽緩沖液,混勻,將免疫親和柱連接上樣器,將上述混合液轉移至上樣器中,使液滴以2 mL/min速度下滴,試樣液滴完后用20 mL水淋洗親和柱,待水滴完后,抽干親和柱,棄去淋洗液,再用2 mL甲醇洗脫,收集洗脫液于離心管中。在50 ℃下氮吹至近干,冷卻后用0.40 mL流動相復溶,0.45 μm濾膜過濾,待測。
MycoSep 226多功能凈化柱凈化:移取提取液置多功能凈化柱凈化,取凈化液4.00 mL于離心管中。在50 ℃下氮吹至近干,冷卻后用0.40 mL流動相復溶,0.45 μm濾膜過濾,待測。
2 結果與分析
2.1 HPLC檢測色譜圖
AFTG2、AFTG1、AFTB2和AFTB1標準品的HPLC色譜圖見圖1。由圖1可知,AFTG2、AFTG1、AFTB2和AFTB1均達到了很好的基線分離,目標峰未出現變形、拖尾等現象,出峰時間分別在10.0 min、12.0 min、14.3 min和17.5 min。由表2可知,在0.075 0 μg/L~10.0 μg/L,AFTG1和AFTB1具有良好的線性關系。在0.022 5 μg/L~3.00 μg/L,AFTG2和AFTB2具有良好的線性關系,相關系數在0.999 3~0.999 7之間。

表2 黃曲霉毒素G2、G1、B2、B1的線性方程、線性范圍、相關系數和檢出限
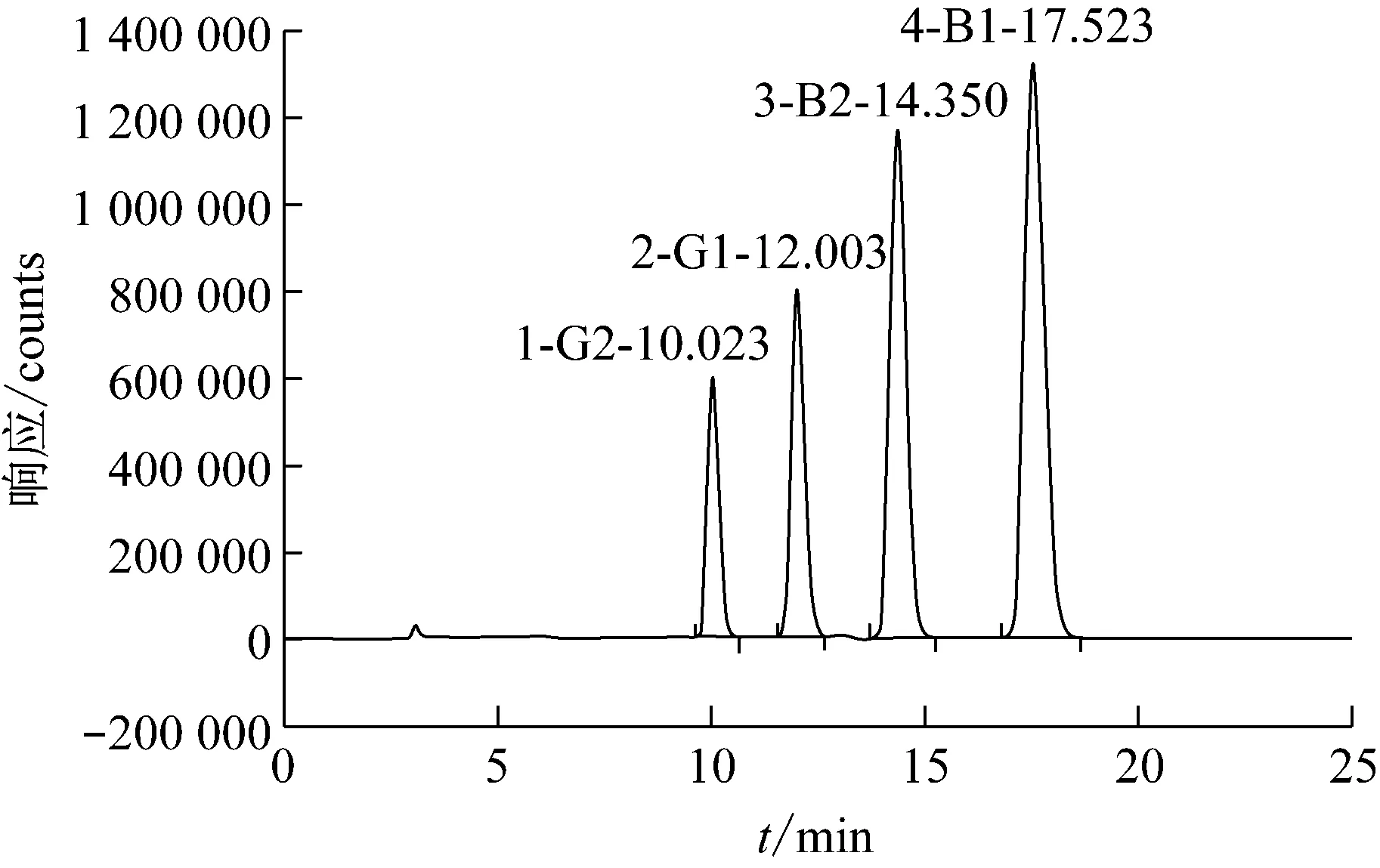
圖1 標準溶液色譜圖
2.2 檢出限
以3倍信噪比作為儀器檢出限,得出黃曲霉毒素G2、G1、B2和B1的儀器檢出限依次為0.022 5 μg/L、0.075 0 μg/L、0.022 5 μg/L和0.075 0 μg/L,方法檢出限為為0.010 0 μg/kg、0.030 0 μg/kg、0.010 0 μg/kg和0.030 0 μg/kg。
2.3 回收率
對變性淀粉樣品進行3個不同水平加標實驗,每個加標水平重復六次,按照1.3.3方法進行提取、凈化檢測,結果如表3所示。四種黃曲霉毒素在不同水平加標中,其平均回收率為96%~104%之間,相對標準偏差RSD為1%~3%之間,說明該方法能較好地檢測樣品中黃曲霉毒素含量,且重復性較好。
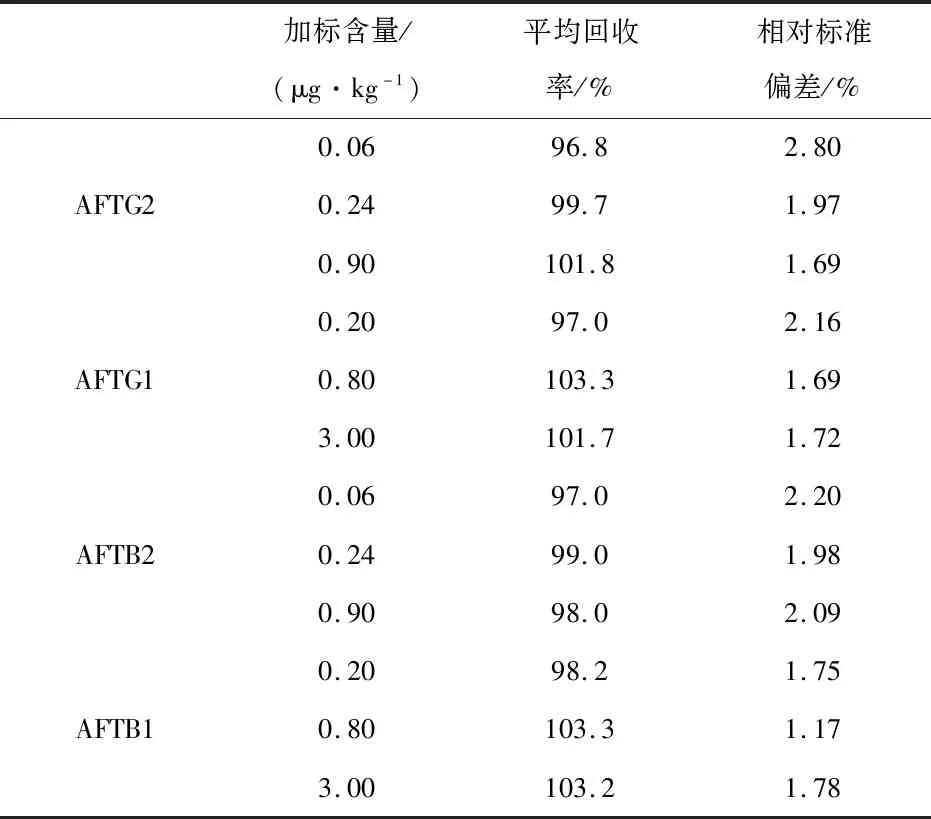
表3 黃曲霉毒素G2、G1、B2、B1的加標回收率(n=6)
2.4 與高效液相色譜-柱前衍生方法的比較
食品安全國家標準《食品中黃曲霉毒素B族和G族的測定》GB 5009.22—2016中[3]第二法(高效液相色譜-三氟乙酸柱前衍生法)和第三法(高效液相色譜-柱后光化學衍生法)是較為常見的兩種檢測方法。高效液相色譜-三氟乙酸柱前衍生法是基于使AFTB1和AFTG1的熒光性增強,解決了黃曲霉毒素B1和G1因靈敏度低而達不到痕量檢測要求的問題[7]。
圖2是高效液相色譜-三氟乙酸柱前衍生法所得的色譜圖。由圖可知,柱前衍生法的檢測時間為35 min,而柱后光化學衍生的檢測時間為25 min,提高了檢測效率。同時減少了三氟乙酸、正己烷等有害試劑的使用。兩種方法色譜圖均能達到較好的分離,且回收率較好。
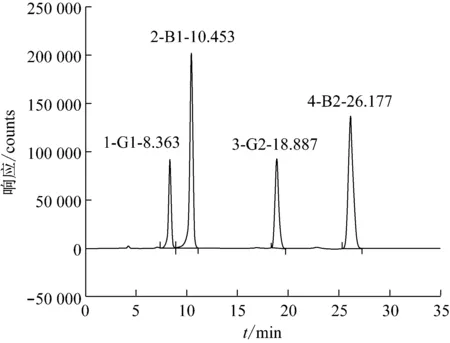
圖2 黃曲霉毒素標準溶液柱前衍生色譜圖
2.5 免疫親和柱與多功能凈化柱的比較
黃曲霉毒素常用的凈化方式有免疫親和柱和多功能凈化柱[8]。本試驗比較了免疫親和柱及MycoSep 226多功能凈化柱對測定變性淀粉中黃曲霉G2、G1、B2、B1的凈化效果。選擇變性淀粉作為樣品并進行加標實驗,采用上述兩種凈化柱分別凈化,得到的樣品色譜圖如圖3所示。
由圖3B可見,經過免疫親和柱凈化的樣品,基本可以消除雜質對黃曲霉毒素的干擾問題。兩種凈化柱測定樣品中黃曲霉毒素B1的含量分別為0.063 8 μg/kg和0.065 8 μg/kg,相對標準偏差為2.18%,說明兩種凈化柱得出的數據沒有顯著差異,均能用于檢測變性淀粉中黃曲霉毒素時的凈化。然而,采用MycoSep 226多功能凈化柱凈化,在目標峰前面出現大量雜峰,而免疫親和柱能夠特異性的吸附樣品中的黃曲霉毒素,使其與雜質分離,大量雜質被淋洗除去,因此,相對來說免疫親和柱凈化效果更好,檢測靈敏度更高。總體而言,免疫親和柱凈化去除機制干擾能力較強,凈化效果好;而多功能凈化柱操作簡單,價格便宜[7]。
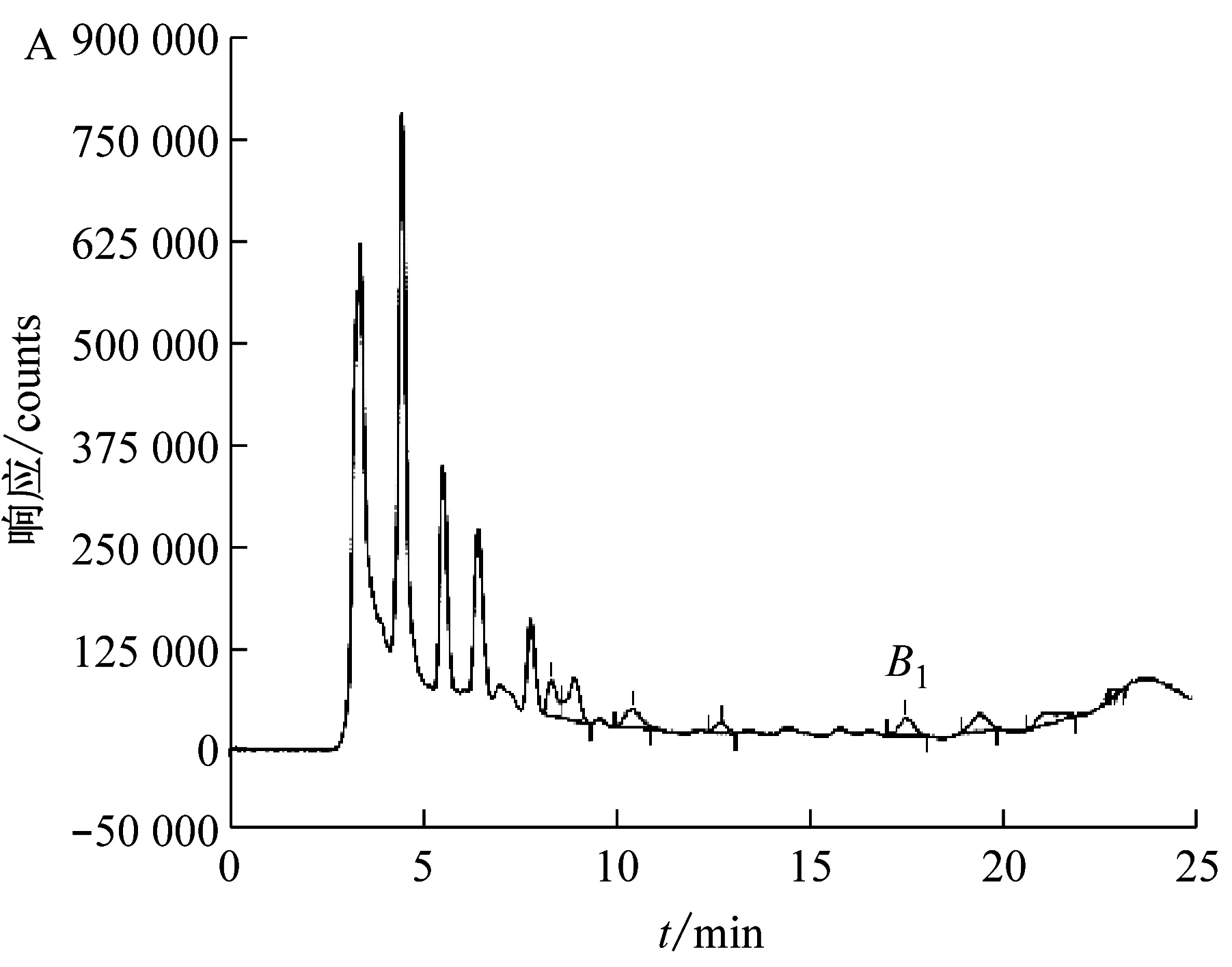
(A:MycoSep 226多功能凈化柱樣品;B:免疫親和柱樣品;C:MycoSep 226多功能凈化柱樣品加標;D:免疫親和柱樣品加標)圖3 不同凈化柱對變性淀粉中黃曲霉毒素G2、G1、B2、B1凈化效果的比較
3 結論
本方法采用高效液相色譜-光化學衍生法測定變性淀粉中黃曲霉毒素G2、G1、B2和B1含量,試驗通過改變流動相比例,樣品凈化方法以及柱前衍生法和柱后光化學衍生法的方法進行對比。結果表明,與國標GB 5009.22—2016相比,采用本實驗的流動相比例(乙腈∶甲醇∶水=10∶30∶60,v/v)縮短了儀器檢測時間,且分離度較好。多功能凈化柱和免疫親和柱均能用于黃曲霉毒素的凈化,兩者測定結果無顯著差異,相對于柱前衍生,柱后光化學衍生法能很大程度上節省儀器檢測時間和檢測成本,且能減少化學試劑對檢測人員的傷害。因此,采用乙腈-甲醇-水作為流動相,多功能凈化柱或免疫親和柱凈化,柱后光化學衍生,能有效檢測變性淀粉樣品中黃曲霉毒素G2、G1、B2和B1的含量,且該方法簡便,快速,檢測成本較低,對檢測人員傷害較小。

