透明質酸產生菌的紫外誘變及發酵工藝的優化
季旭,趙帥東,周滟晴,張佳卉,劉婷,汪立平,2,3*
1(上海海洋大學 食品學院,上海,201306) 2(農業部水產品貯藏與保鮮質量安全風險評估實驗室(上海),上海,201306) 3(上海海洋大學 食品熱加工工程技術研究中心,上海,201306)
透明質酸(hyaluronic acid,HA)是由D-葡萄糖醛酸和N-乙酰氨基葡糖的雙糖單位聚合而成的酸性黏多糖,通過β-1,3和β-1,4糖苷鍵連接[1]。由于其獨特的流變學特性、生物相容性及非免疫原性,被廣泛應用于醫藥、化妝品和保健食品等領域[2-3]。隨著需求量的日益增大,HA的市場價值預計在2025年會達到154億美元[4]。目前,HA主要有2種生產方法,即動物組織提取法和微生物發酵法。微生物發酵生產較傳統提取法有不受動物原料資源限制、易于大規模生產、無動物源致病病毒感染的危險和分離純化成本低等優點[5-6],已成為工業化生產HA的主要方式。在工業上,HA的常用生產菌株為獸疫鏈球菌和馬鏈球菌[7],產量可達到6~7 g/L[8],但同時產生透明質酸酶和鏈球菌溶血素,其中透明質酸酶會降低HA的產量[9],鏈球菌溶血素可引起溶血[10]。近年來,以安全的(generauy recognized as safe,GRAS)微生物菌株為生產菌株發酵生產HA,成為一種比較理想的替代選擇[11]。如枯草芽孢桿菌[12]、乳酸菌[13]、大腸桿菌[14]和谷氨酸棒桿菌[15]等,但是重組菌株的HA生產成本相對較高[4]。IZAWA等[16-17]通過GRAS菌株嗜熱鏈球菌發酵生產HA,優化發酵條件后的HA產量為208 mg/L。由于此類GRAS菌株的HA產量較低,這極大地限制了工業應用。因此,通過菌株的誘變選育和發酵工藝的優化來提高GRAS菌株的HA產量勢在必行。
本研究以實驗室保藏GRAS透明質酸產生菌株BacillusvelezensisZ1為出發菌株,通過紫外誘變,篩選出高產HA且穩定性良好的突變株,對其搖瓶發酵的培養基成分與發酵條件進行優化,以期進一步提高其HA產量。
1 材料與方法
1.1 材料
1.1.1 菌株
貝萊斯芽孢桿菌(Bacillusvelezensis)Z1,本實驗室保藏,從豬鼻黏膜中分離得到。
1.1.2 培養基
血瓊脂平板培養基(g/L):牛肉浸膏10.0,胰蛋白胨5.0,NaCl 5.0,瓊脂15.0,pH值為7.0,在121 ℃下滅菌20 min,待冷卻至50 ℃,在無菌條件下加入5%無菌脫纖維羊血。
透明質酸培養基(g/L):胰蛋白胨15.0,酵母粉5.0,K2HPO4·3H2O 2.0,MgSO4·7H2O 0.5,HA 1.0,瓊脂20.0,pH值為7.0,在121 ℃下滅菌20 min。
種子培養基(g/L):葡萄糖12.5,酵母浸膏12.5,胰蛋白胨12.5,MgSO4·7H2O 0.5,KH2PO42.0,pH值為7.0,在121 ℃下滅菌20 min。
發酵基礎培養基(g/L):葡萄糖40.0,牛肉浸膏10.0,胰蛋白胨10.0,MgSO4·7H2O 1.0,KH2PO42.0,pH值為7.0,在121 ℃下滅菌20 min。
1.2 實驗方法
1.2.1 培養方法
種子培養:挑取2~3環初始菌株,接入裝有50 mL種子培養基的250 mL錐形瓶中,150 r/min,37 ℃振蕩培養。
搖瓶發酵:按體積分數10%的接種量將種子液接入裝有100 mL發酵培養基的500 mL錐形瓶中,150 r/min,37 ℃振蕩培養。
1.2.2 紫外誘變實驗
(1)菌懸液的制備:將菌株Z1接入種子培養基中培養12 h,菌液經4 200 r/min離心10 min,棄上清液,用無菌生理鹽水洗滌2次,再重懸于無菌生理鹽水中,調整菌懸液濃度至107CFU/mL,并放在無菌環境中保存備用[18]。
(2)紫外誘變與突變株的篩選:紫外燈功率為30 W,照射距離為30 cm,需提前預熱20 min。將5 mL的菌懸液和無菌回形針放入直徑為6 cm的無菌培養皿中,并置于磁力攪拌器上攪拌。照射時間分別為0、20、40、50、60、70、80、100 s。誘變結束后,倒入新的種子培養基,在暗室內37 ℃靜置培養12 h,以避免光復活對誘變的影響[19]。將所得菌液梯度稀釋至10-4~10-6倍,各取100 μL涂布于血瓊脂平板上,在避光條件下,37 ℃培養24 h。按公式(1)計算致死率[20]:

(1)
在血瓊脂平板上挑取菌落直徑與黏度較大的菌株,再劃線于透明質酸平板上,選取不產生透明圈的單菌落,種子培養14 h,搖瓶發酵16 h,測定HA產量,篩選出產量較高菌株。
(3)突變株的傳代穩定性實驗:將篩選到的突變株作為第1代接種到血瓊脂平板上,傳代至第4代,并測定搖瓶發酵后的HA產量,進一步篩選出產量較高且穩定的突變株。
1.2.3 發酵工藝的優化
1.2.3.1 發酵培養基成分的優化
將HA產量較高且穩定的突變株接入種子培養基,種子培養14 h,再搖瓶發酵24 h,測定HA產量。
單因素試驗:
(1)碳源:以初始發酵培養基為基礎,改變其中的葡萄糖質量濃度(20、40、60、80、100 g/L),測定HA產量。
(2)氮源:以初始發酵培養基為基礎,選擇胰蛋白胨和牛肉浸膏進行復配[21],測定HA產量。
(3)無機鹽:以初始發酵培養基為基礎,分別考察MgSO4·7H2O質量濃度(0.5、1.0、1.5、2.0、2.5 g/L)和KH2PO4質量濃度(1.0、1.5、2.0、2.5、3.0 g/L)對HA產量的影響。
響應面優化:
在發酵培養基成分單因素試驗的基礎上,根據Box-Behnken設計原理,選取葡萄糖質量濃度、胰蛋白胨質量濃度、牛肉浸膏質量濃度和MgSO4·7H2O質量濃度4個因素,HA產量為響應值,進行響應面試驗。
1.2.3.2 發酵條件的優化
單因素試驗:
(1)裝液量:在培養基成分優化的基礎上,以不同的裝液量(60、80、100、120、140 mL)裝入錐形瓶中,測定HA產量。
(2)初始pH值:在培養基成分優化的基礎上,改變發酵培養基的初始pH值(6.2、6.6、7.0、7.4、7.8),測定HA產量。
(3)溫度:在培養基成分優化的基礎上,調整發酵溫度(31、33、35、37、39 ℃),測定HA產量。
(4)搖床轉速:在培養基成分優化的基礎上,調整搖床轉速(50、100、150、200 r/min),測定HA產量。
正交優化:
根據發酵條件單因素試驗結果,確定裝液量、初始pH值、溫度和搖床轉速的因素水平,進行4因素3水平的正交優化試驗。
1.2.4 HA產量的測定
參照Bitter-Muir法[22]。取5 mL發酵液,4 200 r/min離心15 min,上清液加入2倍體積的無水乙醇,4 ℃靜置1 h,再次離心取沉淀,加入一定體積的去離子水,振蕩溶解,然后進行HA產量的測定。
1.2.5 數據處理
每組試驗均有3個平行。采用軟件Design-Expert V 8.0.6進行響應面的數據分析與處理。采用軟件SPSS Statistics 21.0進行正交試驗設計與處理。采用Origin Pro 9.0軟件繪圖。
2 結果與分析
2.1 紫外誘變
2.1.1 紫外誘變時間的確定
由圖1可知,隨著紫外照射時間的增加,菌株致死率也在不斷提高。據文獻報道,致死率一般應控制在80%~90%為宜[23]。當照射時間為60 s時,菌株致死率為82.88%,70~100 s時,致死率均在90%以上。因此,確定紫外照射時間60 s為菌株Z1的最佳誘變時間。
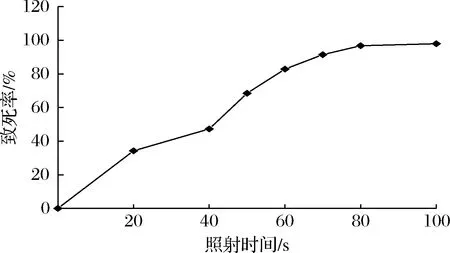
圖1 紫外誘變時間對B.velezensis Z1致死率的影響Fig.1 Effect of UV mutation time on the mortality of B.velezensis Z1
2.1.2 高產HA突變株的篩選
菌株Z1的菌懸液經過紫外照射60 s后,涂布于血瓊脂平板37 ℃培養24 h。在血瓊脂平板上挑取菌落直徑較大、黏度較大的單菌落[5,24],搖瓶發酵后測定其HA產量,各突變株的HA產量如表1所示。其中,突變株ZV2、ZV7、ZV13的HA產量提高了5%~10%,突變株ZV1、ZV3、ZV11、ZV12的HA產量提高了10%~25%,正突變率達到41.18%。
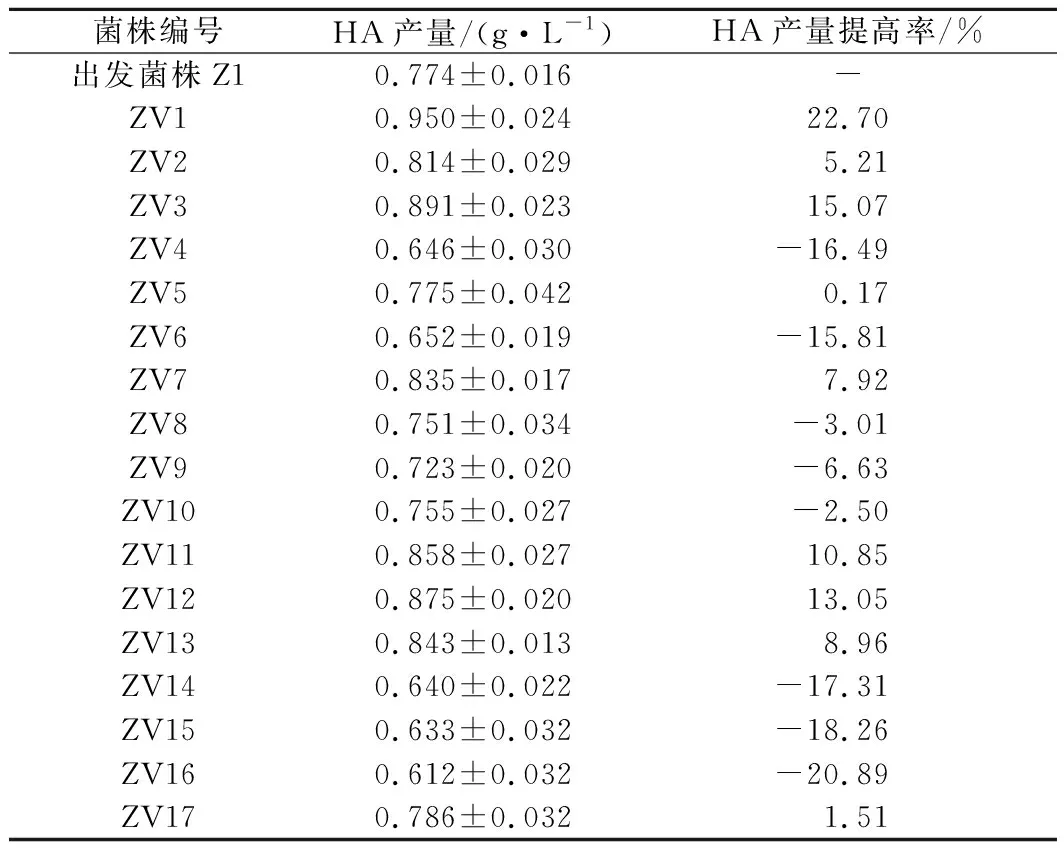
表1 突變株的HA產量Table 1 The HA yield of the mutant strains
由前期實驗可知,出發菌株Z1在透明質酸平板上有輕微的透明圈產生,紫外誘變后,將上述4株突變株分別在透明質酸平板上劃線,菌落周圍無透明圈產生,表明這些突變株均為透明質酸酶陰性菌株,不產透明質酸酶,這有利于維持HA產量的穩定。
2.1.3 高產HA突變株的遺傳穩定性
對HA產量提升較大的突變株(ZV1、ZV3、ZV11、ZV12)進行穩定性試驗,共傳代4次,經過搖瓶發酵測定HA產量,結果如圖2所示。其中,突變株ZV1的HA產量在每一代中相比于其他突變株較高,其產HA能力無顯著性差異(P>0.05),說明該菌株具有穩定的遺傳性。因此,選取突變株ZV1進行發酵工藝的優化。
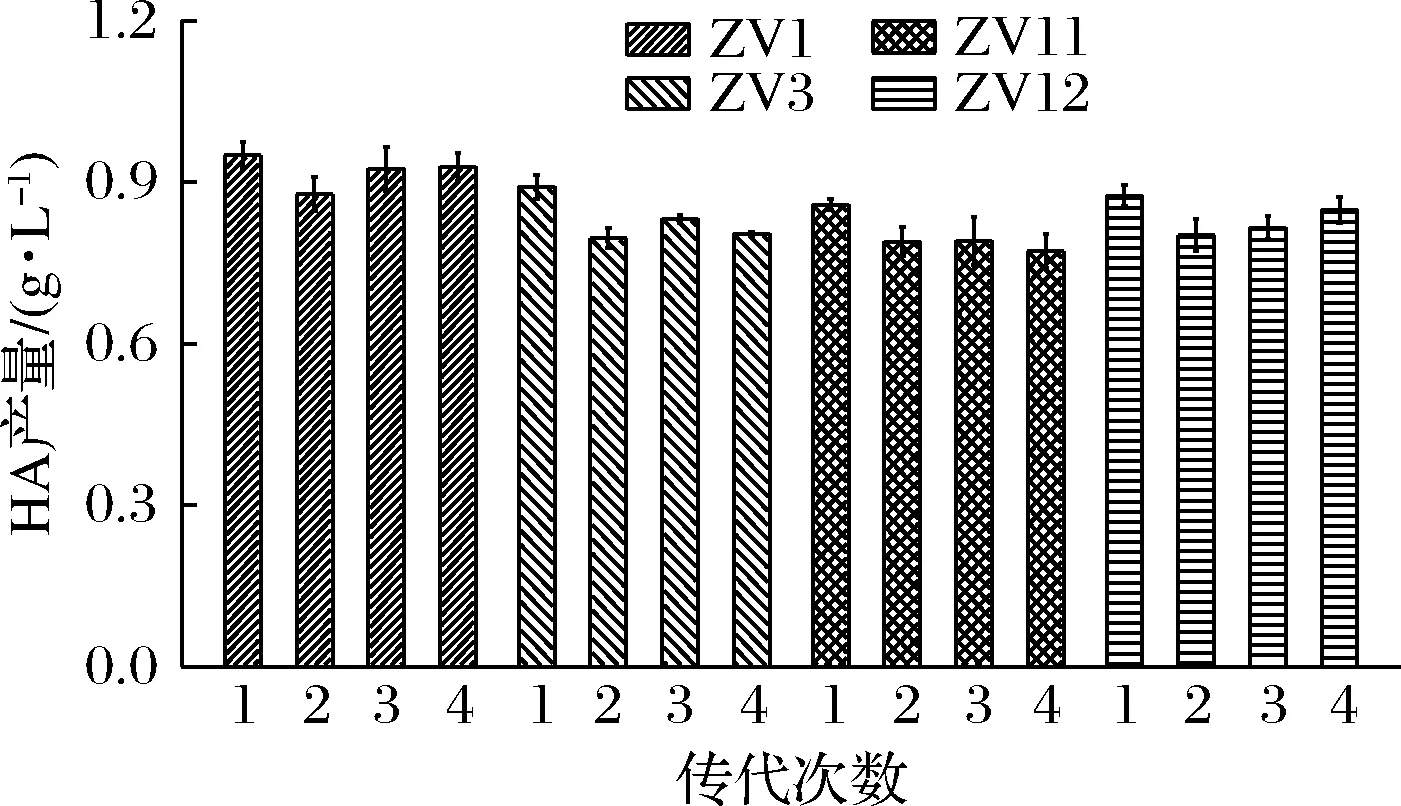
圖2 突變株的傳代穩定性Fig.2 The genetic stability of the mutant strains
2.2 發酵培養基成分的優化
2.2.1 單因素試驗
對于碳源而言,以葡萄糖為單一碳源時,突變株ZV1發酵生產HA的效果較好,與之前的研究相似[25]。以初始發酵培養基為基礎,不同葡萄糖質量濃度對HA產量的影響如圖3-a所示。當葡萄糖質量濃度增加到60 g/L時,HA產量最高,確定葡萄糖質量濃度優選為60 g/L。
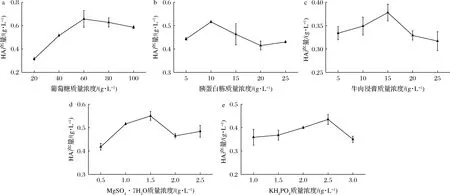
a-葡萄糖;b-胰蛋白胨;c-牛肉浸膏;d-MgSO4·7H2O;e-KH2PO4圖3 培養基成分對B.velezensis ZV1 HA產量的影響Fig.3 The effect of medium components on HA yield of B.velezensis ZV1
對于氮源而言,經預實驗發現,選擇多種氮源進行復配,更有利于HA產生菌株的發酵生產[21]。復配方式:牛肉浸膏質量濃度10 g/L,與不同質量濃度的胰蛋白胨進行復配添加;胰蛋白胨質量濃度10 g/L,與不同濃度的牛肉浸膏進行復配添加,復配氮源對HA產量的影響如圖3-b和圖3-c所示。在胰蛋白胨質量濃度達到10 g/L之后,HA產量開始降低,確定胰蛋白胨質量濃度優選為10 g/L;在牛肉浸膏質量濃度達到15 g/L之前,HA產量在不斷增加,隨后HA產量開始下降,確定牛肉浸膏質量濃度優選為15 g/L。
對于無機鹽而言,在合成HA的過程中,適當質量濃度的Mg2+可保證菌體的生長和HA的生產,K+可用于維持細胞內環境的穩定[19]。分別考察MgSO4·7H2O和KH2PO4質量濃度對HA產量的影響,結果如圖3-d和圖3-e所示。不同質量濃度的MgSO4·7H2O對HA產量有顯著性差異(P<0.05),
MgSO4·7H2O的質量濃度為1.5 g/L時,HA產量達到最大值,為0.55 g/L;不同KH2PO4質量濃度下,HA產量在0.35~0.44 g/L之間,說明KH2PO4質量濃度對于HA產量的影響可忽略,與CHEN等[10]的研究相似。
2.2.2 響應面法設計及結果分析
根據單因素試驗結果,選取葡萄糖質量濃度、胰蛋白胨質量濃度、牛肉浸膏質量濃度和MgSO4·7H2O質量濃度作為4個因素。利用Box-Behnken中心組合設計原理,對4因素3水平進行響應面分析,試驗結果見表2。
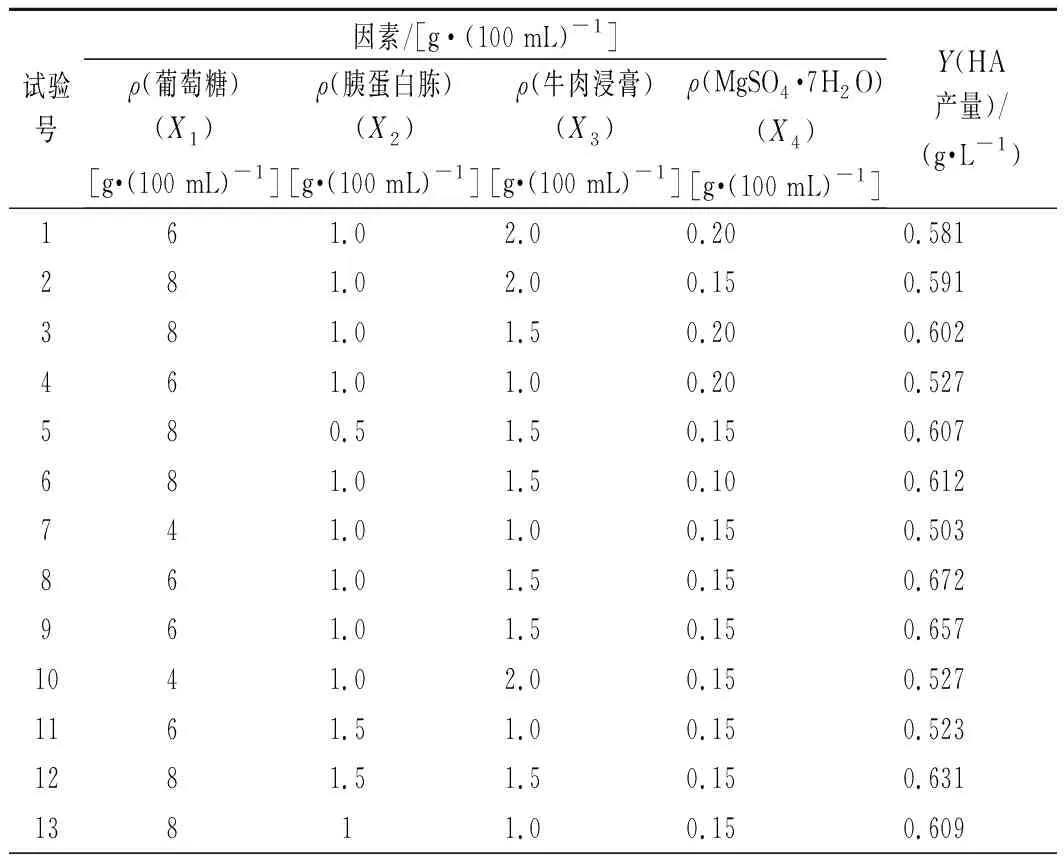
表2 Box-Behnken試驗設計及實驗結果Table 2 Experimental design and results of Box-Behnken
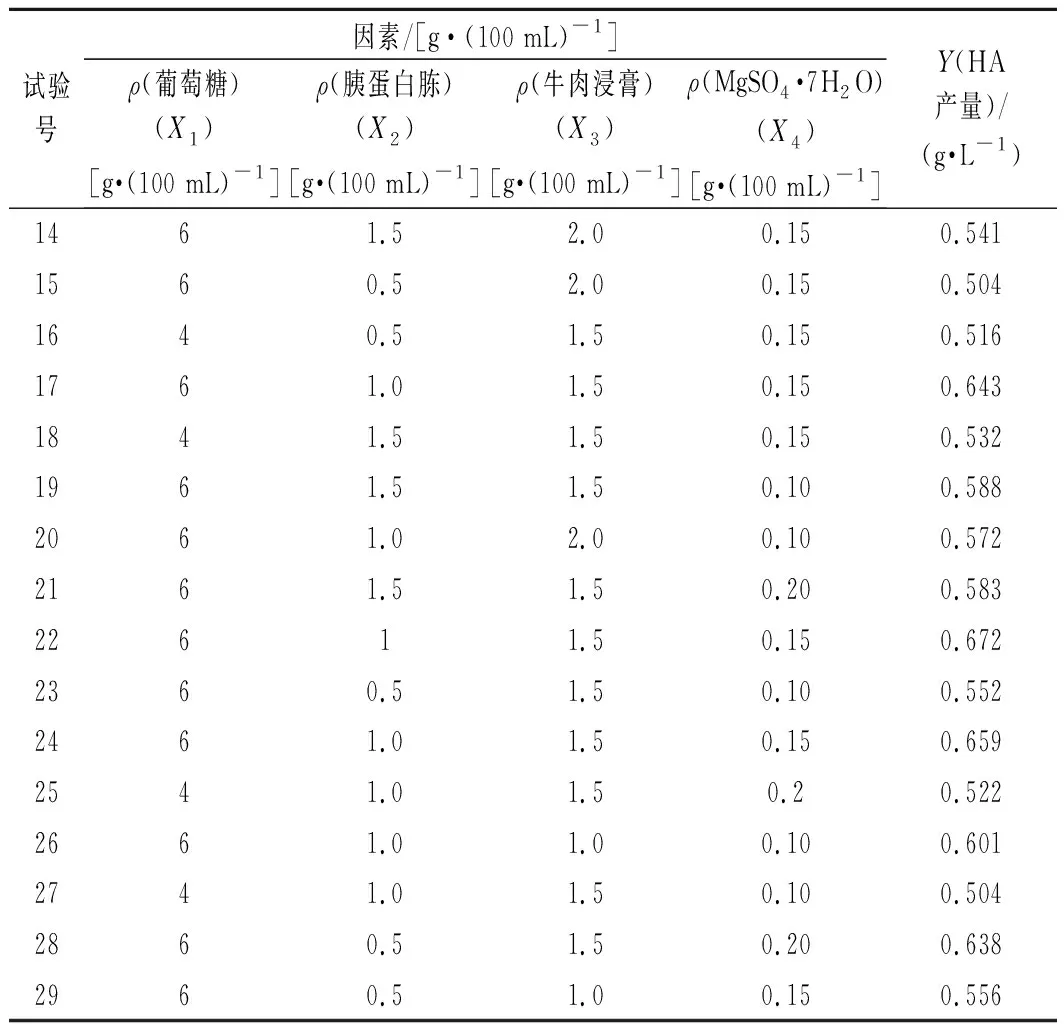
續表2
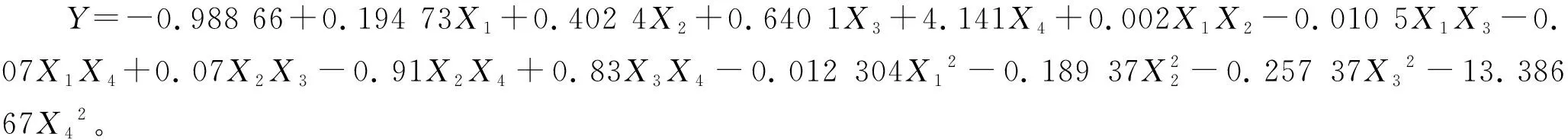
由表3可知,該模型的P<0.000 1,極顯著,失擬項的P值為0.064 5(P>0.05),差異不顯著,說明該模型回歸顯著,失擬不顯著;擬合優度判定系數(R2)為0.901 1,說明該模型擬合程度較好,可用于發酵培養基優化時HA產量的預測。
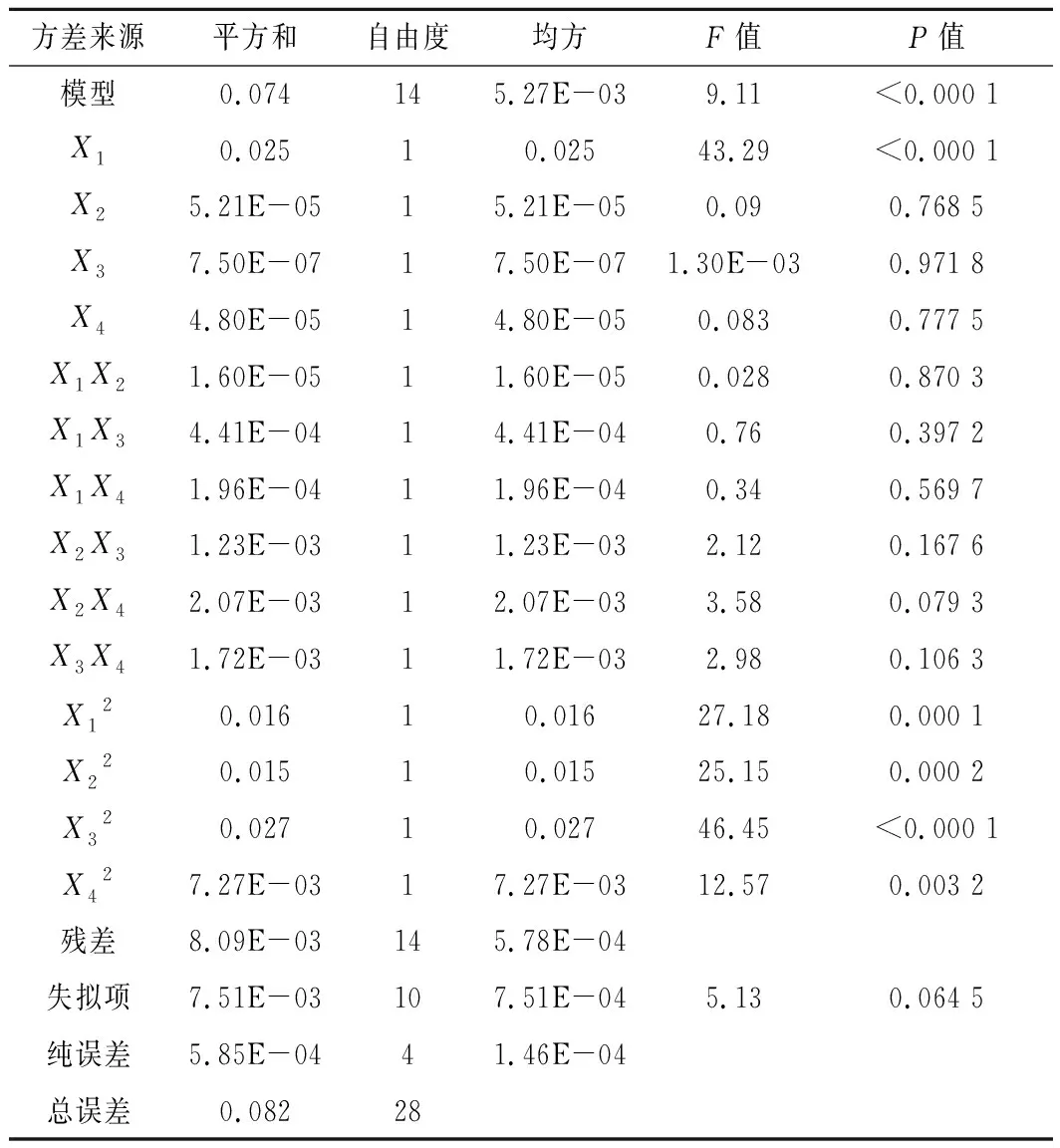
表3 回歸模型的方差分析Table 3 Variance analysis of regression model
其中,交互項(X1X2,X1X3,X1X4,X2X3,X2X4,X3X4)的P值均大于0.05,表明任意2種因素對響應值的交互作用影響不顯著。響應面圖可反映交互作用的影響程度,等高線的形狀趨近于圓形表明交互作用不顯著,趨近于橢圓形則表明顯著[26]。如圖4所示,交互項等高線的形狀趨近于圓形,表明各因素間的交互作用不顯著,與方差分析結果相一致。
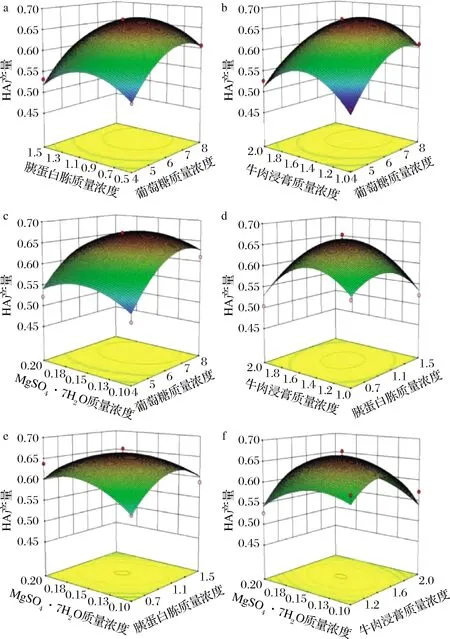
圖4 各因素交互作用對B.velezensis ZV1 HA產量影響的響應面圖Fig.4 Response surface for the alternative effects of various factors on HA yield of B.velezensis ZV1
通過Design-Expert軟件分析得到最優發酵培養基成分為(g/L):葡萄糖69.5,胰蛋白胨10.2,牛肉浸膏14.8,MgSO4·7H2O 1.5,HA產量的最大預測值為 0.671。為了驗證響應面分析的準確性,進行3次驗證實驗,測得HA產量的平均值為0.690 g/L,與模型預測值有較高的一致性。
2.3 發酵條件的優化
對發酵條件中的溫度、pH值、裝液量和搖床轉速進行單因素試驗,結果如圖5所示。
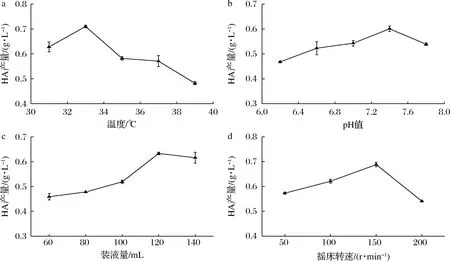
a-溫度;b-pH值;c-裝液量;d-搖床轉速圖5 發酵條件對B.velezensis ZV1 HA產量的影響Fig.5 The influence of fermentation conditions on HA yield of B.velezensis ZV1
在發酵條件的單因素試驗基礎上,采用正交設計試驗L9(34),結果如表4所示。因此,最佳發酵條件為:pH值 7.0,搖床轉速150 r/min,溫度35 ℃,裝液量140 mL。按照上述發酵條件進行3次驗證試驗,HA產量平均值達到0.972 g/L,與正交試驗分析結果基本一致。
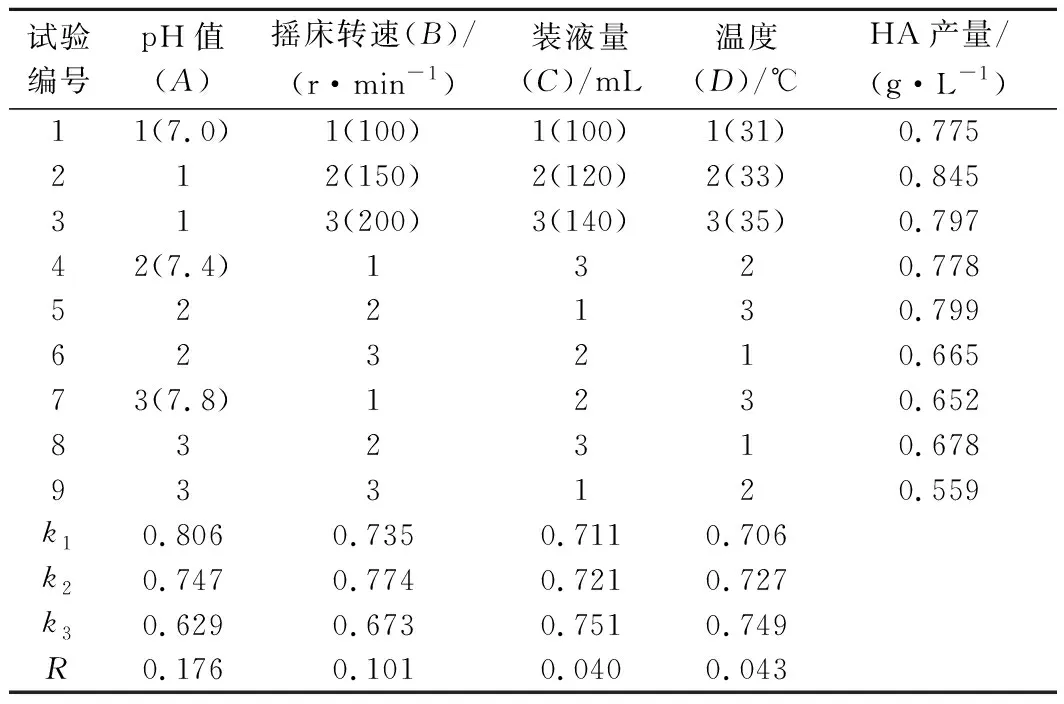
表4 正交試驗設計及結果Table 4 Design and results of orthogonal experiment
2.4 最優發酵工藝條件下突變株ZV1的測定
經紫外誘變所得的突變株ZV1,在最優發酵培養基成分與最佳發酵條件的發酵工藝下,發酵16 h,突變株ZV1的HA產量達到最大值,為1.169 g/L,相較于出發菌株Z1(0.774 g/L)提高了51.03%,比IZAWA等[17]優化后的GRAS菌株HA產量(208 mg/L)要高,更具有工業化的應用潛力。
3 結論
本研究以GRAS透明質酸產生菌株BacillusvelezensisZ1為出發菌株,經過紫外誘變后,得到1株高產HA且穩定性良好、透明質酸酶陰性的突變株ZV1。利用Box-Behnken中心組合設計和響應面法分析,得到最優發酵培養基成分:葡萄糖69.5 g/L,胰蛋白胨10.2 g/L,牛肉浸膏14.8 g/L,MgSO4·7H2O 1.5 g/L;再通過正交試驗得到最佳發酵條件:pH值7.0,搖床轉速150 r/min,溫度35 ℃,裝液量140 mL。在此最優發酵工藝條件下,突變株ZV1的HA產量最大可達到1.169 g/L,比出發菌株Z1提高了51.03%。因此,菌株的誘變選育與發酵工藝的優化可有效提高HA產量,這對于此類GRAS透明質酸產生菌株在HA工業化的發酵生產有一定的應用價值。

