胸腺法新聯(lián)合同步放化療對非小細(xì)胞肺癌患者免疫功能及臨床療效的影響
徐勤 蘭美 高珊 繆繼東 宋怡兵
(自貢市第四人民醫(yī)院,四川 自貢 643000)
非小細(xì)胞肺癌(NSCLC)是發(fā)病率和死亡率最高的腫瘤〔1〕,對于中晚期非小細(xì)胞肺癌,同步放化療為目前最主要的治療方法〔2〕,通過同步放化療,可以獲得一定程度的局部控制率并降低復(fù)發(fā)轉(zhuǎn)移概率。腫瘤的發(fā)生發(fā)展與機(jī)體免疫功能關(guān)系密切,且經(jīng)過放化療后,腫瘤患者的免疫功能會進(jìn)一步降低,毒副反應(yīng)增加,所以放化療治療時,提高病人的免疫應(yīng)答在腫瘤的治療中具有重要作用。而胸腺法新是一種通過促進(jìn)T細(xì)胞在胸腺內(nèi)增生、分化、成熟從而改善機(jī)體免疫功能的免疫調(diào)節(jié)劑,臨床上常應(yīng)用為增強(qiáng)腫瘤患者的免疫力〔3,4〕。本文擬報(bào)道胸腺法新在中晚期NSCLC中應(yīng)用對患者的免疫功能的改變、毒副反應(yīng)及臨床療效的影響。
1 資料與方法
1.1一般材料 依據(jù)2001年中國抗癌協(xié)會專業(yè)委員會修訂的診斷標(biāo)準(zhǔn)和臨床分期標(biāo)準(zhǔn),選擇2015年1月至2018年12月自貢市第四人民醫(yī)院住院的患者共120例,納入標(biāo)準(zhǔn):細(xì)胞學(xué)或病理學(xué)確診的中晚期NSCLC,無法手術(shù)的預(yù)計(jì)生存期在3個月以上的中晚期NSCLC(Ⅲ~Ⅳ期)患者,無遠(yuǎn)處轉(zhuǎn)移,卡氏(KPS)評分在60分以上,年齡60~70歲,1 s用力呼氣容積/用力肺活量(FEV1/FVC)≥65%,放化療前后均同意進(jìn)行影像學(xué)、T淋巴細(xì)胞亞群等外周血檢測。排除標(biāo)準(zhǔn):既往接受過胸部放療者;表皮生長因子受體/間變性淋巴瘤激酶(EGFR/ALK)基因突變者;嚴(yán)重心、肝、腎功能不全者;合并肺結(jié)核等疾病者;精神疾病者;病情危重者。共納入病人120例,放療全部完成且至少完成1個周期化療者納入,按治療方法分為觀察組(同步放化療加胸腺法新聯(lián)合治療)57例和對照組(同步放化療治療)63例,其中觀察組男30例,女27例;平均年齡64.2歲;腺癌22例,鱗癌35例;腫瘤分期Ⅱ期10例,Ⅲ期47 例;KPS評分平均67.4分;對照組男35例,女28例;平均年齡66.9歲;腺癌24例,鱗癌39例;腫瘤分期Ⅱ期12例,Ⅲ期51例;KPS評分平均69.4分。兩組性別、年齡、腫瘤類型、腫瘤分期比較差異無統(tǒng)計(jì)學(xué)意義(P>0.05)。
1.2治療方法 對照組采用化療方案為紫杉醇/多西他賽+順鉑/卡鉑(按體表面積計(jì)算劑量,3 w方案),同步放療(IMRT,模擬定位增強(qiáng)掃描后,掃描圖像傳輸至eclipse放療計(jì)劃系統(tǒng),勾畫靶區(qū)并外擴(kuò),給予放療劑量60 Gy,采用Varian trilogy直線加速器6 MV X線照射,常規(guī)分割,周圍正常組織給予合理劑量限值),觀察組在對照組的基礎(chǔ)上加上胸腺法新(胸腺法新1.6 mg 2次/w皮下注射,胸腺法新注射液,規(guī)格1.6 mg/支,海南中和藥業(yè)公司),胸腺法新從放化療開始一直使用至放化療結(jié)束。
1.3觀察指標(biāo)及評定標(biāo)準(zhǔn) 兩組在放化療前、放化療結(jié)束后1月檢測外周血血常規(guī)、T細(xì)胞亞群的變化,觀察從放化療治療開始至放化療結(jié)束后3月放射性肺炎的發(fā)生率。采用實(shí)體瘤療效評價標(biāo)準(zhǔn)(RECIST)標(biāo)準(zhǔn)〔5〕評價放化療后1個月臨床獲益率(CBR),CBR=〔完全緩解(CR)+部分緩解(PR)+疾病穩(wěn)定(SD)〕/〔CR+PR+SD+疾病進(jìn)展(PD)〕×100%。采用WHO抗癌藥物急性及亞急性毒性不良反應(yīng)表現(xiàn)和分級標(biāo)準(zhǔn)〔5〕判定藥物的毒副不良反應(yīng),分為0~Ⅳ級。放射性肺炎的評價標(biāo)準(zhǔn)參考CTC3.0。
1.4統(tǒng)計(jì)方法 采用SPSS17.0軟件進(jìn)行χ2、t檢驗(yàn)、秩和檢驗(yàn)。
2 結(jié) 果
2.1兩組外周血淋巴細(xì)胞計(jì)數(shù)比較 兩組治療前外周血淋巴細(xì)胞計(jì)數(shù)差異無統(tǒng)計(jì)學(xué)意義〔對照組(1.55±0.74)×109/L、觀察組(1.65±0.41)×107/L,P>0.05〕,治療前相比,兩組治療后的淋巴細(xì)胞水平均有下降〔對照組(0.71±0.22)×109/L、觀察組(0.97±0.37)×109/L,P<0.05〕,但治療后觀察組的淋巴細(xì)胞水平明顯高于對照組(P<0.05)。
2.2兩組免疫功能比較 治療前,兩組CD3+、CD4+、CD8+、CD4+/CD8+、NK 細(xì)胞比較差異無統(tǒng)計(jì)學(xué)意義(P>0.05);治療后,觀察組的CD3+、CD4+、CD4+/CD8+較治療前顯著升高(P<0.05),且較對照組顯著升高(P<0.05);對照組治療后CD4+、CD4+/CD8+明顯升高(P<0.05)。治療后觀察組CD8+較治療前明顯下降(P<0.05,P>0.05)。見表1。
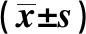
表1 兩組治療前后T淋巴細(xì)胞亞群比較
2.3兩組間毒副反應(yīng)比較 觀察組與對照組Ⅲ~Ⅳ度骨髓抑制抑制率〔26.32%(15例) vs 36.51%(23例)〕與放射性肺炎發(fā)生率〔5.26%(3例)vs 4.76%(3例)〕比較差異無統(tǒng)計(jì)學(xué)意義(P>0.05)。
2.4兩組臨床獲益率比較 觀察組CBR(82.46%,CR 2例,PR 28例,SD 17例,PD 10例)高于對照組(74.60%,CR 2例,PR 26例,SD 19例,PD 16例),但差異無統(tǒng)計(jì)學(xué)意義(P>0.05)。
3 討 論
已有研究證實(shí),與健康人相比,肺癌患者的免疫功能是降低的〔6〕,而放化療會進(jìn)一步降低患者的免疫功能〔7〕。淋巴細(xì)胞是抗腫瘤免疫的重要細(xì)胞,其水平變化反映了機(jī)體的免疫功能〔8〕。放化療可損傷正常的淋巴細(xì)胞導(dǎo)致淋巴細(xì)胞數(shù)量和功能發(fā)生異常,而惡性腫瘤患者免疫功能的下降常導(dǎo)致接受放化療的患者預(yù)后不良。因此,臨床常通過調(diào)節(jié)免疫的方法來改善患者的自身免疫功能。
胸腺法新是一種生物細(xì)胞免疫調(diào)節(jié)劑,其作用機(jī)制可能為:①可調(diào)節(jié)和增強(qiáng)T細(xì)胞在胸腺內(nèi)增殖、分化、成熟,調(diào)節(jié)T淋巴細(xì)胞CD4+/CD8+比例,②可增強(qiáng)B細(xì)胞介導(dǎo)的體液免疫和抗體應(yīng)答,③增加NK細(xì)胞活性,④增加細(xì)胞因子的分泌,從而增強(qiáng)淋巴細(xì)胞殺傷活性,而有助于非特異性地增加NSCLC患者T淋巴因子受體的水平,促進(jìn)免疫功能的改善與恢復(fù)〔9,10〕。已有文獻(xiàn)報(bào)道,胸腺法新輔助化療治療可以通過直接抑制肺癌A549細(xì)胞的增殖、促進(jìn)其凋亡,從而抑制腫瘤細(xì)胞的生長,促進(jìn)免疫功能恢復(fù)〔11〕。也有報(bào)道,胸腺法新應(yīng)用于肺癌聯(lián)合化療的患者,有助于增強(qiáng)抗腫瘤的療效,并對化療后受抑制的免疫功能有一定的恢復(fù)作用〔12〕。而放療的直接殺傷作用還會引起外周淋巴細(xì)胞數(shù)目的減少〔13〕,引起細(xì)胞亞群的再分布〔14〕。有報(bào)道指出單純常規(guī)分割放療對免疫系統(tǒng)的影響,可能是通過殺死腫瘤細(xì)胞中浸潤的CD8+T淋巴細(xì)胞,導(dǎo)致腫瘤細(xì)胞凋亡從而激活了免疫抑制通路〔15〕。楊婧等〔16〕在IMRT對外周血淋巴細(xì)胞及其亞群變化的影響中觀察到了放療后外周血淋巴細(xì)胞總數(shù)的減少,放療對腫瘤細(xì)胞的免疫抑制效應(yīng),打破了免疫平衡,降低機(jī)體的免疫功能。對于NSCLC,以三維適形為基礎(chǔ)的放療同步聯(lián)合化療〔17〕,能夠提高NSCLC的治療效果,且延長患者生存,是目前中晚期NSCLC的主要治療手段。但是有細(xì)胞毒性的化療藥物和放療對免疫功能是雙重打擊,因此,放療合并化療會更加降低機(jī)體的免疫功能,加重毒性反應(yīng)。而黃從秀等〔18〕指出除了放療對機(jī)體的免疫抑制作用,放療也能夠激活宿主的天然免疫系統(tǒng)和適應(yīng)性免疫系統(tǒng),對免疫系統(tǒng)還有一定程度調(diào)節(jié)的作用。
本研究結(jié)果提示放化療會進(jìn)一步降低機(jī)體的免疫功能。在細(xì)胞免疫中,CD4+T細(xì)胞被認(rèn)為是輔助性T細(xì)胞,CD8+T細(xì)胞為抑制性T細(xì)胞,兩者共同作用維持機(jī)體的T細(xì)胞免疫功能,CD4+T細(xì)胞升高和CD4+/CD8+比值上升表明機(jī)體細(xì)胞免疫功能處于增強(qiáng)狀態(tài),NK細(xì)胞是固有免疫細(xì)胞,在受到刺激時快速啟動固有免疫應(yīng)答,可以直接攻擊腫瘤細(xì)胞,NK細(xì)胞比值增加且NK細(xì)胞活性增強(qiáng)有助于維持正常的免疫功能,同時NK細(xì)胞還介導(dǎo)細(xì)胞因子如白細(xì)胞介素(IL)-2、IL-6、腫瘤壞死因子(TNF)-α等的產(chǎn)生,進(jìn)而提高抗腫瘤治療的效果。本研究結(jié)果也提示了免疫功能改善的同時一定程度上提高了抗腫瘤治療效果〔19,20〕。試驗(yàn)結(jié)果與單純化療后對外周血淋巴細(xì)胞亞群的影響基本一致,但楊婧等〔16〕觀察到單純放療可引起外周血CD4+T細(xì)胞減少和CD4+/CD8+比值降低的結(jié)論不一致,可能與楊婧入組的病人包括鼻咽癌、直腸癌等多種惡性腫瘤,而非單一的NSCLC。劉靜等〔21〕指出在不同腫瘤及不同劑量不同分割方式下放療對腫瘤的免疫應(yīng)答效應(yīng)可能會有所不同。在牟安娜〔22〕研究的NSCLC患者IMRT后外周血淋巴細(xì)胞亞群的變化中,發(fā)現(xiàn)治療后CD4+T細(xì)胞數(shù)是增多的,與本實(shí)驗(yàn)結(jié)論一致,但是本實(shí)驗(yàn)接受的是同步放化療,非單純放療或化療,這是對免疫功能的雙重打擊,故對于免疫調(diào)節(jié)劑對同步放化療肺癌患者的免疫功能及抗腫瘤治療療效的影響及可能機(jī)制,還需要深入研究。
本研究結(jié)果提示胸腺法新有助于減輕放化療后發(fā)生嚴(yán)重骨髓抑制的概率。放射性肺炎的發(fā)生與機(jī)體免疫功能密切相關(guān),在大鼠實(shí)驗(yàn)?zāi)P椭幸延杏^察到胸腺肽對放射性肺損傷的防治作用〔23〕,本實(shí)驗(yàn)中兩組對比放射性肺炎的發(fā)生無明顯差異,可能與入組例數(shù)較少及放射性肺炎與放療劑量、放射野設(shè)置、肺基礎(chǔ)疾病〔24〕、患者自身肺功能狀態(tài)〔25〕等多種因素有關(guān)〔26〕,尚需進(jìn)一步研究。

