基于“STAT3/miR-17”反饋環探討活血榮絡方對腦缺血再灌注損傷模型大鼠的保護作用機制
顏思陽 楊仁義 劉利娟 馬強 李俊熙 周德生


〔摘要〕 目的 探討活血榮絡方對腦缺血再灌注損傷大鼠的保護作用及對線粒體自噬的影響。方法 采用生物信息學方法挖掘腦梗死差異表達miRNAs,并預測活血榮絡方可能通過調節“STAT3-miR-17”反饋環路發揮作用。將SD雄性大鼠隨機分為假手術組、模型組、活血榮絡方組,運用線栓法建立腦缺血再灌注模型。造模前36、12 h及術后12 h給藥。術后24 h行神經功能評分,并行TTC染色評估腦梗死體積;透射電鏡觀察自噬小體;Western blot檢測線粒體及自噬相關蛋白,評估線粒體自噬情況;Real-time PCR檢測“STAT3-miR-17”反饋環中miRNA、mRNA的表達。結果 與模型組相比,活血榮絡方可明顯改善模型大鼠神經功能損傷,減少腦梗死體積(P<0.01),下調p62、TOMM20的表達(P<0.05),上調LC3B的表達(P<0.01),增加損傷側腦組織自噬小體;下調miR-17 miRNA的表達(P<0.01),上調STAT3 mRNA的表達(P<0.01)。結論 活血榮絡方可通過上調線粒體自噬發揮神經保護作用,其機制可能與調控“STAT3-miR-17”反饋環路相關。
〔關鍵詞〕 腦梗死;活血榮絡方;STAT3;miR-17;反饋環;線粒體自噬
〔中圖分類號〕R285.5? ? ? ?〔文獻標志碼〕A? ? ? ?〔文章編號〕doi:10.3969/j.issn.1674-070X.2021.04.001
〔Abstract〕 Objective To investigate the protective effect of Huoxue Rongluo Decoction on ischemia/reperfusion injury rats and its influence on mitochondrial autophagy. Methods Bioinformatics method was used to mine the differentlyexpressed miRNAs in cerebral infarction, and it was predicted that Huoxue Rongluo Decoction might play a role by regulating the "STAT3-miR-17" feedback loop. SD male rats were randomly divided into sham operation group, model group, and Huoxue Rongluo Decoction group, and the cerebral ischemia reperfusion model was established by thread plug method. Drugs were administered at 36 and 12 hours before modeling and 12 hours after surgery. Neural function score was performed 24 hours after operation, and cerebral infarction volume was assessed by TTC staining; autophagosomes were observed by transmission electron microscope; mitochondria and autophagy-related proteins were detected by Western blot to assess mitochondrial autophagy; real-time PCR was used to detect the expression of miRNA and mRNA in the feedback loop of "STAT3-miR-17". Results Compared with the model group, Huoxue Rongluo Decoction can significantly improve the neurological damage, reduce cerebral infarction volume of rats (P<0.01), down-regulate the expressions of p62 and TOMM20 (P<0.05), up-regulate the expression of LC3II (P<0.01), and increase autophagosomes in the injured brain tissue; down-regulate the expression of miR-17 miRNA (P<0.01), up-regulate the expression of STAT3 mRNA (P<0.01). Conclusion Huoxue Rongluo Decoction exerts neuroprotective effect by moderately up-regulating mitochondrial autophagy, and its mechanism may be related to the regulation of "STAT3-miR-17" feedback loop.
〔Keywords〕 cerebral infarction; Huoxue Rongluo Decoction; STAT3; miR-17; feedback loop; mitochondrial autophagy
腦血管病是全球第二大死亡原因,也是全世界致殘的第三常見原因,具有高死亡率、致殘率和復發率的特點[1-2]。同時,研究顯示我國腦血管病疾病負擔在腦出血呈緩慢下降趨勢時,腦梗死上升趨勢較明顯[3]。因此,腦梗死的防治具有重要的社會意義。線粒體自噬作為一種特殊的自噬類型,可以選擇性地清除受損線粒體,其在應激狀態中(如缺氧、鈣超載等)起著至關重要的作用。腦缺血再灌注引發的級聯反應可激活線粒體自噬這一過程[4],但目前對于線粒體自噬在腦缺血再灌注損傷(ischemia/reperfusion injury, I/R)的作用仍存在爭議。
腦梗死屬中醫學“缺血性中風”范疇。榮氣,為一切精微物質的總稱[5]。因其具備精微物質屬性,又具有氣化運動的功能,而榮氣虛與榮氣滯互為因果、消長共存,導致氣化失司、內邪交互、神機失用,發為腦梗死[6]。基于中西醫結合方法論,將線粒體的生理、病理與榮氣理論相聯系,認為榮氣的物質屬性相當于現代醫學的線粒體,而線粒體的功能可以體現榮氣的作用[7]。
基于榮氣虛滯理論創制的活血榮絡方為湖南中醫藥大學第一附屬醫院院內制劑,廣泛應用于臨床。前期研究[8]表明活血榮絡方能夠作用于線粒體,可減輕線粒體活性氧的產生,降低線粒體鈣超載等。但其調控腦梗死后線粒體自噬的作用機制有待進一步研究。本項目利用生物信息學方法結合腦缺血再灌注大鼠模型,篩選“轉錄因子(transcription factors, TF)-miRNA”反饋環及下游效應機制,探討活血榮絡方對I/R的保護作用及對線粒體自噬的影響。
1 材料
1.1? 實驗動物
2~3月齡雄性SPF級SD大鼠30只,體質量250~280 g,購自湖南斯萊克景達實驗動物有限公司,動物許可證號:SCXK(湘)2016-0002。飼養于湖南中醫藥大學第一附屬醫院實驗動物中心(通風良好,晝夜交替12 h,溫度21~26 ℃,濕度40%~50%)。實驗經湖南中醫藥大學第一附屬醫院倫理委員會批準(倫理批準號:20201010-13)。
1.2? 主要藥物及試劑
活血榮絡方(院內制劑):雞血藤30 g,石楠藤30 g,生地黃15 g,玄參10 g,黃精15 g,乳香10 g,沒藥10 g,川芎10 g。各藥混合置于圓底燒瓶中,加10倍量水浸泡12 h后用冷凝回流裝置加熱回流2 h,提取液過濾,殘渣加8倍量水,繼續冷凝回流1 h,提取液過濾,合并2次過濾液于旋轉蒸發儀上進行濃縮,即得活血榮絡方浸膏,無菌玻璃瓶分裝,4 ℃貯存備用。根據人動物體表面積換算法(給藥劑量=0.018×人給藥劑量/大鼠體質量),大鼠每天灌胃劑量約為11.7 g/kg。
BCA蛋白定量試劑盒(貨號:70-PQ0012,杭州聯科生物技術股份有限公司);SDS-PAGE凝膠配置試劑盒(貨號:CW0022S,北京康為世紀生物科技有限公司);Immobilon Western HRP底物(貨號:WBKLS0100,美國Millipore公司);PageRulerTM Prestained Protein Ladder(貨號:26616,美國賽默飛世爾科技公司);抗體:LC3B、p62、TOMM20、Goat Anti-Rabbit IgG H&L(HRP)(貨號:ab48394、ab91526、ab186735、ab150120,英國Abcam公司);HyPureTM Molecular Biology Grade Water(貨號:SH30538.02,美國HyClone公司);RNA提取液、ServicebioRT First Strand cDNA Synthesis Kit、2×SYBR Green qPCR Master Mix (Low ROX)(貨號:G3013、G3330、G3321,武漢賽維爾生物科技有限公司)。
1.3? 主要儀器
透射電鏡(型號:Tecnai G2 Spirit Bio TWIN,美國FEI公司);小型Mini-Protean?Tetra垂直電泳槽、小型Trans-blot轉印槽、Power PacTM Basic基礎電泳儀(電源)、化學凝膠成像分析儀、熒光定量PCR儀(型號:1658001、1703930、1645050、Chemi DocTMXRS+、CFX96TM,美國Bio-Rad公司);PVDF膜(規格:26.5 cm×3.75 m/卷,0.22 μm,貨號:ISEQ00010,美國Millipore公司);臺式高速冷凍型微量離心機(型號:D3024R,中國DragonLab公司);超微量分光光度計(型號:NanoDrop2000,美國Thermo Scientific公司);超凈工作臺(型號:SW-CJ-1FD,中國蘇凈安泰公司);標準試劑型純水儀(型號:GBZ2001-uo-p,中國青島富勒姆科技有限公司);多功能酶標儀(型號:Enspire,美國Perkinelmer公司)。
2 方法
2.1? “藥物-疾病-表型”核心靶點篩選及富集分析
利用中藥系統藥理數據庫(TCMSP,https://tcmspw.com/tcmsp.php)[9]及中醫藥整合藥理學研究平臺v2.0數據庫(TCMIP, http://www.tcmip.cn/TCMIP/index.php/Home/Login/login.html),收集活血榮絡方中主要藥物(川芎、生地黃、黃精、雞血藤、乳香、沒藥、玄參)的化學成分。以口服生物利用度(OB)≥30%[10],化合物類藥性(DL)≥0.18[11]為篩選條件,篩選出活血榮絡方中具有較高活性的化合物。通過PubChem(https://pubchem.ncbi.nlm.nih.gov/)數據庫[12]收集與校對候選化合物名稱,并利用Swiss Target Prediction(http://www.swisstargetprediction.ch/)數據庫[13]對候選化合物相關靶點進行預測,剔除無3D/2D化學結構、靶點化合物。
通過GeneCards(https://www.genecards.org/)數據庫[14],以“Cerebral Ischemia”OR“Stroke”AND“Mitochondrial autophagy”(“腦缺血”或“卒中”和“線粒體自噬”)為檢索詞,收集腦梗死線粒體自噬的作用靶點。通過Bioinformatics Gent中Van de Peer Lab取交集獲得活血榮絡方與缺血性腦卒中線粒體自噬(“藥物-疾病-表型”)的共同靶點。
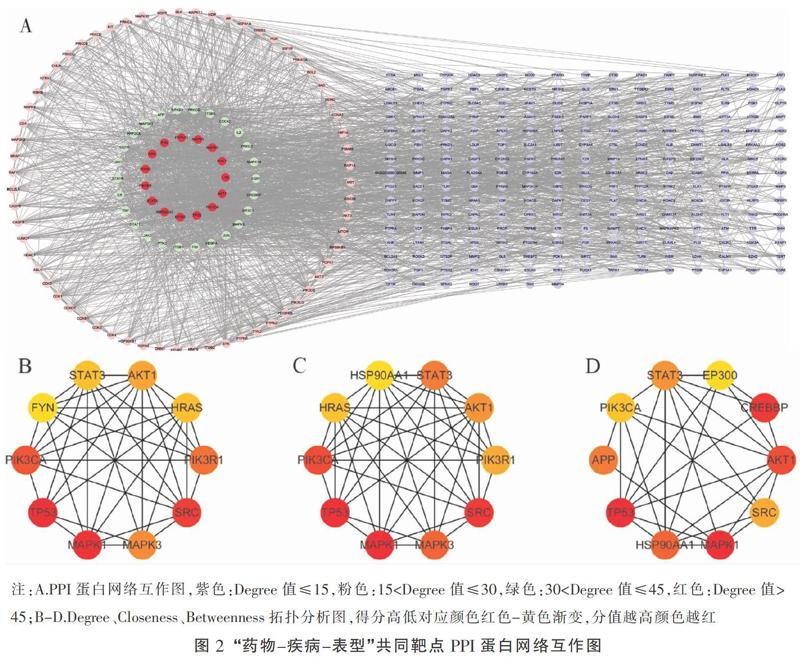
將共同靶點導入STRING數據庫(https://string-db.org/)[15],選擇Multiple Protenin,限定物種為Homo sapiens,設定最低要求互動分數為高度信度0.700[16],獲得PPI網絡相關信息。導入Cytoscape軟件,使PPI網絡可視化,行Degree、Closeness、Betweenness拓撲分析,聚焦核心靶點。通過DAVID數據庫對作用靶點進行GO、KEGG富集分析,利用R軟件ggplot2包對前10位進行可視化。
2.2? “mRNA-miRNA”反饋環路的構建
根據“2.1”篩選獲得PPI、GO、KEGG富集分析結果,利用在線數據庫TargetScan(http://www.targetscan.org/vert_72/)[17]、miRWalk(http://mirwalk.umm.uni-heidelberg.de/)[18]、mirDIP(http://ophid.utoronto.ca/mirDIP/index.jsp)[19]、miRDB(http://mirdb.org/)[20]進行反向預測,篩選作用于“藥物-疾病-表型”核心靶點的潛在miRNA。同時利用GEO數據庫(https://www.ncbi.nlm.nih.gov/geo/),以“Cerebral infarction”或“Cerebral ischemia”為檢索詞,獲取腦梗死miRNA芯片(GSE117064)[21]。R語言對數據表達矩陣行質量控制,采用limma包對表達矩陣進行差異性分析,以|logFC|≥1與adj.P.Val<0.05為篩選條件,篩選出腦梗死后差異表達的miRNA,繪制火山圖及前50位熱圖。將其與核心靶點反向預測的miRNA取交集,篩選出腦梗死后差異表達并能調控核心靶點的miRNAs。
進一步利用數據庫TransmiR v2.0篩選核心靶點可能調控的miRNAs,綜合分析獲得可能的“TF-miRNA”反饋環路。
2.3? 動物模型的制備與評價
大鼠適應性喂養一周,術前12 h內禁食不禁水。以10%水合氯醛(3.5 mL/kg)腹腔注射麻醉大鼠,麻醉滿意后,參考Longa等[22]報道的大腦中動脈阻塞法(middle cerebral artery occlusion, MCAO),鈍性分離右側頸總動脈(common carotid artery, CCA)、頸外動脈(external carotid artery, ECA)和頸內動脈(internal carotid artery, ICA),從ECA與ICA分叉部約4 mm處斜45°剪口進栓線,插入栓線約18 mm梗阻右側大腦中動脈;梗阻2 h后拔出拴線進行再灌注。假手術組分離CCA、ECA、ICA,不插入栓線,余過程同造模組。將大鼠保溫至蘇醒后分籠喂養,術后6 h再恢復進食。采用Zea-Longas[22]標準評分法,評分1~3分大鼠納入后續實驗。
2.4? 分組及給藥
將30只SD大鼠隨機分為3組,分別為假手術(Sham)組、模型(I/R)組、活血榮絡方(HXRLF)組,每組10只。實驗過程中出現死亡或取材時發現為腦出血、蛛網膜下腔出血等予以剔除,按需要以相同方法造模補充。
HXRLF組劑量參照前期實驗[23],每天灌胃給藥11.7 g/kg,連續給藥3次,分別為造模前36 h和12 h以及造模后12 h,Sham組和I/R組給予等劑量蒸餾水。
2.5? 神經功能缺損評分
大鼠再灌注后,按Zea-Longas五級標準評分法對大鼠進行神經功能缺損評分[22],評分等級為0~4分,分值越高,神經功能缺損越嚴重。其中0分無明顯神經功能缺損;1分:提尾時對側前肢不能完全伸直,爬行時向對側轉圈;2分:提尾時對側前肢屈曲內收,爬行時向對側轉圈;3分:站立不穩,爬行時向偏癱側跌倒;4分:意識障礙,不能夠自發行走。取評分在1~3分者進行后續實驗。
2.6? TTC染色觀察大鼠腦組織變化
再灌注24 h后,大鼠麻醉滿意后固定,腹主動脈采血后快速斷頭取腦,于-20 ℃冰箱冷凍30 min,切除嗅球,沿冠狀面切片,置于37 ℃水浴鍋預熱的2% TTC染液中,避光雙面染色20 min。染色結束后于4%多聚甲醛中固定,4 ℃冰箱過夜后置于深色背景面觀察,紅色為正常腦組織,白色為梗死腦組織。缺血區腦梗死體積比=各切片白色缺血區面積之和/各切片腦片面積之和。用Image-J軟件計算腦梗死面積并分析。
2.7? 透射電鏡觀察各組大鼠腦組織中線粒體自噬現象
再灌注24 h后,大鼠深度麻醉后固定,腹主動脈采血后先后經心臟灌注生理鹽水及4%多聚甲醛,灌注充分后斷頭取腦,分離出損傷側皮質腦組織,于冰上制備成1 mm3大小的組織塊,置于4 ℃預冷的戊二醛溶液中固定,電鏡室包埋、檢測。
2.8? Western blot法檢測各組大鼠腦組織中LC3B、p62、TOMM20的表達水平
再灌注24 h后,大鼠深度麻醉下斷頭取腦,取損傷側腦組織分裝于凍存管中,液氮急凍后轉移至-80 ℃冰箱保存。取相應組別大鼠腦組織置于冰上,加入裂解液(組織裂解液∶PMSF=100∶1)后,經組織搗碎均漿機充分研磨提取總蛋白。采用BCA法測定總蛋白濃度。蛋白上樣量為3 μg/μL,10 μL/孔。經SDS-PAGE凝膠電泳,轉膜,5%脫脂牛奶室溫封閉1.5 h,一抗(LC3B:1∶1 000,p62:1∶1 000,TOMM20:1∶1 000)4 ℃孵育過夜,洗膜3次,10 min/次,二抗(山羊抗兔:1∶10 000)37 ℃恒溫水浴箱孵育,再次洗膜后顯色成像。使用Image-Lab檢測圖像灰度值并進行分析,以目的蛋白與β-actin灰度值的比值表示相對蛋白表達量。
2.9? Real-time PCR法檢測各組大鼠腦組織“TF-miRNA”反饋環路miRNA、mRNA基因表達
取-80 ℃凍存的腦組織100 mg,加入1 mL Trizol Reagent,組織搗碎均漿機充分研磨提取總RNA,使用Nanodrop 2000檢測RNA濃度及純度。逆轉錄后,按試劑盒說明書進行擴增,反應體系為:2×qPCR Mix 7.5 μL,2.5 μM基因引物1.5 μL,反轉錄產物2.0 μL,ddH2O 4.0 μL。預變性95 ℃10 min,循環(40次)95 ℃,15 s→60 ℃,60 s,熔解曲線60 ℃→95 ℃,每15 s升溫0.3 ℃。miRNA內參為U6,mRNA內參為GAPDH,相對表達量用2-ΔΔCt表達。PCR引物序列見表1。
2.10? 統計學分析
采用SPSS 25.0軟件進行統計分析,計量資料以“x±s”表示,神經功能評分采用Mann-Whitney test分析,其余指標滿足方差齊性,則各組間比較采用單因素方差分析進行比較,若不滿足方差齊性,則采用Kruskal Wallis H檢驗。
3 結果
3.1? “藥物-疾病-表型”核心靶點篩選及富集分析結果
通過TCMSP及TCMID數據庫共獲得符合篩選條件的活血榮絡方中具有較高活性的化合物99個(川芎7個,生地黃2個,雞血藤24個,玄參9個,黃精12個,乳香8個,沒藥45個)。通過Swiss Target Prediction數據庫對篩選出的化合物進行相關靶點預測,剔除無化學結構式及無靶點化合物,得到活血榮絡方可能作用的靶點1 109個。通過GeneCards數據庫收集到腦梗死線粒體自噬靶點1 653個靶點。利用Bioinformatics Gent取交集獲得活血榮絡方主要化合物與腦梗死線粒體自噬(藥物-疾病-表型)共同靶點,共同靶點372個。見圖1。
利用STRING數據庫和Cytoscape軟件對共同靶點蛋白進行相互作用網絡聚焦,分別行Degree、Closeness、Betweenness拓撲分析,聚焦于前10位核心靶點。見圖2。
通過DAVID數據庫對作用靶點進行GO、KEGG富集分析,對P值取負對數,得出“-lgP”值,-lgP值越大,富集程度越大,篩選出富集程度前10位進行分析,并利用R軟件ggplot2分析包進行可視化。見圖3。活血榮絡方作用靶點主要分布在胞質、胞核、溶酶體等細胞組分中,通過調控ATP結合、蛋白質絲氨酸/蘇氨酸激酶活性、蛋白質結合、轉錄因子活性等,調節多種蛋白磷酸化、炎癥反應、對缺氧的反應、血管生成、轉錄、抑制凋亡等,通過HIF-1信號通路、PI3K/Akt信號通路等調節腦梗死后線粒體自噬。結合前期研究[23-24],活血榮絡方可激活腦梗死后JAK2/STAT3通路、調控STAT3/miRNA反饋環路,激活下游HIF-1通路等。故本研究聚焦于STAT3、HIF1-α,進一步篩選相關miRNAs。
3.2? “TF-miRNA”反饋環路的構建
利用在線數據庫TargetScan、miRWalk、mirDIP、miRBD進行反向預測,篩選可能作用于STAT3、HIF-1α的潛在miRNA,其中27個可調控STAT3,64個可調控HIF-1α,見圖4。利用GEO數據庫,獲取GSE117064數據集,歸一化與差異化分析后繪制差異miRNAs火山圖,結果表明腦梗死后差異表達的miRNAs共2 565個,其中1 799個表達上調,766個表達下調。三者取交集得2個腦梗死后差異表達并能調控核心靶點的miRNAs(miR-17-5p、miR-20b-5p)。見圖5。
進一步于TransmiR v2.0數據庫中檢索STAT3、HIF-1α調控表達的miRNAs,知STAT3、HIF-1α可轉錄調控miR-17的表達,初步構成“STAT3-miR-17”、“HIF-1α-miR-17”反饋環。而STAT3可作為HIF-1α上游發揮作用,調控HIF-1α轉錄表達[25]。綜上,整合多個數據庫,預測活血榮絡方可通過調控STAT3/miRNA-17反饋環介導下游通路調控腦梗死后線粒體自噬以保護受損腦組織。
綜上,整合多個數據庫,預測活血榮絡方可通過調控STAT3/miRNA-17反饋環介導下游通路調控腦梗死后線粒體自噬以保護受損腦組織。
3.3? 各組大鼠神經功能評分
與Sham組比較,I/R組神經功能評分明顯升高,神經功能缺損嚴重(P<0.01);與I/R組相比,HXRLF組評分降低,提示活血榮絡方可改善神經功能缺損評分(P<0.01)。見表2。
3.4? 各組大鼠TTC染色情況
TTC染色結果表明,與I/R組相比,活血榮絡方可明顯減少I/R大鼠損傷側腦梗死體積。見表3。
3.5? 各組大鼠損傷側腦組織透射電鏡結果
損傷側腦組織透射電鏡結果顯示,I/R組損傷側腦組織中雙層膜結構自噬小體較Sham組增多;與I/R組相比,HXRLF組雙層膜結構的自噬小體明顯增多。見圖6。
3.6? 各組大鼠腦組織中LC3B、p62、TOMM20的表達水平比較
與Sham組相比,I/R組損傷側腦組織自噬相關蛋白LC3B、p62表達水平上調(P<0.01),線粒體膜蛋白TOMM20表達水平下調(P<0.01);而與I/R組相比,活血榮絡方可顯著上調自噬相關蛋白LC3B(P<0.01),下調TOMM20和p62(P<0.05)。見圖7。
3.7? 各組大鼠腦組織中“STAT3-miR-17”反饋環路mRNA及miRNA的表達
與Sham組比較,I/R組miR-17表達明顯升高(P<0.01),STAT3 mRNA表達降低(P<0.05);與I/R組比較,HXRLF組miR-17的表達可明顯下調(P<0.01);STAT3 mRNA的表達上調(P<0.01)。見圖8。
4 討論
腦梗死會引起細胞內多種轉錄因子(transcription factors, TFs)、微/小分子RNA(microRNAs, miRNAs)發生變化。細胞核內某些TF可以調控特定miRNA的轉錄,上調其表達;而胞質中某些miRNA可與TF mRNA的3UTR相結合,抑制其轉錄后翻譯,下調蛋白表達,減少入核轉錄,進而下調miRNA的轉錄,構成特定的“TF-miRNA”反饋環路[24]。本研究采用生物信息學技術,結合前期研究[24],預測活血榮絡方可能調節“STAT3-miR-17”反饋環路以調控腦梗死后線粒體自噬以發揮腦保護作用。
榮氣是一切精微物質的總稱[5],作為“動力工廠”的線粒體在某種意義上反映了“榮氣”的作用。課題組基于榮氣與線粒體的相關性,從榮氣氣化不足所致榮氣虛與線粒體自噬過度及榮氣氣化阻滯所致榮氣滯與線粒體自噬不足進行了闡釋,揭示了榮氣虛滯與線粒體自噬的相關性[7]。并制定了活血榮絡方以調理氣化來調整榮氣的升降出入運動,使其恢復到氣化神機的協調狀態。前期研究[23,26]證實活血榮絡方對MCAO/R大鼠起腦保護作用;并可改善線粒體功能[8]。因此,本研究采用MCAO/R大鼠模型,初步驗證“STAT3-miRNA”反饋環在腦梗死中的作用及活血榮絡方的調控作用。研究中發現,與模型組相比,活血榮絡方可明顯改善I/R組大鼠的神經功能缺血,減少腦梗死體積,增加自噬小體數量,上調線粒體自噬標記蛋白的表達,并可下調miR-17 miRNA的表達,上調STAT3 mRNA表達。提示活血榮絡方的神經保護作用與上調線粒體自噬有關,其機制可能與調控“STAT3-miR-17”反饋環路相關。
STAT3是多種細胞因子受體信號轉導的基礎,參與細胞自噬、增殖、凋亡、血管新生等多個生物過程[25,27]。應激狀態下激活形成穩定的二聚體并進入細胞核,協調各種轉錄程序[28-29],是自噬相關基因的主要轉錄增強子[25]。He等[30]研究表明miR-17可直接靶向STAT3發揮作用。而miR-17與STAT3表達呈負相關,抑制miR-17,可上調STAT3、p-STAT3的表達[31-32]。本研究表明,I/R組miR-17 miRNA表達升高,而STAT3 mRNA有所下降;活血榮絡方可抑制miR-17 miRNA的表達,上調STAT3 mRNA的表達。提示活血榮絡方可能通過調節“STAT3-miR-17”調控下游相關通路發揮作用。
現有研究[25,33]表明,STAT3可調節HIF-1α在低氧狀態下的表達來執行其激活自噬的功能。亦可直接靶向BNIP3調控線粒體自噬的發生,其磷酸化可能增加BNIP3表達激活線粒體自噬[34-35]。此外,STAT3向線粒體的易位可能在自噬調節中起關鍵作用[36]。而LC3作為自噬標記蛋白,主要包括胞質中的LC3I(LC3A)和定位于自噬小體膜上的LC3II(LC3B)兩種形式,兩者之間可相互轉化,而LC3II通常被認為是自噬形成的標志分子。p62可充當支架蛋白與LC3相結合,進而被溶酶體降解,其表達常與自噬水平呈負相關,即自噬水平升高時,p62的表達水平降低,反之,則表達升高;而當自噬小體與溶酶體形成受阻時,自噬小體的降解受阻,LC3II和p62則會累積[37]。并選取了線粒體膜蛋白TOMM20來反應線粒體變化情況。研究發現,活血榮絡方可上調LC3B的表達,并下調p62、TOMM20的表達,但對下游相關通路的調控作用有待進一步研究。
綜上所述,活血榮絡方對MCAO/R大鼠腦組織I/R損傷有保護作用。其可能機制與調節“STAT3/miR-17”反饋環路,上調線粒體自噬,清除受損線粒體,維持線粒體功能有關。為中醫藥研究提供新的研究方向或思路。
參考文獻
[1] GBD CAUSES oF DEATH COLLABORATORS. Global, regional, and national age-sex-specific mortality for 282 causes of death in 195 countries and territories, 1980-2017: A systematic analysis for the Global Burden of Disease Study 2017[J]. Lancet, 2018, 392(10159): 1736-1788.
[2] GBD 2017 DALYs, HALE Collaborators. Global, regional, and national disability-adjusted life-years (DALYs) for 359 diseases and injuries and healthy life expectancy (HALE) for 195 countries and territories, 1990-2017: A systematic analysis for the Global Burden of Disease Study 2017[J]. Lancet, 2018, 392(10159): 1859-1922.
[3] 彭? 琴,李海玲,王? 媛,等.1990-2016年中國人群腦血管病疾病負擔變化趨勢[J].中華流行病學雜志,2019,40(4):400-405.
[4] ZHANG X N, YAN H J, YUAN Y, et al. Cerebral ischemia-reperfusion-induced autophagy protects against neuronal injury by mitochondrial clearance[J]. Autophagy, 2013, 9(9): 1321-1333.
[5] 周德生,張雪花,譚? 靜.榮氣虛滯論[J].中醫藥通報,2005,4(2):22-25.
[6] 周德生,陳湘鵬,胡? 華,等.腦梗死榮氣虛滯病機特征之探討[J].中西醫結合心腦血管病雜志,2014,12(12):1560-1561,1576.
[7] 顏思陽,周德生.基于榮氣虛滯理論探討腦梗死后線粒體自噬及臨床辨治[J].中西醫結合心腦血管病雜志,2020,18(6):1000-1002.
[8] 陳湘鵬,周德生,胡? 華,等.活血榮絡片對急性腦梗死患者血漿CF6及線粒體游離Ca2+濃度水平的影響[J].河南中醫,2016,36(6):1006-1008.
[9] RU J, LI P, WANG J, et al. TCMSP: A database of systems pharmacology for drug discovery from herbal medicines[J]. Journal of Cheminformatics, 2014. 6: 13.
[10] TIAN S, LI Y Y, WANG J M, et al. ADME evaluation in drug discovery. 9. Prediction of oral bioavailability in humans based on molecular properties and structural fingerprints[J]. Molecular Pharmaceutics, 2011, 8(3): 841-851.
[11] GIBALDI M, LEVY G. Pharmacokinetics in clinical practice. I. Concepts[J]. JAMA, 1976, 235(17): 1864-1867.
[12] KIM S, CHEN J, CHENG T J, et al. PubChem 2019 update: Improved access to chemical data[J]. Nucleic Acids Research, 2019, 47(D1): D1102-D1109.
[13] GFELLER D, MICHIELIN O, ZOETE V. Shaping the interaction landscape of bioactive molecules[J]. Bioinformatics, 2013, 29(23): 3073-3079.
[14] FISHILEVICH S, NUDEL R, RAPPAPORT N, et al. GeneHancer: genome-wide integration of enhancers and target genes in GeneCards[J]. Database, 2017, 2017: 1-17.
[15] VON MERING C, JENSEN L J, SNEL B, et al. STRING: known and predicted protein-protein associations, integrated and transferred across organisms[J]. Nucleic Acids Research, 2005, 33: D433-D437.
[16] SZKLARCZYK D, GABLE A L, LYON D, et al. STRING v11: protein-protein association networks with increased coverage, supporting functional discovery in genome-wide experimental datasets[J]. Nucleic Acids Research, 2019, 47(D1): D607-D613.
[17] LEWIS B P, BURGE C B, BARTEL D P. Conserved seed pairing, often flanked by adenosines, indicates that thousands of human genes are microRNA targets[J]. Cell, 2005, 120(1): 15-20.
[18] DING J, LI X M, HU H Y. TarPmiR: a new approach for microRNA target site prediction[J]. Bioinformatics, 2016, 32(18): 2768-2775.
[19] TOKAR T, PASTRELLO C, ROSSOS A, et al. mirDIP 4.1-integrative database of human microRNA target predictions[J]. Nucleic Acids Research, 2018, 46(D1): D360-D370.
[20] CHEN Y H, WANG X W. miRDB: an online database for prediction of functional microRNA targets[J]. Nucleic Acids Research, 2020, 48(D1): D127-D131.
[21] SONODA T, MATSUZAKI J, YAMAMOTO Y, et al. Serum MicroRNA-based risk prediction for stroke[J]. Stroke, 2019, 50(6): 1510-1518.
[22] LONGA E Z, WEINSTEIN P R, CARLSON S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84-91.
[23] 周穎璨,王洪海,周德生,等.活血榮絡方對大鼠腦缺血再灌注損傷JAK2、STAT3表達的影響[J].時珍國醫國藥,2017,28(9): 2111-2114.
[24] 楊仁義,周德生,傅馨瑩,等.基于STAT3/miRNA反饋環路探討中醫藥促腦梗死后血管新生的調控機制[J].中國實驗方劑學雜志,2020,26(20):221-228.
[25] YOU L K, WANG Z G, LI H S, et al. The role of STAT3 in autophagy[J]. Autophagy, 2015, 11(5): 729-739.
[26] 周德生,劉利娟,寇志剛,等.活血榮絡片對大腦中動脈缺血模型大鼠腦組織微囊蛋白-1表達的影響[J].河北中醫,2016,38(1):80-84,163.
[27] BROMBERG J F, WRZESZCZYNSKA M H, DEVGAN G, et al. Stat3 as an oncogene[J]. Cell, 1999, 98(3): 295-303.
[28] SRIVASTAVA J, DIGIOVANNI J. Non-canonical Stat3 signaling in cancer[J]. Molecular Carcinogenesis, 2016, 55(12): 1889-1898.
[29] GUANIZO A C, FERNANDO C D, GARAMA D J, et al. STAT3: A multifaceted oncoprotein[J]. Growth Factors, 2018, 36(1/2): 1-14.
[30] HE M, WANG Q Y, YIN Q Q, et al. HIF-1α downregulates miR-17/20a directly targeting p21 and STAT3: a role in myeloid leukemic cell differentiation[J]. Cell Death and Differentiation, 2013. 20(3): 408-418.
[31] 李國良,劉德衍,楊彥華,等.miR-17及其靶基因HIF-1α、STAT3在心源性猝死心肌組織中的表達及其意義[J].中國法醫學雜志, 2019,34(6):562-566.
[32] WANG Z, YUAN W, LI B, et al. PEITC promotes neurite growth in primary sensory neurons via the miR-17-5p/STAT3/GAP-43 axis[J]. Journal of Drug Targeting, 2019, 27(1): 82-93.
[33] SHEN S S, NISO-SANTANO M, ADJEMIAN S, et al. Cytoplasmic STAT3 represses autophagy by inhibiting PKR activity[J]. Molecular Cell, 2012, 48(5): 667-680.
[34] PRATT J, ANNABI B. Induction of autophagy biomarker BNIP3 requires a JAK2/STAT3 and MT1-MMP signaling interplay in Concanavalin-A-activated U87 glioblastoma cells[J]. Cellular Signalling, 2014, 26(5): 917-924.
[35] LI S, XIA Y, CHEN K, et al. Epigallocatechin-3-gallate attenuates apoptosis and autophagy in concanavalin A-induced hepatitis by inhibiting BNIP3[J]. Drug Design, Development and Therapy, 2016, 10: 631-47.
[36] SZCZEPANEK K, CHEN Q, LARNER A C, et al. Cytoprotection by the modulation of mitochondrial electron transport chain: The emerging role of mitochondrial STAT3[J]. Mitochondrion, 2012, 12(2): 180-189.
[37] 余婧萍,宋禎彥,李富周,等.芍藥苷通過促進細胞自噬抑制H2O2誘導的SH-SY5Y細胞的氧化損傷[J].湖南中醫藥大學學報,2020,40(6):653-659.
(本文編輯? 蘇? 維)

