培養濾液MPT64抗原檢測陰性結核分枝桿菌的基因多態性分析
趙國連 談小文 崔曉利 黨麗云
目前,一些分子生物學檢測技術可以很容易實現對結核分枝桿菌(Mycobacteriumtuberculosis,MTB)和非結核分枝桿菌(non-tuberculous mycobacteria,NTM)的鑒別。但這些技術對基礎設施和操作人員的熟練程度有較高要求[1]。因此,快速、敏感、簡便的MTB鑒定方法對結核病的準確診斷和正確治療至關重要。MPT64抗原檢測的膠體金免疫層析法可用于BACTEC MGIT 960液體培養(簡稱“MGIT 960液體培養”)陽性分枝桿菌菌種的快速鑒定,價格便宜、方便使用、15 min內可獲得結果[2],在德國、日本和南非等地的研究中均表現出較高的診斷效能[3]。然而,也有研究顯示,MPT64抗原檢測在MTB鑒別中存在一定量的假陰性結果,認為可能與MTB的MPT64基因多態性相關[4-5]。因此,筆者通過基因測序比對,分析MPT64抗原檢測假陰性MTB的基因多態性,以期獲得MPT64抗原檢測假陰性結果產生的原因。
資料和方法
一、菌株來源
收集2018年1月至2020年6月就診于西安市胸科醫院行痰液、支氣管肺泡灌洗液、胸腹腔積液等標本分枝桿菌MGIT 960液體培養的疑似肺結核患者資料,選取培養陽性且經分枝桿菌萋-尼抗酸染色鏡檢確認為陽性,并有MPT64抗原檢測(膠體金免疫層析法)、對硝基苯甲酸/噻吩-2-羧酸肼(PNB/TCH)生長試驗和分枝桿菌菌種鑒定(DNA微陣列芯片法)結果的1962例患者分枝桿菌臨床分離株作為研究對象。對其中MPT64抗原檢測與分枝桿菌菌種鑒定結果不一致的菌株(本院研究室保存)行GeneXpert MTB/RIF(簡稱“GeneXpert”)和PNB培養檢測,并對MPT64抗原檢測陰性但菌種鑒定結果為MTB的14株菌株進行MPT64基因測序。
二、研究方法
1.MGIT 960液體培養:收集標本行液化去污處理[6],將0.5 ml處理后標本接種于MGIT 960分枝桿菌生長指示管中,充分混勻,室溫靜置30 min。于37 ℃在MGIT 960系統中孵育,最長42 d,并定期監控。培養陽性標本經分枝桿菌萋-尼抗酸染色鏡檢確認。
2.MPT64抗原檢測(膠體金免疫層析法):將MGIT 960液體培養陽性且分枝桿菌萋-尼抗酸染色鏡檢確認陽性的標本按照MPT64抗原檢測試劑盒(杭州創新生物檢控技術有限公司生產)說明書進行操作。對MPT64抗原檢測陰性的菌株,14 d后再次行MPT64抗原檢測。
3.PNB/TCH培養基生長試驗:采用微孔板肉湯(PNB)培養基(珠海銀科醫學工程股份有限公司)按照試劑說明書進行操作,培養7~10 d后觀察菌株生長情況,有細菌生長時可初步鑒定為NTM。
4.分枝桿菌菌種鑒定:同時將MGIT 960液體培養陽性且經分枝桿菌萋-尼抗酸染色鏡檢確認陽性的標本應用DNA微陣列芯片法試劑盒(北京博奧晶典生物技術有限公司)進行分枝桿菌菌種鑒定。嚴格按照說明書操作。將提取的核酸模板2 μl加入18 μl擴增反應液,擴增反應結束后將6 μl的擴增產物與9 μl雜交緩沖液混合。經95 ℃ 5 min變性后與芯片進行雜交。在50 ℃恒溫水浴鍋中雜交2 h后進行洗滌、掃描。參照試劑盒說明書進行結果判讀:當探針信號值大于參考值時判讀為陽性,否則為陰性。將所有探針信號值排序,獲取最大探針信號值。若最大信號值為陰性,則報告“無分枝桿菌”;若只有1條探針為陽性結果,則表示待測樣本為該探針所對應的分枝桿菌菌種或菌群;若1條以上探針為陽性結果,則通過探針組合情況來確定待測樣本所對應的分枝桿菌菌種或菌群。
5. GeneXpert檢測:對MPT64抗原檢測與分枝桿菌菌種鑒定結果不一致的菌株行GeneXpert檢測。按照試劑盒說明書進行操作。當GeneXpert檢測結果為陽性時,鑒定為MTB。
6.MPT64基因測序:將MPT64抗原檢測陰性而菌種鑒定結果為MTB的菌株及H37Rv對照菌株(來源于2019年中國疾病預防控制中心下發的熟練度測試菌株)及MPT64抗原檢測陽性的MTB臨床分離株各1株)所提取的DNA,依據之前報道的MPT64引物(正向:5′-TCGATCTGCTAGCTTGAGTCTGGT-3′;反向:5′-ACCACCGCACCAA GGCTGTCTA-3′)[7]進行基因擴增。擴增程序為95 ℃ 3 min預變性,95 ℃ 45 s變性,62 ℃ 45 s退火,72 ℃ 70 s延伸,共40個循環。擴增產物經1%瓊脂糖凝膠電泳確認并送生物工程(上海)有限公司測序。測序結果與H37Rv菌株在BioEdit軟件上使用Cluster W多序列比對,并標記發生突變的核苷酸序列。
三、統計學處理
采用SPSS 19.0軟件進行數據分析。計數資料采用“構成比或百分率(%)”表示。以基因芯片檢測為參考標準,評價MPT64抗原檢測MTB的診斷效能,各指標計算公式如下:敏感度=真陽性例數/(真陽性例數+假陰性例數)×100%;特異度=真陰性例數/(真陰性例數+假陽性例數)×100%;陽性預測值=真陽性例數/(真陽性例數+假陽性例數)×100%;陰性預測值=真陰性例數/(真陰性例數+假陰性例數)×100%;一致率=(真陽性例數+真陰性例數)/總例數×100%。各方法間的一致性檢驗采用Kappa檢驗,Kappa值≥0.75說明一致性較好;0.4≤Kappa值<0.75說明一致性一般;Kappa值<0.4說明一致性較差。
結 果
一、MPT64抗原檢測情況
1962株菌株的DNA微陣列芯片法菌種鑒定結果與培養后細菌PNB/TCH生長試驗結果一致,其中88株(4.5%)為NTM,1874株(95.5%)為MTB。88株NTM菌株中,MPT64抗原檢測陰性菌株87株(98.9%),1株陽性菌株經GeneXpert和PNB培養鑒定為MTB與NTM混合感染,但因NTM生長較快而在培養物中成為優勢菌。1874株MTB菌株中,MPT64抗原檢測陰性14株(0.7%),陽性1860株(99.3%)。對于分枝桿菌MGIT 960液體培養陽性標本,以DNA微陣列芯片法檢測結果為參照標準,MPT64抗原檢測對MTB的檢測效能見表1。
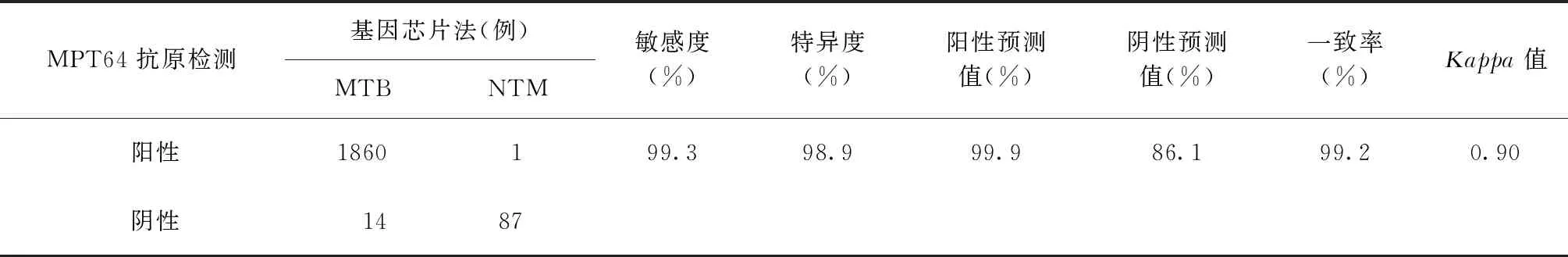
表1 MPT64抗原檢測以DNA微陣列芯片法為參照方法鑒定分枝桿菌菌種的結果
二、MPT64基因擴增產物瓊脂糖凝膠電泳結果
對MPT64抗原檢測陰性的14株MTB臨床分離株(1~14號)和1株H37Rv標準菌株(15號)及MPT64抗原檢測陽性的1株MTB臨床分離株(16號)的MPT64蛋白基因擴增后行1%瓊脂糖凝膠電泳,結果見圖1。與H37Rv標準菌株相比,3號標本有大約1300 bp的大片段插入,而其他MPT64抗原檢測陰性標本有小片段缺失。16號MPT64抗原檢測陽性MTB菌株與H37Rv菌株無肉眼可見差異。
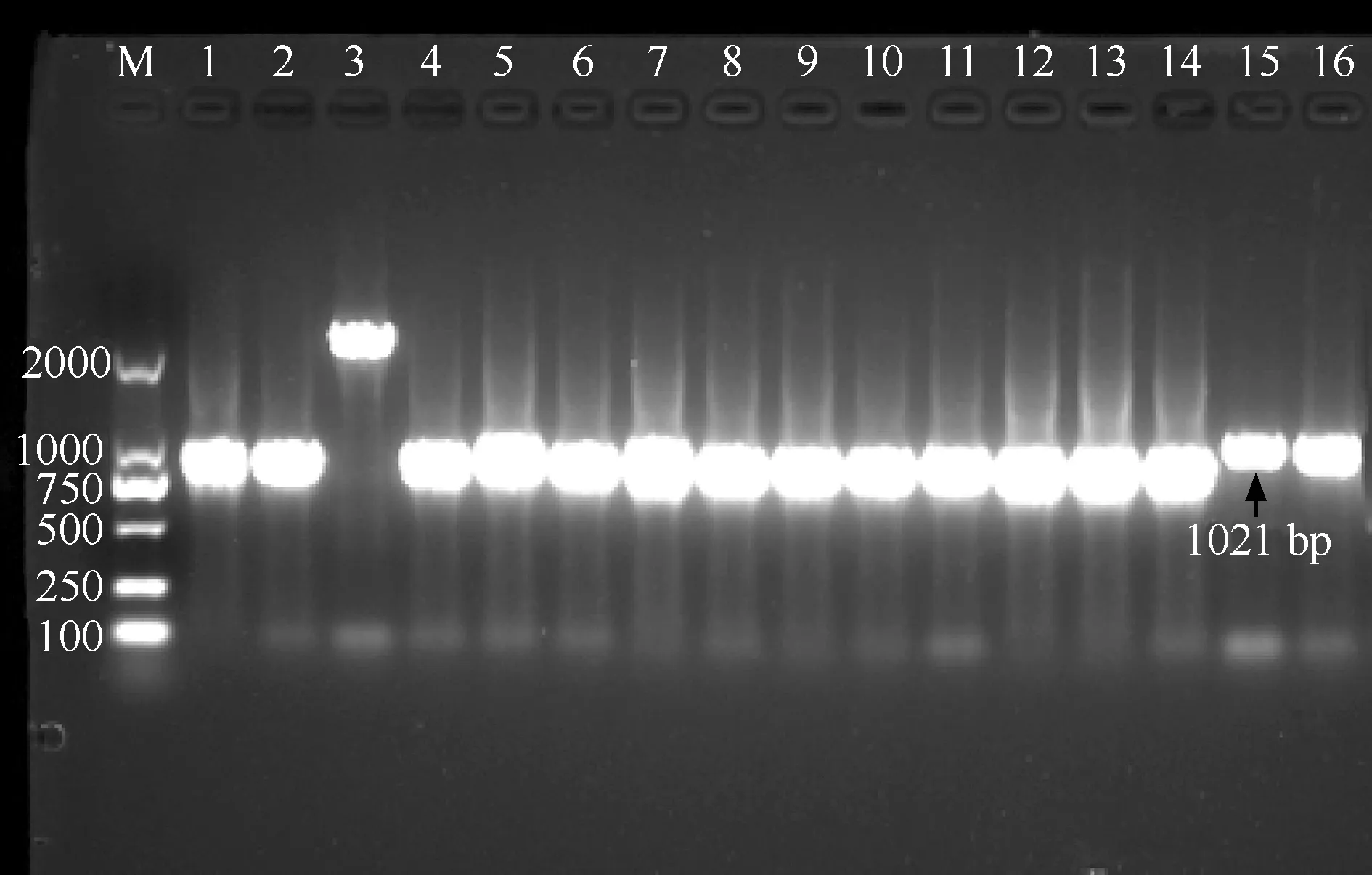
注 M:DNA相對分子質量Marker 2000 bp;1~14號泳道為MPT64抗原檢測陰性的結核分枝桿菌MPT64基因條帶,15號泳道為H37Rv標準菌株MPT64基因條帶,16號泳道為MPT64抗原檢測陽性結核分枝桿菌臨床分離株MPT64基因條帶
三、MPT64基因測序結果
對14株MPT64抗原檢測陰性的MTB臨床分離株、1株H37Rv標準菌株、1株MPT64抗原檢測陽性的MTB臨床分離株進行MPT64基因測序。結果顯示,14株MPT64抗原檢測陰性的MTB臨床分離株發生MPT64基因第197~259位核苷酸缺失突變,導致第66~86位氨基酸缺失者達92.9%(13/14);另1株(3號泳道)MPT64蛋白基因在第587位點插入了1361 bp的IS6110基因片段。而MPT64抗原檢測陽性的MTB臨床分離株與H37Rv標準菌株基因一致,未發生MPT64基因的突變。具體見表2。
討 論
MPT64抗原檢測是使用小鼠單克隆抗MPT64抗體檢測MTB菌株MPT64分泌蛋白的方法。MPT64分泌蛋白是由RD2區域基因編碼的主要濾液蛋白(相對分子質量24 000),能夠在培養早中期分泌并釋放于MTB菌體外。故MPT64抗原檢測的膠體金免疫層析法可以在短時間內實現對MGIT 960液體培養陽性分枝桿菌菌株的快速鑒定,有效區分MTB和NTM。既往有學者采用MTB抗原膠體金法檢測853株分枝桿菌臨床分離株,以PNB/TCH傳統菌種鑒定方法為參照標準,其敏感度、特異度、陽性預測值、陰性預測值分別為99.0%、98.9%、99.9%、91.8%[8]。然而,也有研究報道了MPT64抗原檢測存在假陰性的結果[4-5,7,9],這可能與培養液中細菌生長數量不足有關,但更多的報道認為與MPT64基因多態性相關[5,9]。
本研究顯示,對于分枝桿菌MGIT 960液體培養陽性標本,以DNA微陣列基因芯片法檢測結果為參照標準,MPT64抗原檢測MTB的陽性預測值達99.9%,可認為以MPT64抗原檢測陽性為確定分離培養物為MTB的方法具有較高的可靠性。同時,筆者對1874株MTB菌株行MPT64抗原檢測,共檢出14株(0.7%)陰性菌株,低于各地報道的占比(1.4%~6.8%)[5,10-11],可能與不同國家與地區流行的結核分枝桿菌復合群(MTBC)譜系間的差異有關[12]。故認為當 MGIT 960液體培養陽性標本經MPT64抗原檢測為陰性時,應進一步采用其他菌種鑒定方法,以避免誤診和漏診。
本研究對14株MPT64抗原檢測陰性的MTB行MPT64基因擴增測序,發現13株(92.9%)發生了MPT64基因第197~259位點的63 bp核苷酸缺失突變,導致第66~86位氨基酸的缺失,與易松林等[13]對2017年湖南省85株MPT抗原陰性的臨床分離株進行測序,有81株(95.3%)MPT64基因存在63 bp堿基缺失突變的研究結論相近。提示MPT64基因突變可能存在地域聚集性,但也可能存在多種單個位點突變或者單個堿基插入的情況。Jiang等[14]模擬分析了這些63 bp缺失的MPT64基因蛋白三級結構,結果顯示突變蛋白存在α螺旋缺陷,相鄰β片段卷曲程度增加,可能是發生整體拓撲結構變化的原因。此外,易松林等[13]研究還發現MPT64單位點非同義突變也會導致MPT64抗原檢測陰性,例如402位G→A突變,613與614位間插入堿基等。Chew等[15]對2012—2016年分離于新加坡的8株MPT64抗原檢測陰性的MTB菌株進行分析,結果顯示,6株存在MPT64基因63 bp堿基缺失突變,1株在第347位點插入2 bp堿基導致移碼突變,1株在第257位點發生非同義突變。2019年,Singh等[16]對印度10株MPT64抗原檢測陰性的MTB菌株進行測序,結果顯示,4株發生MPT64基因第26位G缺失突變,4株發生第37位C缺失突變,說明這兩種缺失突變均可導致氨基酸移碼突變,是編碼蛋白多樣性的原因。綜上,不同地區的MPT64蛋白基因多態性存在一定差異,但63 bp 堿基缺失突變是我國境內報道的MPT64抗原檢測陰性的主要原因。
本研究報道了中國第1株因MPT64基因第587位點插入IS6110基因片段而導致MPT64抗原檢測陰性的MTB菌株,雖與Hillemann等[17]在2005年德國報道的1株因MPT64蛋白基因第177位點插入IS6110的多拷貝而導致MPT64蛋白序列中斷的IS6110插入位置不一致,但這兩種位點IS6110插入均導致了MPT64蛋白的變化,可認為是MPT64抗原檢測陰性的原因。
綜上,MPT64抗原檢測操作簡單、時效性強、敏感度高,可用于培養陽性MTB與NTM的快速鑒定。MPT64蛋白基因第197~259位點的63 bp核苷酸缺失突變及IS6110插入突變是本研究MPT64檢測陰性的主要原因。但由于MPT64抗原檢測陰性不能完全排除結核病診斷,仍需使用其他鑒定方法復核。另外,本研究為單中心研究,獲得的樣本數量較少,代表性欠佳。此外,對于MPT64檢測陽性MTB菌株是否存在MPT64基因的同義突變、單位點插入也有待進一步研究。

