基于網絡藥理學與分子對接探討黃芪治療潰瘍性結腸炎的作用機制
郝民琦 王佳慧 李曉玲 李海龍 吳玉泓
中圖分類號 R285;R574.1 文獻標志碼 A 文章編號 1001-0408(2021)10-1215-09
DOI 10.6039/j.issn.1001-0408.2021.10.10
摘 要 目的:預測黃芪對潰瘍性結腸炎(UC)的可能作用靶點與機制,為臨床應用黃芪治療UC的后續研究提供參考。方法:經中藥系統藥理學分析平臺數據庫(TCMSP)和UniProt KB數據庫檢索黃芪的活性成分及其對應靶點基因,經Gene Cards數據庫檢索UC疾病相關靶點基因,借助Venny 2.1.0在線作圖工具獲取黃芪與UC的交集靶點基因,并應用Cytoscape 3.7.0軟件構建“藥物-化合物-交集靶點”相互作用網絡。利用STRING數據庫獲取交集靶點的蛋白質-蛋白質相互作用關系(PPI)網絡,并應用Cytoscape 3.7.0軟件進行可視化分析和拓撲學分析以獲取核心靶點基因。借助DAVID數據庫對交集靶點基因進行基因本體(GO)功能注釋及KEGG通路富集,并應用Cytoscape 3.7.0軟件構建“靶點-通路”富集網絡。通過AutoDock vina 1.1.2軟件將度值排名前5位的活性成分與核心靶點基因編碼蛋白進行分子對接,應用Discovery Studio 3.5軟件繪制結合模式圖。結果:黃芪中共有化合物143個,共篩選出了活性成分20個,對應的靶點基因189個;UC疾病相關靶點基因共4 356個。黃芪(涉及14種活性成分)與UC的交集靶點基因有126個。PPI網絡中的核心靶點基因為AKT1、MAPK1、RB1、JUN等。GO功能注釋共得到GO條目2 294個(q值<0.05),包括生物過程條目2 093個(如對脂多糖的反應、對細菌來源分子的反應等)、細胞組成條目49個(如膜筏、膜微區等)、分子功能條目152個(如核受體活性、配體激活的轉錄等)。KEGG通路富集分析共得到條目160個(q值<0.05),如流體剪切應力和動脈粥樣硬化信號通路、磷脂酰肌醇3激酶/蛋白激酶B(PI3K/Akt)、白細胞介素17(IL-17)信號通路等。分子對接結果顯示,度值排名前5位的活性成分(槲皮素、山柰酚、芒柄花黃素、異鼠李素、7-O-methylisomucronulatol)與核心靶點編碼蛋白的結合能均小于-5.0 kcal/mol。結論:黃芪中的槲皮素、山柰酚、芒柄花黃素異等活性成分可能通過作用于MAPK14、JUN、AKT1等靶點基因,進而對PI3K/Akt、IL-17等信號通路產生調控作用,最終發揮對UC的治療作用。
關鍵詞 黃芪;活性成分;潰瘍性結腸炎;網絡藥理學;分子對接;作用機制
Study on the Mechanism of Astragali Radix in the Treatment of Ulcerative Colitis Based on Network Pharmacology and Molecular Docking
HAO Minqi1,2,3,WANG Jiahui1,2,LI Xiaoling1,2,LI Hailong2,4,WU Yuhong1(1. School of Basic Medicine, Gansu University of TCM, Lanzhou 730000, China; 2. Key Laboratory of Dunhuang Medicine and Its Transformation of Ministry of Education, Gansu University of TCM, Lanzhou 730000, China; 3. Key Laboratory of TCM Mining and Innovation Transformation, Gansu University of TCM, Lanzhou 730000, China; 4. First Clinical Medicial School, Gansu University of Chinese Medicine, Lanzhou, 730000, China)
ABSTRACT? ?OBJECTIVE:To predict the potential target and mechanism of Astragali Radix in the treatment of ulcerative colitis (UC), and to provide reference for the clinical application of Astragali Radix in the treatment of UC. METHODS:The active components and their corresponding target genes of Astragali Radix were retrieved by TCMSP and UniProt KB database. The related target genes of UC were searched by Gene Cards database. The intersection target genes of Astragali Radix and UC were obtained by Venny 2.1.0 online mapping tool, and interaction network of “drug-compound-intersection target” was constructed by using Cytoscape 3.7.0 software. PPI network of intersecting targets was obtained by using STRING database, and the visualization analysis and topological analysis were carried out by using Cytoscape 3.7.0 software to obtain the core target genes. By using DAVID database, the gene ontology (GO) function annotation and KEGG pathway enrichment of intersecting target genes were carried out, and the “target-pathway” enrichment network was constructed by using Cytoscape 3.7.0 software. Through AutoDock vina 1.1.2 software, the top five active components in the list of degree value were linked with the protein encoded by the core target genes; Discovery Studio 3.5 software was applied to draw out binding pattern map. RESULTS:There were 143 compounds in Astragali Radix, 20 active components were screened out, and 189 corresponding target genes were selected; there were 4 356 UC disease related target genes. There were 126 intersection target genes of Astragali Radix (involving 14 active components) and UC. The core target genes in PPI network were AKT1, MAPK1, RB1, JUN, etc. A total of 2 294 GO items (q value<0.05) were obtained from GO functional annotation, including 2 093 biological process items (e.g. response to lipopolysaccharide, response to molecule of bacterial origin), 49 cell composition items (e.g. membrane raft, membrane microdomain), and 152 molecular function items (e.g. nuclear receptor activity, ligand-activated transcription factor activity). KEGG pathway enrichment analysis yielded 160 items (q value<0.05), such as fluid shear stress and atherosclerosis signaling pathway, phosphatidylinositol 3 kinase/protein kinase B (PI3K/Akt) signaling pathway,interleukin-17 (IL-17) signaling pathway. Molecular docking results showed that top 5 active ingredients (quercetin, kaempferol, formenonetin, isorhamnetin, 7-O-methylisomucronulatol) in the list of degree value had binding energies<5.0 kcal/mol with the protein encoded core targets. CONCLUSIONS: Quercetin, kaempferol, formononetin and other active components in Astragali Radix may play a role in the treatment of UC through the action of MAPK14,JUN,AKT1 and other target genes,and then on the signal pathways such as PI3K/Akt and IL-17.
KEYWORDS? ?Astragali Radix; Active ingredients; Ulcerative colitis; Network pharmacology; Molecular docking; Mechanism of action
潰瘍性結腸炎(UC)是一種慢性、非特異性腸道炎癥性疾病,其臨床多表現為反復發作或持續性的腹痛、腹瀉、黏液膿血便或不同程度的全身癥狀[1]。歷代中醫學家認為,該病的主要病因為內外之邪影響脾胃,使脾胃運化失司,而脾胃氣虛是發病的根本[2]。黃芪為豆科植物蒙古黃芪Astragalus membranaceus(Fisch.)Bge. var. mongholicus(Bge.)Hsiao或膜莢黃芪Astragalus membranaceus(Fisch.)Bge.的干燥根,具有補氣固表、利水退腫、托毒排膿等功效[3]。現代藥理研究表明,黃芪的主要成分有黃芪多糖、黃芪甲苷Ⅳ以及黃酮類、生物堿類、氨基酸類化合物等,在保護腸黏膜、抗炎、調節免疫等方面有重要作用[4-5]。相關研究發現,黃芪納米制劑在扶植UC模型大鼠腸道正常菌群生長、調節菌群失調等方面發揮了良好的作用,且其作用優于雙歧桿菌活菌膠囊[6-7]。趙先亮等[8]研究發現,在UC患者天樞、大腸俞等穴位注射黃芪注射液具有較好的療效。由此可見,黃芪及其活性成分在治療UC方面具有一定的開發價值。網絡藥理學突破了“單藥物、單靶點”的傳統理念,借助拓撲學分析、生物信息技術分析可以更系統、整體地探究傳統中藥的潛在作用靶點,充分挖掘其分子作用機制,為現代中醫藥研究提供了新的思路[9]。基于此,本研究擬通過網絡藥理學技術,探討黃芪治療UC多成分、多途徑、多靶點的整體調節作用機制,并將篩選出的核心靶基因與黃芪的主要活性成分進行分子對接,以初步驗證黃芪治療UC的主要成分與靶點,進而為其治療UC的相關后續研究提供參考。
1 材料與方法
1.1 黃芪活性成分篩選及靶點基因收集
通過中藥系統藥理學分析平臺數據庫(TCMSP,http://tcmspw.com/),以生物口服利用度(OB)≥30%、類藥性指數(BL)≥0.18作為篩選條件[9],篩選黃芪的活性成分。在UniProt KB數據庫(http://www.uniprot.org/)中,以“Organism:Homo sapiens(物種:智人)”為查詢條件,檢索上述活性成分對應靶點的UniProt ID,獲取對應的基因簡稱,去重后即得黃芪活性成分的對應靶點基因。
1.2“藥物-化合物-交集靶點”互作網絡構建
以“Ulcerative colitis”為關鍵詞,從Gene Cards數據庫(http://www.genecards.org/)中檢索UC疾病相關靶點基因。將其與“1.1”項下所得活性成分對應靶點基因分別上傳至Venny 2.1.0在線作圖工具(https://bioinfogp.cnb.csic.es/tools/venny/index.html)中,繪制韋恩圖,得到黃芪與UC的交集靶點基因。將黃芪活性成分信息、交集靶點基因信息分別導入Cytoscape 3.7.0軟件中,構建“藥物-化合物-交集靶點”互作網絡,應用該軟件中“Analyze network”功能對上述網絡進行拓撲學分析。網絡中,節點代表藥物、活性成分和交集靶點基因,節點之間以邊相連接;節點度值表示與節點相連邊的數量,其值越大,即與其相連的節點就越多,表明該節點在網絡中越重要,在整個網絡中起到樞紐的作用,可能是關鍵成分或者靶點[10]。
1.3 蛋白質-蛋白質相互作用網絡構建及核心靶點篩選
將黃芪與UC交集基因導入到STRING數據庫(http://string-db.org/)中,選擇“Multiple proteins(多種蛋白質)”選項,種屬設置為“Homo sapiens(智人)”,置信度設為“0.9”,并選擇隱藏散在的節點,以獲取交集靶點基因的蛋白質-蛋白質相互作用(PPI)網絡。應用Cytoscape 3.7.0軟件對結果進行可視化分析(網絡中,節點的大小及顏色的深淺與節點的重要性成正相關),并借助該軟件的“CytoNCA”插件進行拓撲學分析,分別以介數中心性、接近中心性、度中心性、特征向量中心性、局部平均連通度、網絡中心性等參數的中位值為篩選條件,應用R 4.0.2軟件進行2次篩選,每次僅選取所有參數均大于中位值的靶點進項下一次打分,末次打分所剩的靶點則為核心靶點。其中,介數中心性代表經過某一節點的最短路徑的數量;接近中心性計算節點與網絡中其他節點的平均距離,接近中心性越大的節點其信息流動性越佳;度中心性是某一節點與其他節點的鏈接性,表示節點的最直接影響力;特征向量中心性表示某一節點所處的周圍環境即鄰居節點的數量及質量;局部平均連通度則注重節點與節點之間的相互影響,是對度中心性的補充;網絡中心性作為一種新的基于邊緣聚類系數的關鍵蛋白中心性度量,既考慮了節點的中心性,又考慮了節點與相鄰節點之間的關系;這6個參數代表了整個網絡中每個單獨節點的拓撲重要性,其量化值越大,說明節點在該網絡中越重要[11-13]。
1.4 基因本體功能注釋和KEGG信號通路富集
基于DAVID數據庫(https://david.ncifcrf.gov/)對黃芪與UC的交集靶點基因進行基因本體(GO)功能注釋和KEGG通路富集分析。限定物種為“Human(人類)”,保留q值(即校正后的P值)小于0.05的富集條目,并按照q值大小進行排序。GO分析選取排名前10位的富集結果進行展示,KEGG分析選取排名前20位的富集結果進行展示。將KEGG通路富集結果和交集靶點基因信息導入Cytoscape 3.7.0軟件中,構建“靶點-通路”富集網絡,實現富集分析結果的可視化。
1.5 “藥物成分-核心靶點”分子對接驗證
從PubChem數據庫(https://pubchem.ncbi.nlm.nih.gov/)中下載“1.1”項下黃芪活性成分中度值排名前5位的化合物的2D結構,保存為“SDF”格式,作為小分子配體。從PDB數據庫(https://www.rcsb.org/)中下載核心靶點對應蛋白的3D結構,保存為“PDB”格式,作為蛋白受體。利用Discovery Discovery Studio 3.5軟件對蛋白受體進行去除原配體、水分子及添加氫原子等預處理并尋找活性口袋;然后,采用AutoDockTools 1.5.1軟件定義小分子配體,將小分子配體保存為“pdbqt”格式,并采用AutoDock vina 1.1.2軟件對核心靶點蛋白受體和黃芪活性成分小分子配體進行分子對接[14]。通過兩者結合能來評價其結合活性:若結合能<0 kcal/mol,則表示配體與受體能夠自發地結合;結合能<-5.0 kcal/mol,表明結合活性良好,且結合能越小表明對接越穩定(1 kcal=4.186 J)[15]。選取結合能≤-7.0 kcal/mol的受體-配體分子對接結果并應用Discovery Studio 3.5軟件繪制核心靶點蛋白受體和黃芪活性成分小分子配體之間的結合模式圖,分別以3D和2D結構進行對接模式展示。
2 結果
2.1 黃芪中活性成分的篩選結果
通過TCMSP檢索發現,黃芪中共含有143個化合物,經篩選后得到20個活性成分。黃芪活性成分的基本信息見表1。
2.2 “藥物-化合物-交集靶點”相互作用網絡的分析結果
從UniProt KB數據庫中共獲得黃芪活性成分對應靶點基因405個,去重后得到靶點基因189個;從Gene Cards數據庫中共篩選出UC疾病相關靶點基因4 356個。兩者取交集后共得到交集靶點基因126個。黃芪與UC交集靶點基因的韋恩圖見圖1。
“藥物-化合物-交集靶點”相互作用網絡見圖2(圖中,中央圓形節點代表黃芪,外周圓形節點代表黃芪活性成分,節點上的編號為化合物對應的TCMSP編號,綠色矩形代表“藥物-疾病”交集靶點,活性成分節點的大小代表與其所連接的靶點數目成正比)。由圖2可見,該網絡中共包括節點141個、邊274條。該網絡中,每個化合物平均與18.571個靶點相互作用,每個靶點平均與2.063個化合物相互作用。通過比較“藥物-化合物-交集靶點” 網絡中各成分的度值,篩選出排名前5位的活性成分分別是槲皮素、山柰酚、芒柄花黃素、異鼠李素、7-O-methylisomucronulatol,分別能與108、35、20、20、18個靶點蛋白發生作用;排名前5位的靶點蛋白分別是前列腺素內過氧化物合酶2(PTGS2)、PTGS1、熱休克蛋白90α家族A類成員1(HSP90AA1)、蛋白質絲氨酸蛋白酶1(PRSS1)、類視黃醇X受體α(RXR-α),分別能與13、11、10、10、8個成分發生作用。
2.3 PPI網絡構建及核心靶點基因的篩選結果
拓撲學分析結果顯示,PPI網絡中共包含節點112個、邊447條。經Cytoscape 3.7.0軟件中“CytoNCA”插件兩次篩選后最終得到8個核心靶點基因,即RELA、MYC、IL2、MAPK14、JUN、MAPK1、AKT1、RB1。黃芪與UC交集靶點基因的PPI網絡如圖3,PPI核心靶點基因的篩選流程見圖4,核心靶點基因的拓撲參數詳見表2。
2.4 GO功能注釋和KEGG 通路富集分析的結果
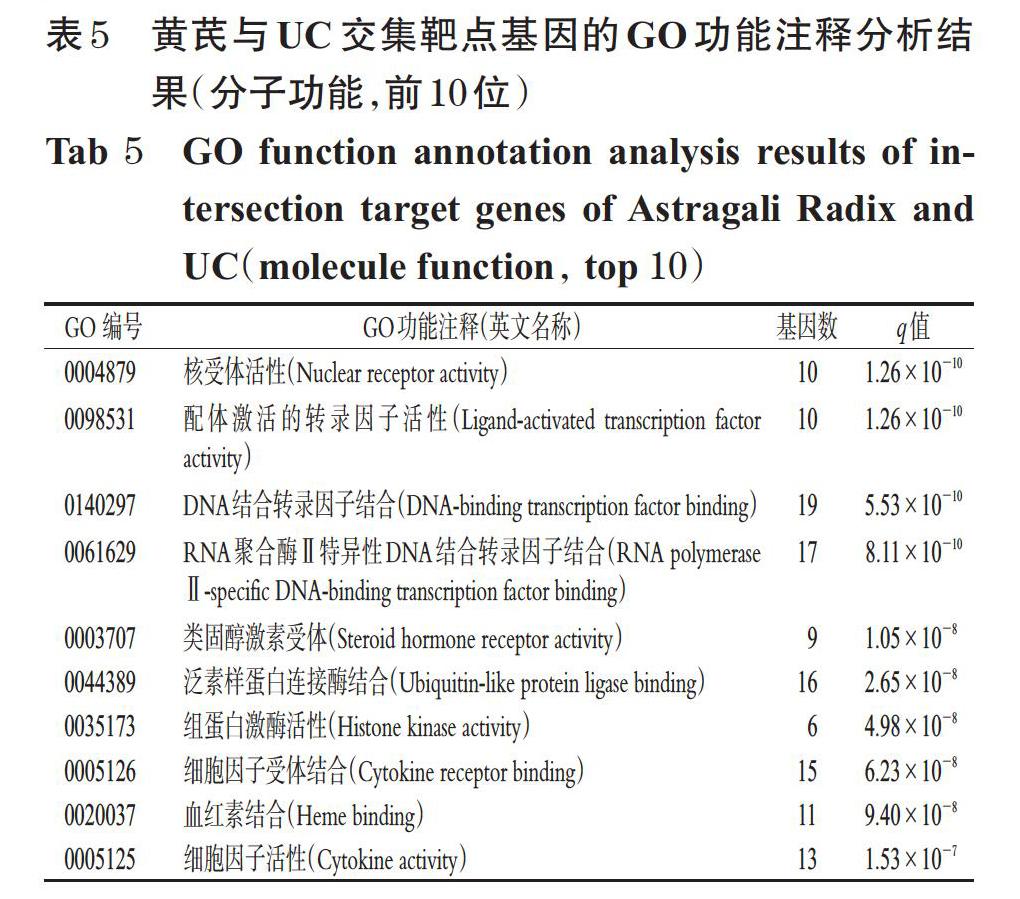
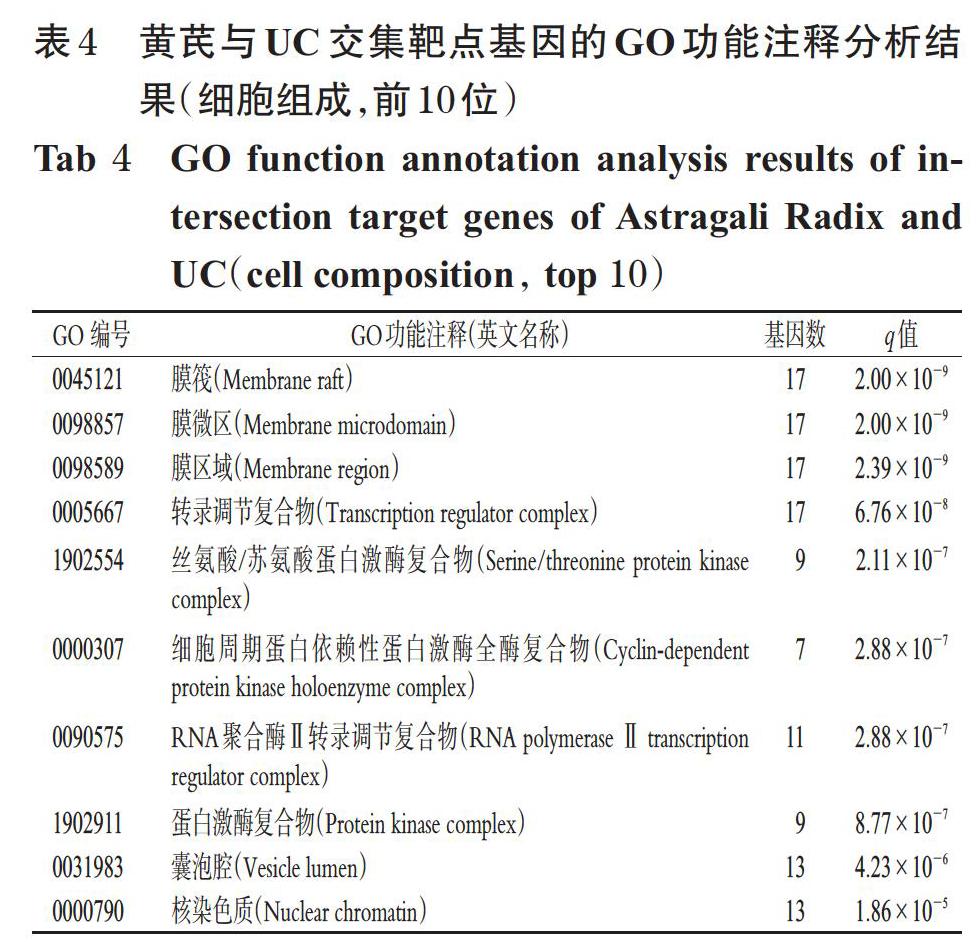
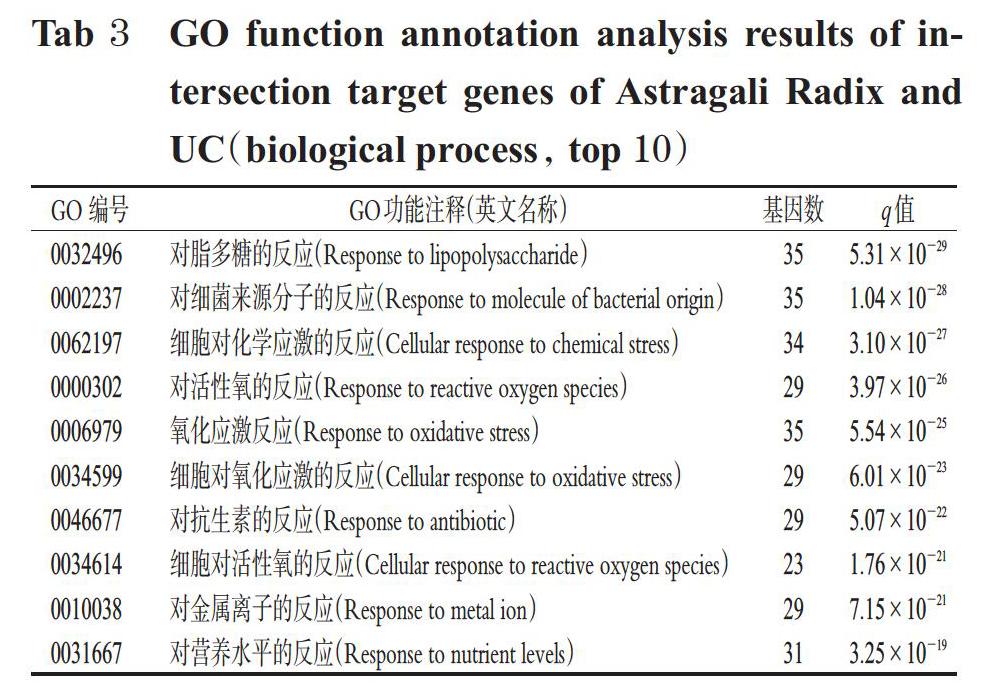
通過GO功能注釋分析共得到條目2 294個(q值<0.05),包括生物過程2 093個、細胞組成49個、分子功能152個。分析發現,其生物過程涉及對脂多糖的反應、對細菌來源分子的反應、細胞對化學應激的反應等;細胞組成涉及膜筏、膜微區、膜區域、轉錄調節復合物等;分子功能主要集中于核受體活性、配體激活的轉錄因子活性、DNA結合轉錄因子結合等,詳見表3、表4、表5。
KEGG通路富集共獲得條目160個(q值<0.05),排名靠前的通路包括糖尿病并發癥中晚期糖基化終產物及其受體(AGE-RAGE)信號通路、流體剪切應力和動脈粥樣硬化信號通路、前列腺癌信號通路、乙型肝炎、白細胞介素17(IL-17)信號通路等。KEGG富集分析結果(前20條)見表6,其富集網絡(前20條)見圖5。
2.5 黃芪主要活性成分與核心靶點蛋白的分子對接結果
“藥物-化合物-交集靶點”互作網絡中度值排名前5位的主要活性成分與PPI核心靶點基因JUN、MAPK1、ATK1、IL2、MAPK14、RB1(RELA和MYC基因在數據庫中未找到對應蛋白晶體結構)編碼蛋白分子對接的結合能分數色 階圖見圖6。由圖6可知,各組合對接分數均小于-5.0 kcal/mol,表明結合活性良好。以上結果說明,黃芪的主要活性成分對UC的核心靶點具有很強的關聯性,而上述活性成分與核心靶點可能是黃芪治療UC的主要作用靶點。
結合能≤-7.0 kcal/mol的受體-配體分子對接結果3D、2D示意圖見圖7(圖中,黑色背景為3D結構圖,主要展示對接位置及形態;白色背景為2D結構圖,主要展示對接成鍵信息)。氫鍵是促使配體結合到活性位點的主要作用力[16]。由圖7可知,槲皮素可與MAPK1基因編碼蛋白(PDB 編號6d5y)的活性位點MET-108、VAL-39形成氫鍵;槲皮素可與RB1基因編碼蛋白(PDB 編號1gux)的活性位點ARG-552形成氫鍵;7-O-methylisomucronulatol可與RB1基因編碼蛋白(PDB 編號1gux)的活性位點ARG-552、ARG-556形成氫鍵;芒柄花黃素可與ATK1基因編碼蛋白(PDB 編號1unp)的活性位點GLU-40、GLN-43、GLN-47形成氫鍵;芒柄花黃素可與RB1基因編碼蛋白(PDB 編號1gux)的活性位點THR-738、ARG-556形成氫鍵,并可在HIS-699處形成π-π堆積;異鼠李素可與MAPK1基因編碼蛋白(PDB 編號6d5y)的活性位點MET-108、GLU-33形成氫鍵;異鼠李素可與MAPK14基因編碼蛋白(PDB 編號5eti)的活性位點LEU-164、ASN-82、ASN-159形成氫鍵;異鼠李素與RB1基因對應蛋白(PDB編號1gux)的活性位點ARG-556、ARG-552處形成氫鍵;山柰酚可與MAPK14基因編碼蛋白(PDB編號5eti)的活性位點ASN-159、ASN-82形成氫鍵;山柰酚可與RB1基因編碼蛋白(PDB 編號:1gux)的活性位點ARG-741、ARG-698、ARG-552、HIS-733形成氫鍵。
3 討論
UC是以持續或反復發作的腹瀉、黏液膿血便為主要臨床表現,伴腹痛、里急后重和不同程度全身癥狀的一種慢性非特異性腸道炎癥性疾病,其病因病機尚未完全明確[17]。近年來的研究多認為,UC的發生發展是外源有害物質進入體內所致宿主反應、遺傳基因調控和過度免疫反應三者之間相互作用的結果[18-19],且與腸黏膜局部免疫反應異常的關系尤為密切[16]。目前中醫臨床認為,UC發病的根本原因為脾胃氣虛,治療宜以益氣健脾為主[20]。基于數據挖掘和文獻分析顯示,在用于治療UC的中藥當中,補虛藥黃芪的使用頻次最高[21-25]。黃芪性微溫,味甘,歸脾、肺二經,具有補氣固表、利水退腫、托毒排膿、生肌等功效[3,26]。相關研究表明,黃芪能夠保護免疫系統及腸黏膜屏障、抑制腸道內細菌生長[27]。由此可見,黃芪可通過上述途徑發揮對UC的治療作用,但其具體分子調控機制仍不明確。
本研究結果表明,槲皮素、山柰酚、芒柄花黃素異、鼠李素、7-O-methylisomucronulatol等活性成分的作用靶點基因較多,為黃芪的主要活性成分。相關藥理研究表明,槲皮素最為核心且最為顯著的功效即為調節炎癥,其可通過抑制炎性細胞因子及炎癥誘導酶而發揮抗炎作用[28]。山柰酚具有極強的抗炎活性,可緩解炎癥反應,具有保護結腸黏膜的作用[29]。氧自由基(ORF)具有很強的氧化作用,可引起細胞損傷及死亡,而芒柄花黃素能夠有效抑制并清除體外反應體系中的ORF,對機體具有保護作用,且芒柄花黃素還具有抗炎活性[30-31]。異鼠李素屬于黃酮類化合物,其抗炎作用可涉及中樞神經系統、循環系統以及消化系統等,可通過抑制炎性細胞因子的表達來阻斷核因子κB(NF-κB)以及p38絲裂原活化蛋白激酶(p38 MAPK)信號通路,進而發揮抗炎作用[32]。
通過對交集靶點基因進行GO功能注釋分析發現,黃芪可以通過多種生物過程、細胞組成和分子功能對UC進行調控。KEGG通路富集結果表明,AGE-RAGE信號通路、流體剪切應力和動脈粥樣硬化、前列腺癌、PI3K/Akt、IL-17、TNF等信號通路為主要的調節通路,提示不同疾病之間可能存在著相同的調節機制。研究發現,PI3K/Akt信號通路活化后可啟動下游的NF-κB通路,釋放促凋亡蛋白和炎性細胞因子,促進腸上皮細胞凋亡,從而維持腸道炎癥,最終導致UC遷延難愈[33-34]。阻斷該通路后,NF-κB活化將受到抑制,使得炎性細胞因子的表達下調,從而修復結腸黏膜的炎癥損傷[35]。IL-17通過與IL-17受體結合,誘發下游信號通路轉導,從而進一步誘導細胞因子和趨化因子的表達,與炎癥和自身免疫疾病息息相關[36];此外,IL-17還可通過活化MAPK等通路誘導中性粒細胞聚集以誘發炎癥,如代表免疫失衡的輔助性T 細胞17(Th17)細胞水平升高以及外周血中IL-17含量升高均可見于炎癥性腸病中[37]。在TNF信號通路中,TNF-α可通過上調NF-κB等因子來誘導多種效應分子的表達,從而實現白細胞募集、炎癥級聯放大等效應,進而加重UC的炎癥反應[38]。
PPI網絡的拓撲學分析結果表明,MAPK14、IL2、MAPK1等8個靶點基因處于網絡的核心位置,這8個靶點基因不僅對應多個活性成分,而且在PPI網絡中具有重要作用,提示這8個基因可能是黃芪發揮治療作用的極重要的靶點。如MAPK基因與細胞增殖、凋亡和炎癥等多種生命活動有關,參與細胞對多種刺激的反應,其可調節細胞增殖、分化,影響細胞的存活和凋亡,與UC的發生密切相關[39-40]。IL-2是一種具有多種生物學活性的細胞因子,其對免疫調節有很大的作用,可與單核細胞體結合,增強T細胞活化和細胞殺傷作用[41]。分子對接結果表明,核心靶點與黃芪主要活性成分均擁有良好的對接活性(結合能<-5.0 kcal/mol),進一步說明了黃芪主要活性成分可通過調控上述核心靶點對UC起到治療作用,驗證了上述網絡藥理學預測結果的可靠性。
綜上所述,黃芪中的槲皮素、山柰酚、芒柄花黃素異、鼠李素等活性成分可通過作用于MAPK14、MAPK1、JUN、AKT1等靶點基因,進而對TNF、PI3K/Akt等信號通路產生調控作用,從而發揮其對UC的治療作用。從分析結果中還可以看出,通路及靶點之間存在著交叉作用,同一靶點可通過調控多條通路而發揮對疾病的治療作用,而代表不同疾病的信號通路(如癌癥、肝炎等信號通路)又包含相同的靶點,這與中醫學“同病異治,異病同治”的思想較為符合,也從現代分子生物學角度初步印證了中藥多靶點、多通路、多途徑的治療特點。
參考文獻
[ 1 ] RUBIN D T,ANANTHAKRISHNAN A N,SIEGEL C A,et al. ACG clinical guideline:ulcerative colitis in adults[J]. Am J Gastroenterol,2019,114(3):384-413.
[ 2 ] 汪蕓,崔丁鹿.潰瘍性結腸炎脾胃氣虛證的研究進展[J].現代中西醫結合雜志,2015,24(25):2845-2847.
[ 3 ] 國家藥典委員會.中華人民共和國藥典:一部[S]. 2020年版.北京:中國科技出版社,2020:315.
[ 4 ] ZHANG W,MA W,ZHANG J,et al. The immunoregulatory activities of astragalus polysaccharide liposome on macrophages and dendritic cells[J]. Int J Biol Macromol,2017,105(Pt 1):852-861.
[ 5 ] 劉佳麗,孫平良,李忠海,等.黃芪對潰瘍性結腸炎的研究進展[J].中華中醫藥學刊,2021,39(3):160-163.
[ 6 ] 孫立群,梁金花,高月娟.探討納米級中藥黃芪對潰瘍性結腸炎大鼠腸道菌群失調的調整作用[J].中國中醫急癥,2012,21(8):1263-1265.
[ 7 ] 梁金花,鄭科文,孫立群.探討中藥黃芪多糖對潰瘍性結腸炎大鼠腸道菌群失調的調整作用[J]. 微量元素與健康研究,2013,30(2):1-3.
[ 8 ] 趙先亮,王雪芹.黃芪注射液穴位注射治療慢性潰瘍性結腸炎80例[J].河南中醫,2006,26(8):73-74.
[ 9 ] 付海榮,龐毅,譚家華,等.山豆根治療白血病作用機制的網絡藥理學研究[J].中國藥房,2019,30(24):3392-3398.
[10] 何天目,段燦燦,李曉飛,等.基于網絡藥理學和分子對接探索血必凈注射液治療冠狀病毒肺炎的潛在機制[J].中國現代應用藥學,2020,37(4):398-405.
[11] LI M,WANG J,CHEN X,et al. A local average connecti- vity-based method for identifying essential proteins from the network level[J]. Comput Biol Chem,2011,35(3):143-150.
[12] LI M,ZHENG R,ZHANG H,et al. Effective identification of essential proteins based on priori knowledge,network topology and gene expressions[J]. Methods,2014,67(3):325-333.
[13] 任曉龍,呂琳媛. 網絡重要節點排序方法綜述[J].科學通報,2014,59(13):1175-1197.
[14] TROTT O,OLSON A J. AutoDock vina:improving the speed and accuracy of docking with a new scoring function,efficient optimization,and multithreading[J]. J Comput Chem,2010,31(2):455-461.
[15] 石少瑜.彝族“黃藥”艾納香正丁醇部位化學成分分離及其抗A549、NCI-H1299細胞活性[D].北京:中央民族大學,2020.
[16] 黃友,楊莎莎,林夏,等.基于網絡藥理-分子對接研究附子理中丸治療潰瘍性結腸炎的作用機制[J].藥學學報,2020,55(8):1812-1822.
[17] 毛慧芳,安冬,李璐,等.不同中醫證型潰瘍性結腸炎腸道菌群特征性變化研究進展[J].中國中醫藥信息雜志,2020,27(10):141-144.
[18] SHAM H P,BAZETT M,BOSILJCIC M,et al. Immune stimulation using a gut microbe-based immunotherapy reduces disease pathology and improves barrier function in ulcerative colitis[J]. Front Immunol,2018,27(9):2211.
[19] LEBER A,HONTECILLAS R,TUBAU-JUNI N,et al.NLRX1 modulates immunometabolic mechanisms controlling the host-gut microbiota interactions during inflammatory bowel disease[J]. Front Immunol,2018,26(9):363.
[20] 石琳妮,張高松.黃芪顆粒聯合雙歧桿菌四聯活菌片治療潰瘍性結腸炎臨床研究[J].新中醫,2019,51(6):159- 162.
[21] 董文海,韓梅,張俊仲.中藥治療潰瘍性結腸炎的用藥規律分析[J].光明中醫,2018,33(18):2640-2642.
[22] 遲宇鈞.基于文獻分析的中醫藥治療潰瘍性結腸炎古今用藥規律的研究[D].沈陽:遼寧中醫藥大學,2017.
[23] 裴銀奇,趙黨生.基于中醫傳承輔助系統的潰瘍性結腸炎方劑用藥規律分析[J].亞太傳統醫藥,2016,12(24):92- 94.
[24] 劉冬梅,王德運.中醫藥治療潰瘍性結腸炎活動期的數據挖掘[J].山西中醫,2016,32(8):48-50.
[25] 劉啟鴻,趙培琳,方文怡,等.基于文獻分析中醫藥治療潰瘍性結腸炎用藥規律[J].福建中醫藥,2019,50(3):10-12.
[26] 王東博,趙曼佳,代云桃,等.黃芪分析方法的優化和黃芪標準湯劑的質量評價[J].中國中藥雜志,2020,45(1):119-123.
[27] 鄧蓓蓓.黃芪多糖對重癥急性胰腺炎大鼠腸黏膜屏障損傷的保護作用[D].長春:吉林大學,2017.
[28] 楊穎,王蕓蕓,蔣琦辰.槲皮素藥理作用的研究進展[J].特種經濟動植物,2020,23(5):24-28.
[29] 徐甜,連雅君,李振漢,等.當歸-白芍藥對治療潰瘍性結腸炎的網絡藥理學研究[J].中華中醫藥學刊,2020,38(1):173-176.
[30] 楊雅靜.芒柄花黃素對實驗小鼠免疫功能的影響[D].唐山:華北理工大學,2019.
[31] 王茹月,葉雨.芒柄花黃素應用于抗癌藥物開發的研究進展[J].腫瘤防治研究,2019,46(2):183-187.
[32] 閆姍,王曉坤,楊林燕,等.異鼠李素的抗炎作用研究進展[J].甘肅科技,2020,36(13):115-118.
[33] 蔣寅.黃芩苷對潰瘍性結腸炎PI3K/Akt/NF-κB信號通路的影響及其機制研究[D].南京:南京中醫藥大學,2016.
[34] HUANG X L,XU J,ZHANG X H,et al. PI3K/Akt signa- ling pathway is involved in the pathogenesis of ulcerative colitis[J]. Inflamm Res,2011,60(8):727-734.
[35] 張超賢,郭李柯,郭曉鳳.三硝基苯磺酸/乙醇灌腸液誘導大鼠潰瘍性結腸炎TLR4/NF-κB和PI3K/AKT/NF-κB信號通路的表達及電針的干預作用[J].西安交通大學學報(醫學版),2015,36(2):263-270.
[36] 馬春梅.絲/蘇氨酸蛋白激酶NDR1正向調控IL-17誘導的炎癥及作用機制[D].杭州:浙江大學,2016.
[37] 郭小芹. IL-17/IL-17R通路在炎癥性腸病中的免疫調節機制研究[D].北京:中國人民解放軍軍事醫學科學院,2013.
[38] 馬遙,姜兆偉,靳云軼,等.大鼠牙周炎正畸牙移動初期TNF信號通路的基因本體分析[J].口腔疾病防治,2019,27(11):695-702.
[39] LIAN L,ZHANG S,YU Z,et al. The dietary freeze-dried fruit powder of actinidia arguta ameliorates dextran sulphate sodium-induced ulcerative colitis in mice by inhibi- ting the activation of MAPKs[J]. Food Funct,2019,10(9):5768-5778.
[40] 張海霞.溫清潰結飲對于DSS誘導的大鼠UC的治療作用及對TLR4/MyD88/NF-KB通路的影響[D].北京:北京中醫藥大學,2019.
[41] 于仁芳,孔曉.外周血及結腸黏膜TNF-α、IL-6和IL-2在潰瘍性結腸炎患者中的表達[J].中國急救醫學,2018,38(S02):183.
(收稿日期:2020-11-25 修回日期:2021-01-28)
(編輯:林 靜)

