香葉木素對大鼠腦缺血再灌注損傷的保護作用研究
肖聚慧,劉小軍
(鄭州大學第二附屬醫院,河南 鄭州 450014)
中風是一組以腦部缺血及出血性損傷癥狀為主要臨床表現的疾病,具有極高的病死率和致殘率,中風的病死率有隨年齡增長而上升的趨勢。中風分為兩種類型:一種是由血管阻塞所造成的缺血性腦中風,一種是由出血所造成的出血性腦中風[1]。不論是缺血性或是出血性腦中風都會造成腦功能異常。除了直接的缺血、缺氧,再灌注損傷在疾病進展中也起著關鍵作用,其中涉及到過度的炎癥反應,自由基損傷,Ca2+超載,自噬和細胞凋亡等多種病理和生理學過程。由于一直缺乏有效的治療措施,目前認為預防是最好的措施,臨床上迫切需要提出一種有效的腦缺血再灌注損傷醫學策略并揭示其潛在機制。
研究證實,很多天然植物提取物具有治療腦缺血性疾病的巨大潛力[2]。香葉木素(Dio)主要提取自檸檬,活性成分為黃酮類化合物,具有抗氧化、抗感染、抗休克等多種作用[3-4],且多篇文獻報道香葉木素具有抑制腫瘤的作用[5-7]。迄今為止,對香葉木素與腦缺血再灌注損傷的研究還很少,揭示香葉木素對腦I/R損傷、細胞自噬和細胞凋亡之間潛在的藥理學聯系,實現其藥用價值。
在本研究中,筆者旨在探索香葉木素是否可以增加腦缺血再灌注對大鼠腦血流量,減少缺血梗死體積,并評估香葉木素對動物保護神經組織和神經行為功能的作用。
1 材料和方法
1.1 實驗動物
48只10周齡(體質量250~280 g)雄性Wistar大鼠購自北京維通利華實驗動物技術有限公司[SCXK(京)2016-0006],動物飼養于恒溫、恒濕的 SPF 級動物房,維持12 h/12 h的光/暗循環條件。本項目的研究過程得到動物倫理委員會的批準,承諾盡量減少動物的使用數量并減輕動物的痛苦,動物處置方法均符合動物倫理學規范。
1.2 分組及處理
將大鼠隨機分為假手術對照組(Sham組,n=16)、腦缺血/再灌注組(I/R組,n=16)、香葉木素治療組(I/R + Dio組,n=16)。使用滅菌生理鹽水稀釋Dio,造模14 d前開始給藥(20 mg/kg),連續灌胃14 d,Sham組和I/R組使用滅菌的生理鹽水灌胃。14 d治療后,對大鼠進行短暫局灶性腦缺血模型造模。
1.3 短暫局灶性腦缺血模型
參照文獻[8],通過大腦中動脈閉塞(MCAO)建立短暫局灶性腦缺血的嚙齒動物模型。通過腹膜內注射10%水合氯醛(400 mg/kg)麻醉大鼠。在整個手術過程中,使用加熱墊將大鼠體溫維持在(37±0.5)℃。沿腹部中線切開頸部皮膚2 cm,分離左側的頸總動脈、頸外動脈和頸內動脈并結扎。將規格為3-0的單絲尼龍線插入大腦中動脈,從頸內動脈與頸外動脈分叉處開始約15 mm。持續缺血1.5 h后抽出單絲尼龍線,再灌注24 h。假手術的對照組大鼠不進行MCAO,其余操作一致。激光多普勒系統(PeriFlux System 5010,Perimed,斯德哥爾摩,瑞典)用于監測局部腦血流量(rCBF)。
1.4 神經功能評分
使用改良的五分量表評分系統評估大鼠的神經功能,得分越高表明神經功能損害越嚴重。再灌注后24 h后評分包括0分:神經系統功能未見喪失,活動正常;1分:不能伸展左前爪;2分:爬行時向左轉;3分:走路時向左側傾倒;4分:無法自發地行走與意識障礙。
1.5 TTC染色
再灌注24 h后在麻醉下處死大鼠進行TTC染色。將鼠腦放入-20 ℃冰箱中速凍10 min,使用振動切片機將大鼠大腦切成 2 mm 的厚片,浸入2% TTC染液(Solarbio,G3005,北京,中國)中,用錫箔紙包裹避光,放在搖床上37 ℃ 孵育15~30 min,使腦片均勻接觸到染色液。紅色表示正常的腦組織,而灰色區域表示梗塞的組織。使用Image-Pro Plus 6.0軟件(Media Cybernetics)計算梗塞體積。
1.6 HE染色
如前所示,再灌注24 h后收集大鼠鼠腦,常規石蠟包被后制備10 μm石蠟切片,然后浸入二甲苯中脫蠟。隨后,依次置于無水乙醇、95%酒精、90%酒精、80%酒精、70%酒精中5 min,最后用蒸餾水沖洗使切片水合。切片放入Harris蘇木素染6 min,用1%的鹽酸酒精分化數秒,使用0.6%氨水返藍,流水沖洗后放入伊紅染液中染色2 min。常規脫水透明后使用中性樹膠封片。用Olympus BX50光學顯微鏡觀察載玻片并拍照。
1.7 免疫熒光染色
大鼠用生理鹽水灌注2 min后用4%多聚甲醛灌注固定,取出鼠腦后放在4%多聚甲醛中浸泡過夜。制備40 μm厚的冰凍切片,室溫下使用山羊血清封閉2 h,然后孵育抗TUNEL(1∶100,Abcam),抗LC3(1∶400,Cell Signaling Technology),抗NeuN(1∶300,Abcam)4 ℃過夜。室溫孵育山羊來源的二抗(1∶1 000,Cell Signaling Technology)2 h,滴加防熒光淬滅劑后封片。顯微鏡下拍片后進行后續分析。
1.8 蛋白質免疫印跡
再灌注24 h后在麻醉狀態下處死動物。在冰上分離鼠腦并制備勻漿后,用RIPA緩沖液裂解組織。離心后收集上清液,使用BCA法測蛋白濃度。等量蛋白上樣電泳,然后將其轉移到聚偏二氟乙烯(PVDF)膜(Millipore,MA,美國)中。10%脫脂奶室溫封閉2 h,然后用抗大鼠LC3 I(1∶3 000,Cell Signaling Technology),抗大鼠LC3 Ⅱ,抗大鼠Beclin(1∶3 000,Cell Signaling Technology),抗大鼠Bcl-2(1∶2 000,Abcam),抗大鼠Atg7(1∶2 000,Cell Signaling Technology),抗大鼠β-actin(1∶5 000,Cell Signaling Technology),4 ℃孵育過夜。PBST洗滌后,將膜與辣根過氧化物酶(HRP)偶聯的山羊抗兔IgG(北京天根生物技術有限公司)在室溫下孵育1 h。在化學發光試劑(Millipore,MA)中測量蛋白質的表達量,結果表示為目的蛋白/β-actin的值。
1.9 統計學處理
2 結果
2.1 香葉木素對腦缺血再灌注大鼠腦血流量和神經系統功能的影響
為了直觀觀察短暫局灶性缺血再灌注的腦血流量變化,因此通過激光多普勒系統對腦血流進行成像觀察。如圖1A顯示,Sham組大鼠的腦血量正常,全腦均有血液灌流,而I/R組中可以明顯觀察到紅色區域減少,表征鼠腦的腦血流量減少(P<0.001),提示I/R組大鼠腦梗死區域增多。值得注意的是,Dio治療組大鼠的腦血流量相較于Sham組有所下降,但是比起I/R組有明顯的增加(P<0.01)。大鼠的神經功能方面,如圖1B所示,Sham組大鼠神經功能正常,平均分低于1分;而I/R組的平均分為3分,表明I/R組大鼠神經功能損傷嚴重;I/R+Dio組大鼠平均得分為1分,表明大鼠出現了較輕微的神經功能損傷。
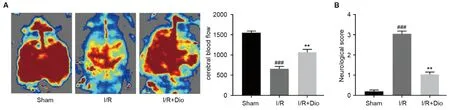
注:與Sham組相比,###P<0.001;與I/R組相比,**P<0.01。圖1 香葉木素對腦缺血再灌注大鼠腦血流量(A)和神經系統功能(B)的影響
2.2 香葉木素對腦缺血再灌注大鼠腦梗死體積及組織損傷的影響
缺血再灌注24 h后取出鼠腦分析鼠腦的組織損傷和梗死情況。如圖2A所示,Sham組大鼠的鼠腦呈現鮮紅色,且顏色分布均勻;I/R組大鼠的左側鼠腦出現灰色的梗死區域,且大腦中部梗死區域更多(P<0.001);I/R+Dio組大鼠的左側鼠腦有一定的梗死,但是相較于I/R組大大降低。HE染色觀察大鼠皮層區域的損傷情況,發現Sham組大鼠皮層結構正常,細胞排列整齊,細胞形態正常;I/R組大鼠皮層結構出現大量破壞,細胞排列疏松,部分神經細胞可見腫脹、破裂和壞死,細胞核出現解體;I/R+Dio組大鼠皮層結構未發生較大改變,細胞形態較為正常,未見明顯壞死區域。
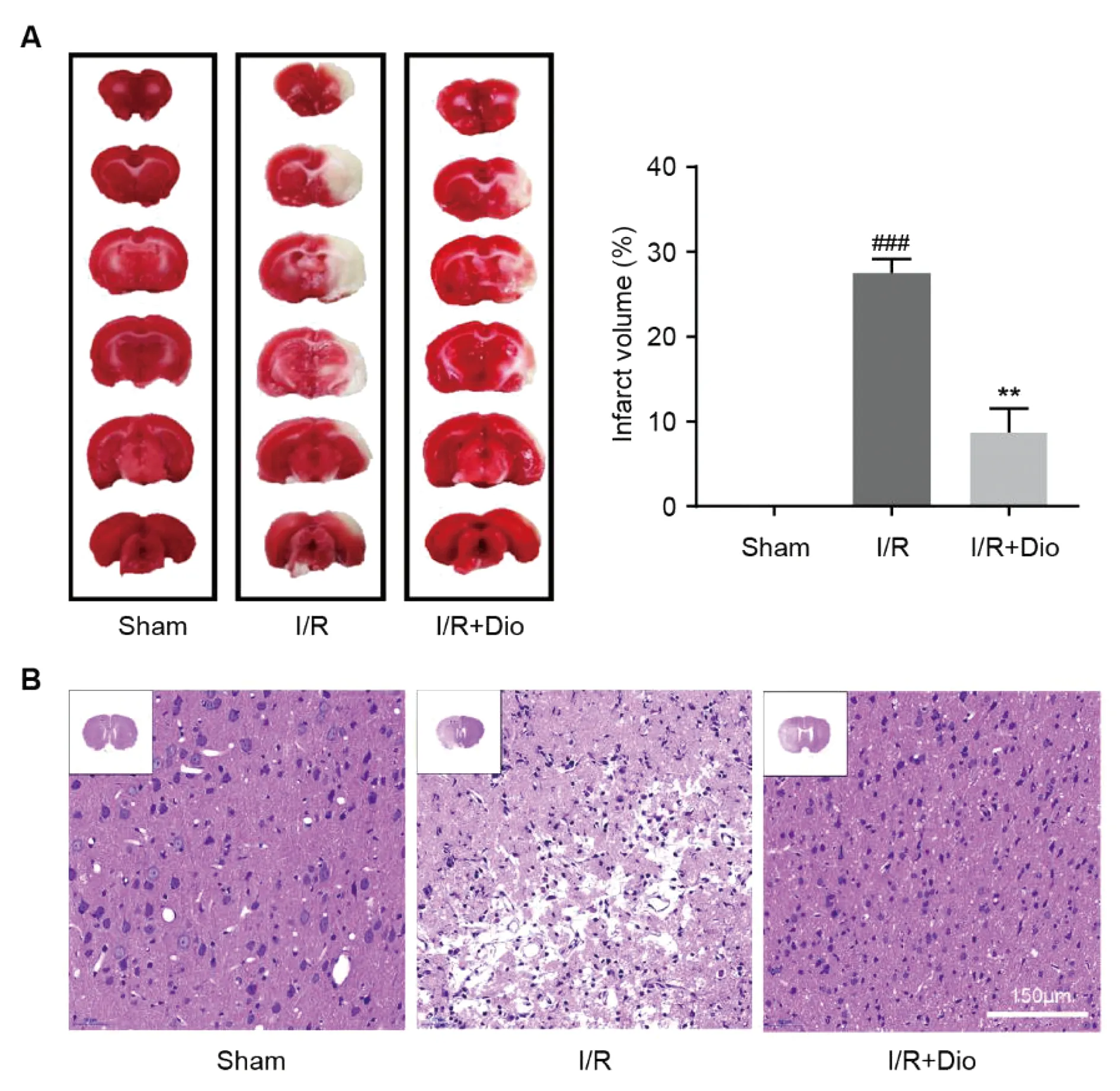
注:與Sham組相比,###P<0.001;與I/R組相比,**P<0.01。圖2 香葉木素對大鼠鼠腦梗死區域(A)和皮層組織(B)的保護作用
2.3 香葉木素對腦缺血再灌注大鼠腦中細胞凋亡的影響
TUNEL染色發現,正常的細胞幾乎沒有DNA的斷裂,因此沒有3′-OH形成,很少能夠被標記。Sham組中僅有少量的TUNEL陽性細胞,而I/R組中出現大量TUNEL陽性的神經元(P<0.001),表明I/R組大鼠皮層區域有大量神經元出現凋亡。相較于I/R組,I/R+Dio組中TUNEL陽性細胞數量降低(P<0.01),表明Dio治療對大鼠鼠腦神經元具有保護作用。
2.4 香葉木對腦缺血再灌注大鼠腦中細胞自噬的影響
圖4A顯示,Sham組中幾乎無LC3信號,而I/R組中LC3陽性細胞顯著增加,I/R+Dio組中LC3信號明顯少于I/R組。另外,相較于Sham組,I/R組的NeuN陽性細胞有少量降低;相較于I/R組,I/R+Dio組NeuN陽性細胞有所增加。LC3是細胞自噬的標志物,而NeuN可以標記成熟的神經元。I/R可以導致大鼠神經元自噬增多,從而導致神經元的數量減少。并且使用Western Blot對自噬相關的蛋白進行了定量檢測,結果顯示與Sham組相比I/R組中LC3 Ⅱ/LC3 Ⅰ比例增加(P<0.001),Beclin和Atg7表達均顯著增加(P<0.001);抗凋亡蛋白Bcl-2表達低于I/R +Dio組(P<0.001)。
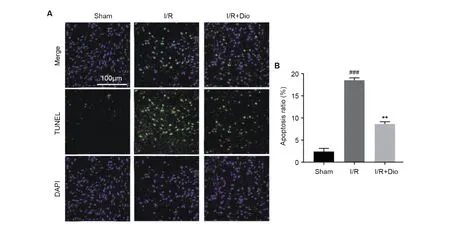
注:A.免疫熒光染色代表圖;B.凋亡率統計圖。與Sham組相比,###P<0.001;與I/R組相比,**P<0.01。圖3 香葉木素治療對皮層神經元細胞凋亡的影響
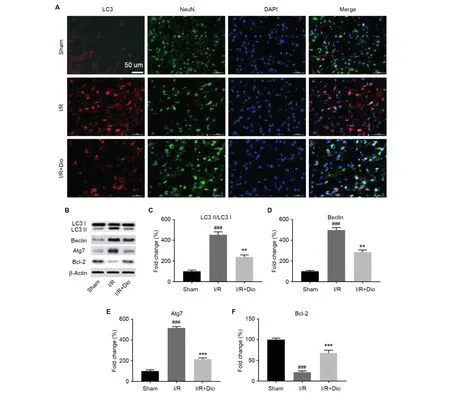
注:A.免疫熒光染色代表圖;B.Western Blot代表圖;C.LC3 Ⅱ/LC3 Ⅰ統計圖;D.Beclin統計圖;E.Agt7統計圖;F.Bcl-2統計圖。與Sham組相比,###P<0.001;與I/R組相比,**P<0.01。圖4 香葉木素對神經元自噬的影響
3 討論
在本研究中,筆者證實了香葉木素對大鼠大腦中動脈閉塞后誘導的腦缺血再灌注損傷的積極影響,發現用香葉木素處理的動物在腦缺血再灌注后腦血流量增加,動物的神經行為功能評分減少。香葉木素治療組腦梗死體積減少,神經元的凋亡和自噬均減少。研究結果表明,香葉木素可以減輕腦缺血再灌注的損傷。
香葉木素廣泛存在與自然界的草本藥物中,是很多藥用植物的有效成分,常用于治療惡性腫瘤[3]。例如香葉木素可以抑制人類肝細胞CYP1A 酶活性,具有抗誘變和抗變應的特性,可用于肝癌的治療[9]。另外,香葉木素可減弱 CCl4誘導的肝損傷大鼠NLRP3 炎性小體信號通路活化增加細胞增殖,減少細胞凋亡從而降低大鼠的肝纖維化程度[10]。香葉木素會降低IL-1β誘導的新生大鼠骨關節炎軟骨細胞NF-κB P65從細胞質向細胞核的轉運,通過抑制NF-κB通路活化緩解軟骨細胞凋亡和免疫反應[11]。香葉木素這種抑制細胞凋亡,減輕炎癥反映的功能是否可以緩解因缺血再灌注導致的腦損傷呢?筆者采用激光多普勒系統觀察大鼠腦部的血流變化,發現I/R造模組大鼠血流明顯減少,而Dio治療可以增加大鼠的腦血流量;另外,對腦組織的切片TTC染色也顯示出I/R會導致大鼠鼠腦梗死區域增加,皮層組織細胞結構被破壞,神經細胞出現壞死,Dio的治療可以減少梗死,維持大腦的正常細胞形態和組織結構。且經過腦I/R后,大鼠出現了明顯的行為障礙,神經功能評分增加;提前的Dio干預可以有效預防I/R造成的行為缺陷。
腦缺血再灌注引起的損傷主要表現為進行性的腦細胞損傷。在I/R過程中,神經元可能發生壞死和凋亡[12]。自噬是一種高度保守的細胞行為,主要參與細胞內大分子循環以及受損細胞器和功能障礙蛋白的清除,這在維持細胞內環境的穩定性中起著重要作用。細胞通過自噬相關基因的表達和調控自主發揮作用,降解細胞內成分,而缺血和缺氧是自噬激活的重要誘因[13]。自噬相關蛋白 (autophagy-related protein,Atg) 是一類自噬相關的蛋白, 在生物體內參與調節自噬的過程。其中幾個關鍵蛋白, 也成為自噬標志物,如微管相關蛋白1輕鏈3 (LC3)以及與其結合輔助LC3成熟的Atg 7,液泡分選蛋白30基因的同源物Beclin等[14]。細胞內的LC3經過加工,在胞漿中形成可溶性的LC3Ⅰ,之后LC3Ⅰ需要Atg7和Atg3參與的泛素化修飾加工[15]。泛素化LC3Ⅰ與通過自噬體膜表面的磷脂酰乙醇胺耦聯,成為膜結合形式的LC3Ⅱ。LC3Ⅱ定位于前自噬體和自噬體, 是自噬體的標志分子,隨自噬體膜的增多而增加。LC3Ⅱ的含量或LC3Ⅱ/LC3Ⅰ的比例與自噬體的數量呈正相關,LC3Ⅱ與LC3Ⅰ的比值增加,反映了細胞的自噬活性增加[16]。Beclin在細胞內主要位于反面高爾基體、內質網和線粒體中。Beclin包含三個結構域:BH-3域,中央卷曲螺旋結構域和進化保守結構域,這些結構域參與自噬調節的蛋白質網絡相互作用[17]。在正常情況下,抗凋亡蛋白Bcl-2通過與BH-3結構域的相互作用來抑制自噬[18]。免疫熒光和蛋白質免疫印跡結果顯示,I/R組大鼠的TUNEL陽性細胞顯著增多,自噬相關蛋白LC3 Ⅱ/LC3 Ⅰ的值顯著增加,Beclin和Atg 7的表達也顯著增加,而抗凋亡的Bcl-2表達則明顯低于I/R+Dio組,表明腦I/R可以激活神經元的自噬信號,促進細胞自噬和細胞凋亡,而Dio的治療可以抗細胞凋亡,減少神經元的自噬現象從而維持神經功能的正常。
綜上所述,本研究首次發現了香葉木素對腦缺血再灌注誘導的神經元自噬的保護作用。香葉木素的干預可以減少神經元自噬來預防腦缺血再灌注損傷。但是,筆者研究有一些局限性,在未來的研究中將繼續探索腦缺血再灌注損傷出現之后,香葉木素是否也能發揮治療作用,以及其發揮作用是否通過其他信號通路和分子機制。

