自噬在結(jié)直腸癌中的作用研究進(jìn)展
柴琳琳, 袁瑋, 胥傳海
(鹽城市第一人民醫(yī)院病理科,江蘇 鹽城 224001)
結(jié)直腸癌是一種常見惡性腫瘤,居女性惡性腫瘤的第2位,男性惡性腫瘤的第3位,約占全世界每年新診斷癌癥的10%[1]。研究表明,結(jié)直腸癌好發(fā)于發(fā)達(dá)國家,然而隨著發(fā)展中國家的持續(xù)進(jìn)步及飲食結(jié)構(gòu)的改變,預(yù)計(jì)到2030年全球結(jié)直腸癌新增病例達(dá)220萬,死亡人數(shù)達(dá)110萬[2-4]。結(jié)直腸癌發(fā)生源自多種內(nèi)在和外在因素,其中包括TP53、KRAS等基因突變,家族史的易感等位基因的積累,常年的慢性炎癥等[5-6]。結(jié)直腸癌的傳統(tǒng)治療方式是手術(shù)、化療、放療以及靶向治療。雖然早期檢測手段和手術(shù)水平的進(jìn)步使得局部和區(qū)域化結(jié)直腸癌患者的5年生存率提高至90%和71%,但是發(fā)生轉(zhuǎn)移的結(jié)直腸癌患者的5年存活率僅為14%左右[7]。更令人擔(dān)憂的是25%的結(jié)直腸癌在診斷時(shí)已經(jīng)顯示腫瘤轉(zhuǎn)移,并且50%接受治療的患者最終也發(fā)生轉(zhuǎn)移[8]。這些統(tǒng)計(jì)結(jié)果表明傳統(tǒng)的標(biāo)準(zhǔn)治療方案需要補(bǔ)充新的治療方式,開發(fā)新的治療靶點(diǎn)。目前,結(jié)直腸癌靶點(diǎn)研究主要集中于血管內(nèi)皮生長因子(VEGF)信號通路、Notch信號通路、Wnt信號通路以及自噬信號通路等[9]。
自噬又稱“自食”,最早在1962年由Ashford和Porter發(fā)現(xiàn),它是在進(jìn)化中高度保守且普遍存在的一種生理的細(xì)胞過程[10]。自噬目的是降解和消除錯(cuò)誤折疊的蛋白質(zhì)和受損的細(xì)胞器,而當(dāng)細(xì)胞處于應(yīng)激環(huán)境時(shí),例如營養(yǎng)饑餓、氧化應(yīng)激、缺氧或感染,自噬將保護(hù)細(xì)胞。在營養(yǎng)饑餓期間,自噬分解DNA/RNA、碳水化合物、蛋白質(zhì)和三酰甘油,并產(chǎn)生基礎(chǔ)營養(yǎng)物質(zhì)為細(xì)胞供能。自噬可以捕獲入侵的病原體并將它們遞送到溶酶體降解,也可通過選擇性隔離和清除受損的線粒體來減少活性氧損傷[11-12]。近年來研究表明,自噬與癌癥啟動(dòng)和治療都有聯(lián)系[13-14]。事實(shí)上,一些研究表明自噬是多種癌基因和抑癌基因的調(diào)節(jié)器[15-16],而其他研究表明自噬既涉及促進(jìn)腫瘤的發(fā)生,也涉及癌癥的發(fā)展和抑制[17-19]。本文綜述自噬在結(jié)直腸癌中的功能研究進(jìn)展。
1 自噬簡介
根據(jù)轉(zhuǎn)運(yùn)到溶酶體的細(xì)胞內(nèi)成分不同,自噬途徑可分為以下3類:巨自噬(macroautophagy)、微自噬(microautophagy)與分子伴侶介導(dǎo)的自噬(chaperone-mediated autophagy)。本文自噬指的是巨自噬。
自噬的發(fā)生是一個(gè)精準(zhǔn)調(diào)控的多層次動(dòng)態(tài)連續(xù)發(fā)展的過程。迄今為止發(fā)現(xiàn),自噬全過程受到超過36個(gè)自噬相關(guān)基因(autophagy related genes,ATGs)及相應(yīng)蛋白嚴(yán)格調(diào)控[20],根據(jù)其發(fā)展過程主要分5個(gè)階段:起始階段(誘導(dǎo)階段)、自噬小體成核、自噬小體形成(延伸)、溶酶體融合(完成)、最終降解。哺乳動(dòng)物的雷帕霉素靶點(diǎn)(mTOR)與細(xì)胞增殖、應(yīng)激和癌癥進(jìn)展有關(guān),是自噬的關(guān)鍵因子。自噬激活激酶(ULK)復(fù)合體由ULK1/ULK2、ATG13/101、黏著斑激酶家族相互作用蛋白(FAK-family interacting protein of 200 kDa,F(xiàn)IP200)組成,該復(fù)合體的形成及活化啟動(dòng)自噬的發(fā)生。mTOR復(fù)合物抑制ULK復(fù)合物的形成,實(shí)際上會(huì)阻止自噬。各種刺激(如缺氧、饑餓)會(huì)抑制mTOR,從而激活ULK復(fù)合物。ULK復(fù)合物是自噬中具有絲氨酸/蘇氨酸激酶活性的核心蛋白。當(dāng)mTOR被抑制時(shí),ULK復(fù)合物被去磷酸化,因此被激活。激活的ULK復(fù)合物定位在吞噬細(xì)胞上,并激活Ⅲ級胞內(nèi)磷脂酰肌醇激酶(PI3K)復(fù)合體。Ⅲ級PI3K復(fù)合體包含了HVPS34、BECLIN-1、P150和ATG14等。ATG12與泛素E1連接酶ATG7、泛素E2連接酶ATG10和ATG5偶聯(lián),然后以ATG12-ATG5的連接物與ATG16L1共價(jià)結(jié)合為新的復(fù)合物進(jìn)而擴(kuò)張自噬體膜。而ATG8家族蛋白中的微管相關(guān)蛋白輕鏈 3(microtubule associated protein-light chain 3,LC3)將與磷脂酰乙醇胺(PE)結(jié)合轉(zhuǎn)變?yōu)長C3-Ⅱ,LC3-Ⅱ位于自噬體的內(nèi)膜和外膜中,使其能夠結(jié)合降解的底物。自噬相關(guān)基因信號通路見圖1。成熟的自噬體可以與溶酶體融合形成自噬溶酶體,通過自噬選擇性地去除蛋白質(zhì)和受損的細(xì)胞器,參與自噬體的形成[21]。
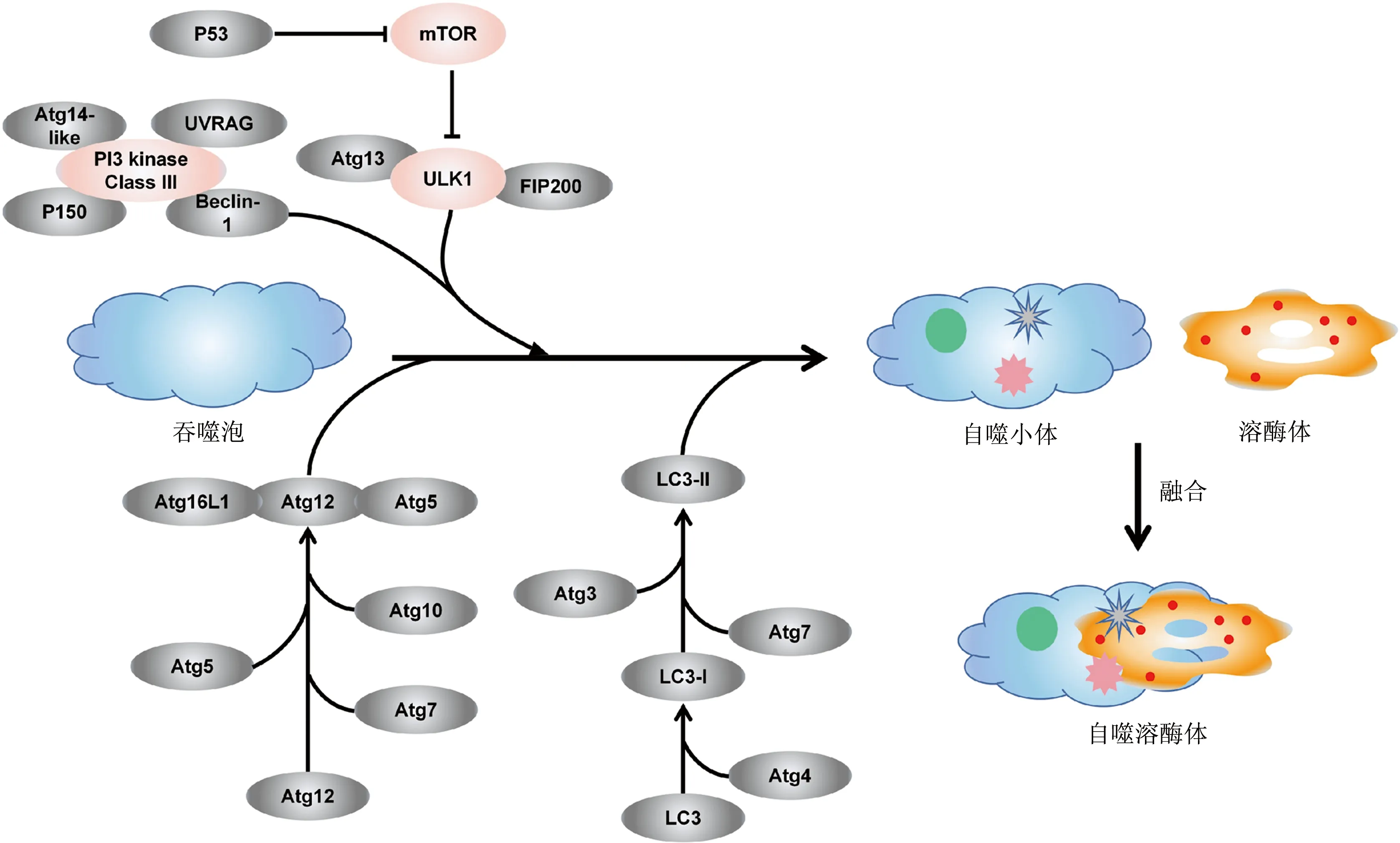
圖1 自噬相關(guān)基因信號通路示意圖
2 自噬對結(jié)直腸癌的調(diào)控
腫瘤發(fā)生源于細(xì)胞增殖和細(xì)胞死亡之間的不平衡。當(dāng)自噬被阻斷時(shí),細(xì)胞增殖和細(xì)胞死亡之間的平衡被破壞,這種破壞可能代表著腫瘤發(fā)生過程的早期步驟[22-23]。為了應(yīng)對壓力,細(xì)胞可以采用多種最終決定細(xì)胞死亡或存活的機(jī)制。在這些機(jī)制中,自噬最初被認(rèn)為是一種抑制惡性轉(zhuǎn)化的機(jī)制。癌細(xì)胞的增殖需要源源不斷的資源來維持細(xì)胞內(nèi)的能量和營養(yǎng)水平。在營養(yǎng)或能量有限的情況下,自噬通過降解細(xì)胞內(nèi)的成分來維持癌細(xì)胞的存活。近年來,對自噬與腫瘤的關(guān)系研究日益增多,因此產(chǎn)生了眾多假說。目前較為公認(rèn)的是自噬在癌癥發(fā)生過程中有著相互矛盾的雙重作用,這一矛盾可能與腫瘤發(fā)生的時(shí)期相關(guān),但引起癌癥自噬的確切機(jī)制尚未完全確定。首先,自噬是正常細(xì)胞中的監(jiān)視系統(tǒng),它能夠清除細(xì)胞器以及積聚的蛋白質(zhì),減少DNA損傷,清除異常線粒體減少活性氧損傷等,并將產(chǎn)生的基礎(chǔ)物質(zhì)重新循環(huán)利用,從而可以應(yīng)激保護(hù)細(xì)胞免遭惡性轉(zhuǎn)化。然而,自噬也能夠?yàn)槟[瘤的生長代謝提供關(guān)鍵營養(yǎng)物質(zhì),并通過抑制細(xì)胞的凋亡與耐藥性從而支持腫瘤形成[24-25]。
2.1 自噬對結(jié)直腸癌發(fā)生的抑制作用
引發(fā)結(jié)直腸癌的因素很多,其中炎癥或其他因素引起的腸上皮細(xì)胞反復(fù)損傷和再生可導(dǎo)致其惡變,最終形成腫瘤。在一項(xiàng)研究中發(fā)現(xiàn),Atg7缺失的小鼠中炎性因子的表達(dá)使其更容易患實(shí)驗(yàn)性結(jié)腸炎,并伴有結(jié)腸細(xì)胞因子表達(dá)增加和全身細(xì)菌侵襲[26]。而ATG5和ATG16L1介導(dǎo)的上皮細(xì)胞自噬有助于清除上皮細(xì)胞中的細(xì)菌,增強(qiáng)抗菌防御,從而降低炎癥反應(yīng),進(jìn)而抑制腫瘤的發(fā)生。當(dāng)巨噬細(xì)胞中缺乏ATG16L1會(huì)損害有絲分裂吞噬功能,從而活性氧的產(chǎn)生增加,導(dǎo)致小鼠結(jié)腸炎的發(fā)生[27]。從免疫學(xué)的角度來看,當(dāng)惡性細(xì)胞通過改變其抗原性能或通過抑制抗腫瘤免疫應(yīng)答從而逃避免疫系統(tǒng)的控制時(shí),癌癥會(huì)快速發(fā)展。TP53突變體的積累,或抗凋亡BCL-2蛋白的過度表達(dá)抑制自噬,直接或者間接導(dǎo)致癌細(xì)胞中基因組的不穩(wěn)定,最終形成惡性細(xì)胞免疫逃逸[28]。除了通過炎癥應(yīng)激以及免疫應(yīng)答,自噬相關(guān)基因也直接參與腫瘤的發(fā)生。TP53作為一個(gè)重要的抑癌基因能夠通過調(diào)節(jié)細(xì)胞凋亡、細(xì)胞周期等發(fā)揮抑癌作用。同時(shí)P53蛋白也可以通過抑制mTOR的活性,增強(qiáng)自噬,抑制結(jié)直腸癌的發(fā)展。通常來說TP53基因突變后喪失抑癌作用,可促進(jìn)細(xì)胞向惡性轉(zhuǎn)化。然而一項(xiàng)研究中發(fā)現(xiàn),當(dāng)TP53基因突變后也能激活自噬,從而促進(jìn)結(jié)直腸癌細(xì)胞的凋亡[29],這一研究暗示了自噬的激活并不完全由單個(gè)基因表達(dá)的改變而發(fā)生變化。而當(dāng)缺乏自噬相關(guān)蛋白LC3B、ATG5和BECLIN1的表達(dá)時(shí),往往結(jié)直腸癌患者預(yù)后不良[30]。在具有高度微衛(wèi)星不穩(wěn)定性的結(jié)直腸癌中,27%的癌癥患者至少包含ATG2B、ATG5、ATG9B和ATG12基因中一個(gè)突變,且其蛋白表達(dá)降低與結(jié)直腸癌和胃癌相關(guān)[31-33]。紫外線抵抗相關(guān)基因(UV radition resistance associated gene,UVRAG)是紫外線耐受相關(guān)基因,編碼一種腫瘤抑制蛋白,通過與BECLIN1相互作用誘導(dǎo)自噬,在結(jié)直腸癌中,具有微衛(wèi)星不穩(wěn)定性的UVRAG移碼突變會(huì)導(dǎo)致腫瘤發(fā)生、上皮間充質(zhì)轉(zhuǎn)化和轉(zhuǎn)移[34-35]。
2.2 自噬對結(jié)直腸癌發(fā)生的促進(jìn)作用
在營養(yǎng)物質(zhì)或能量匱乏的條件下,自噬通過降解細(xì)胞內(nèi)的成分來維持癌細(xì)胞的存活從而促進(jìn)腫瘤的發(fā)生。例如,在腫瘤細(xì)胞快速增殖期,細(xì)胞對氨基酸、氧氣和生長因子減少有明顯的反應(yīng)。在代謝應(yīng)激條件下,癌基因Ras被激活并誘導(dǎo)自噬[36],Ras誘導(dǎo)的自噬通過提供能量和營養(yǎng)來源及延長細(xì)胞存活幫助癌細(xì)胞適應(yīng)應(yīng)激的微環(huán)境[37]。在人類結(jié)直腸癌樣本的分析表明,實(shí)體腫瘤中的腫瘤干細(xì)胞或腫瘤啟動(dòng)細(xì)胞(TICs)通常處于缺氧狀態(tài),缺氧增加了TICs的自我更新能力。一項(xiàng)研究發(fā)現(xiàn),穩(wěn)定敲除ATG5抑制自噬的發(fā)生,體內(nèi)腫瘤啟動(dòng)和生長顯著減少[38]。結(jié)直腸癌患者有很高的KRAS基因突變率,而KRAS的突變通過ERK信號通路促進(jìn)自噬,從而為結(jié)直腸癌細(xì)胞提供營養(yǎng)保障[39]。除了營養(yǎng)支持,部分自噬相關(guān)蛋白的高表達(dá)也暗示了預(yù)后不良。研究發(fā)現(xiàn),結(jié)直腸癌中LC3或BECLIN1高表達(dá),而高水平的LC3或BECLIN1陽性細(xì)胞與轉(zhuǎn)移和預(yù)后不良有關(guān)[40-41]。結(jié)直腸癌組織中,ATG10蛋白高表達(dá)與腫瘤淋巴結(jié)轉(zhuǎn)移和侵襲有關(guān),此外,ATG10的高表達(dá)也與生存不良相關(guān),表明ATG10可能是結(jié)直腸癌潛在的預(yù)后標(biāo)志物[42]。在一篇Meta分析報(bào)告中,BECLIN1的過度表達(dá)與結(jié)直腸癌患者的不良預(yù)后和轉(zhuǎn)移有關(guān)[43]。腫瘤的耐藥性是化療成功與否的關(guān)鍵因素,眾多研究表明自噬能夠通過增加機(jī)體對化療藥物的耐藥性間接促進(jìn)癌癥的發(fā)展。在體外降低ATG7的表達(dá)能夠引起結(jié)直腸癌細(xì)胞的特異性凋亡,并增強(qiáng)化療藥物殺死結(jié)直腸癌細(xì)胞的效果[44]。阿帕替尼是一種新型的酪氨酸激酶抑制劑,研究表明阿帕替尼能夠通過內(nèi)質(zhì)網(wǎng)應(yīng)激誘導(dǎo)結(jié)直腸癌細(xì)胞的凋亡,抑制自噬能夠降低結(jié)腸癌細(xì)胞耐藥性并提升阿帕替尼的抗腫瘤效果[45]。以上結(jié)果表明自噬對腫瘤的發(fā)生起到促進(jìn)作用。
3 總結(jié)
一般來說,非選擇性自噬用于營養(yǎng)脅迫,而選擇性自噬用于細(xì)胞維持。然而,在結(jié)直腸癌腫瘤生長的背景下,這些角色可能會(huì)改變。自噬的復(fù)雜過程涉及多個(gè)基因和蛋白質(zhì)。關(guān)于結(jié)直腸癌中最重要的研究主要集中在LC3、BECLIN1、ATG5及ATG7等分子上,這些研究產(chǎn)生了相互矛盾的結(jié)果,既有促進(jìn)作用,也有抑制作用,而這種“矛”與“盾”的確切機(jī)制尚未研究透徹。根據(jù)現(xiàn)有研究我們有必要確定自噬的雙重作用如何調(diào)節(jié)結(jié)直腸癌的發(fā)生發(fā)展,并確定是什么信號和分子機(jī)制使得自噬在一種情況下起促進(jìn)作用,而在另一種情況下起抑制作用。盡管目前針對自噬已開發(fā)部分臨床藥物,但仍然需要進(jìn)一步的研究來更好地了解結(jié)直腸癌和自噬之間的關(guān)系,并開發(fā)出對治療和預(yù)后有潛在益處的藥物。