龍眼核多酚對LPS 誘導的ALI 小鼠肺組織的保護作用及機制
范風穎,駱 姍,趙 莉
急性肺損傷(ALI)是臨床常見的肺部疾病,以持續或急性肺部炎癥為病理基礎,因嗜中性粒細胞聚集,損傷肺泡-毛細血管屏障,導致出現肺間質水腫、非心源性肺水腫等病理特征[1]。該病發生機制主要是因體內炎性水平升高、氧化應激反應增強導致,氧化應激會增加體內活性氧簇分泌量,引起氣道與血管重塑,并侵犯至肺間質,導致肺水腫發生[2]。在實驗動物模型建立時,常采用脂多糖(LPS)誘導,LPS是革蘭陰性菌主要細胞壁成分,是人體感染革蘭陰性菌的重要病原菌,其誘導作用是誘導機體炎癥反應過度激活,促進大量活性氧大量釋放,引起氧化與抗氧化系統失衡,故會導致肺損傷[3]。目前肺損傷缺乏特異性治療藥物,研究相關治療藥物是重癥科研究重點。龍眼也稱為桂圓,肉質清脆、味美香甜,果肉內含有豐富的碳水化合物、氨基酸、維生素C、蛋白質等營養物質,并含有豐富的多酚、多糖、多肽、皂苷類活性成分,有雙重的營養與藥用成分。中醫認為龍眼歸心、脾經,有補氣養血、安神定志、養心健脾功效。有研究[4]表明,除了龍眼肉,龍眼核有雙重的營養、保健功效,核內含有的脂肪、生物堿等成分,經多種分離純化技術并能從龍眼核內提取到多酚成分,起到抗氧化、抗炎、降血糖等作用。但龍眼核多酚是否能夠作為治療ALI 的相關藥物,以及其肺組織保護機制缺乏研究報道。現本研究就分析眼核多酚對ALI 小鼠的作用機制,報道如下。
1 材料與方法
1.1 實驗動物 雄性小鼠40 只(新疆醫科大學動物實驗中心提供),SPF 級,周齡6~8 w,體重18~22 g;飼養環境SPF 級,室溫20~25 ℃,濕度40%~60%,自由攝食、飲水。
1.2 藥物與試劑 龍眼核:高州產地;地塞米松片:廣東華南藥業,國藥準字H44024469,0.75 mg/片;脂多糖:Sigma 公司;酶聯免疫法試劑盒購自羅氏公司;MR-96A 酶標分析儀購自深圳邁瑞生物;1658001 蛋白印跡電泳儀購自美國BioRad 公司;TD5-Ⅱ型離心機購自長沙平凡;SW-CJ-1FD 型超凈工作臺購自蘇州安泰。
1.3 龍眼核多酚提取 將龍眼核研磨成粉,精密稱量后,過60 目篩,備用。粉末200 g,加入95%乙醇1 L,70 ℃環境下,對龍眼核粉末進行攪拌,提取3 次,每次作用3 h。合并提取液,離心15 min,3500 r/min,壓縮提取液至無醇味浸膏。添加蒸餾水后分散,石油醚脫脂,對其分別加入氯仿、乙酸乙酯等溶劑萃取,合并萃取液,再壓縮、回收,對不同濃縮物進行干燥,液-液萃取法分離出龍眼核多酚。
1.4 動物模型建立 動物模型建立:小鼠得到1 w適應性喂養,模型建立前連續灌胃3 d,對照組、模型組分別腹腔注射等量生理鹽水,地塞米松組:腹腔注射地塞米松20 mg/kg;龍眼核多酚組:腹腔注射龍眼核多酚20 mg/kg,連續3 d,末次給藥1 h 后于小鼠尾部靜脈注射LPS 0.5 ml,建立ALI 模型,其中對照組僅注射等量生理鹽水。
造模完成24 h 后,摘除小鼠眼球,留取血液標本,對血液標本離心15 min,3500 r/min,將血液標本置于-20 ℃環境內保存。將小鼠處死后,開胸取左肺組織,吸干血跡后,電子秤測量肺組織濕重,隨后將肺組織置入60 ℃烘箱內,連續48 h 后測量干重,計算干濕重比值:濕重/干重。取肺組織,甲醛固定24 h,切片,HE 染色,用顯微鏡觀察肺組織病理特征,對肺泡水腫、肺泡充血、肺間質水腫、肺泡壁增厚,分別計0~4 分:0 分:無改變;1 分:輕微變化;2分:中度變化;3 分:重度改變;4 分:極重度改變。小鼠處死后,分離器官,左肺用磷酸緩沖液沖洗,連續3 次,收集灌洗液,離心10 min,2000 r/min,收集上清液,磷酸緩沖液重懸,涂抹在載玻片,以Giemsa 染色,計算嗜中性粒細胞、白細胞的數量,酶聯免疫吸附法檢測腫瘤壞死因子(TNF)-α、白細胞介素(IL)-6及IL-1β。留取的分離血液標本用WST-1 法檢測血清氧化應激指標:包括超氧化物歧化酶(SOD),測定肺組織內丙二醛(MDA)。分離提取細胞總蛋白后,用增強化學發光法計算高遷移率族蛋白(HMG)B1、核因子(NF)-κB 表達。
1.5 統計學方法 應用SPSS20.0 統計軟件分析。計量數據用x±s 表示,采用t檢驗;計數資料采用χ2檢驗,P<0.05 為差異有統計學意義。
2 結果
2.1 肺組織病理特征 對照組小鼠肺組織結構完整,肺泡腔內無滲出物,肺間質正常,肺泡間隔無增厚;模型組肺泡結構被破壞,肺泡腔炎性浸潤,肺間質水腫,肺泡間隔增厚明顯,病理平均分為(12.51±3.48)分;地塞米松、龍眼核多酚組肺泡腔炎性減輕,肺間質水腫緩解,肺泡間隔增厚不明顯,平均病理分分別為(4.81±1.63)、(5.02±0.65)分,地塞米松、龍眼核多酚組高于模型組(t=5.667,5.984;P=0.001,0.001);而兩組比較無顯著差異(P>0.05)。
2.2 濕重/干重比值 對照組肺組織濕重/干重比值明顯低于其他3 組(P<0.05),而地塞米松、龍眼核多酚組較模型組下降(P<0.05),但地塞米松、龍眼核多酚組比較無顯著差異(P>0.05),見表1。
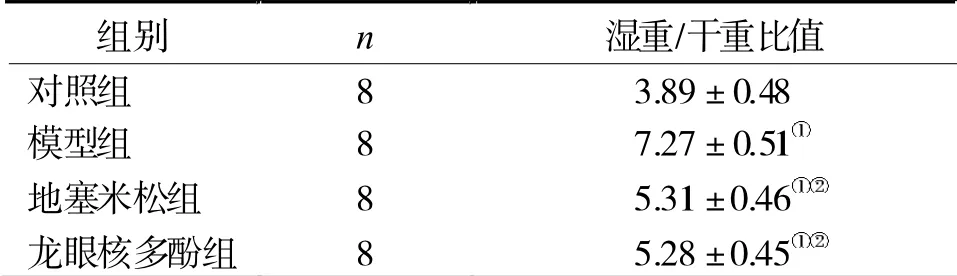
表1 4 組肺組織濕重/干重比值
注:與對照組比較,①P <0.05;與模型組比較,②P <0.05
2.3 炎性水平 對照組嗜中性粒細胞、白細胞計數、TNF-α、IL-6 及IL-1β 均低于其他3 組(P<0.05),而地塞米松、龍眼核多酚組較模型組下降(P<0.05),但地塞米松、龍眼核多酚組比較無顯著差異(P>0.05),見表2。
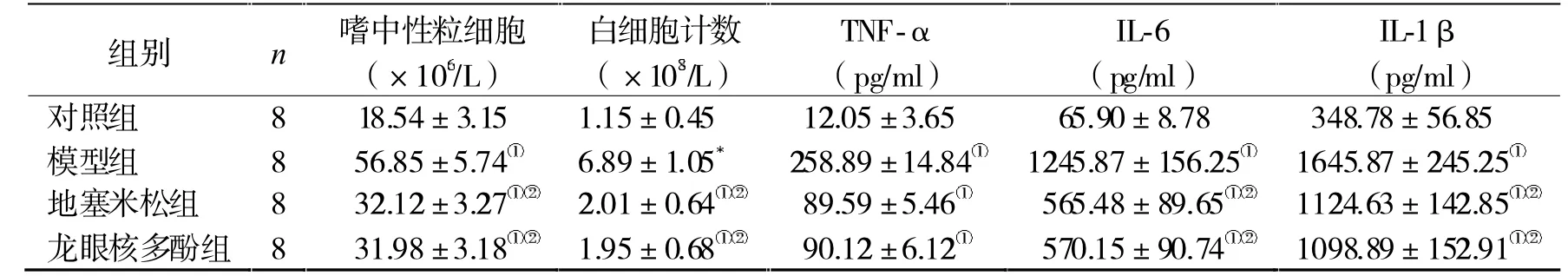
表2 4 組炎性水平比較
2.4 氧化應激反應 對照組SOD 表達高于其他3 組,MDA 表達低于其他3 組(P<0.05),而地塞米松、龍眼核多酚組SOD 表達高于模型組,MDA 表達低于模型組(P<0.05),但地塞米松、龍眼核多酚組比較無顯著差異(P>0.05),見表3。

表3 四組氧化應激反應比較
2.5 HMGB1、NF-κB 表 達 模 型 組HMGB1、NFκB 表達較對照組升高(P<0.05),而地塞米松、龍眼核多酚組表達有所下降,較模型組低(P<0.05),見表4。
表4 不同H MGB1、N-?B 表達比較

表4 不同H MGB1、N-?B 表達比較
注:與對照組比較,①P <0.05;與模型組比較,②P <0.05
3 討論
ALI 發病機制復雜、進展迅猛,其中革蘭陰性菌感染是其主要致病因素,誘發肺部炎性細胞浸潤及氧化應激反應,導致肺間質水腫、肺泡腔滲出[5-6]。脂多糖存在革蘭陰性菌細胞壁外膜,在注射脂多糖后會建立ALI 模型,為動物實驗展開奠定基礎[7-8]。本組研究,在用脂多糖誘導肺組織損傷小鼠模型,經初死解剖肺泡結構被破壞,肺泡腔炎性浸潤,肺間質水腫,肺泡間隔增厚明顯。故采用脂多糖誘導,能成功建立ALI 小鼠模型。本組研究,3 組小鼠的肺組織病理評分、肺組織濕重/干重比值均高于對照組,其中模型組增加明顯,地塞米松、龍眼核多酚有所下降(P<0.05)。結果證實采用地塞米松與龍眼核多酚能減輕小鼠肺組織病理損傷,緩解肺泡間質水腫,故肯定龍眼核多酚對肺組織有一定的保護作用。
ALI 是因炎癥細胞浸潤所致,外界環境改變,或促進嗜中性粒細胞活性,白細胞計數升高,產生過度炎癥反應,損傷肺組織上皮細胞[9-10]。本組研究,ALI 小鼠建立成功后,嗜中性粒細胞、白細胞計數、TNF-α、IL-6 及IL-1β 水平均明顯升高,且高于對照組,但在采用地塞米松、龍眼核多酚后其表達均明顯下降(P<0.05)。結果表明龍眼核多酚能夠下降小鼠炎癥反應。龍眼核含有的生物堿、多酚等成分,具備理化除濕、止血鎮痛作用,且在現代藥理[11]研究中,通過提取龍眼核相關物質,對多種病原菌起到不同程度的抑制作用,而多酚成分占龍眼核主要部分,故能肯定該物質的作用。氧自由基增強過度是致ALI 的重要原因,而且炎癥細胞通過浸潤肺組織,會促進氧化應激反應[12-13]。SOD 是內源性抗氧化系統的重要因子,MDA 是體內自由基脂質過氧化反應后形成的產物,兩者表達直接反映了肺組織損傷程度[14]。本組研究對照組SOD 表達高于其他3 組,MDA 表達低于其他3 組(P<0.05),而地塞米松、龍眼核多酚組SOD 表達高于模型組,MDA 表達低于模型組(P<0.05),但地塞米松、龍眼核多酚組比較(P>0.05)。結果證實在建立動物模型后,氧化應激反應明顯,而在用藥后可改善模型氧化損傷,以此能緩解肺組織炎性浸潤,降低炎癥水平。孫菡崢等[15]報道指出于龍眼核內提取多酚含量為53.68 mg/g,抗氧化性能高,對氧自由基的清除率(73.90±0.60)%。楊敦杰等[16]報道龍眼核內含有豐富的多酚類物質,50%乙醇萃取物之總多酚化合物含量最高,且清除超氧陰離子能力最高。本組研究,地塞米松、龍眼核多酚組HMGB1、NF-κB 表 達 均 低 于 模 型 組(P<0.05)。HMGB1 是反映肺損傷的重要因子,其表達可激活Toll 樣受體4/NF-κB 通路,導致肺損傷的發生[17-18]。研究提示龍眼核多酚通過下降HMGB1、NF-κB 表達,而起到保護肺組織的作用。
基于此,本研究認為龍眼核多酚通過抑制小鼠氧化應激反應,降低肺組織炎癥反應,起到肺組織保護作用,緩解肺損傷程度。雖然其作用與地塞米松的作用效果無明顯差異,但在長期臨床實踐中發現,地塞米松不良反應多,會誘發呼吸困難、過敏性休克、低鉀血癥等嚴重并發癥,此時為龍眼核多酚的臨床應用奠定基礎[19-20]。
綜上所述,龍眼核多酚通過減輕因LPS 誘導的ALI 小鼠的炎癥反應,抑制氧化應激反應,起到肺組織保護作用,緩解肺損傷程度。

