電針對腦缺血大鼠突觸可塑性及小膠質細胞極化的影響
徐 瓊劉建浩王天磊譚春鳳
(三亞市中醫院針灸科,海南三亞 572000)
隨著社會老齡化進程,腦血管疾病發病率呈逐年攀升態勢,其中缺血性腦血管疾病發病率約占75%[1]。 針灸是治療腦血管疾病的有效手段,可體現中藥的優勢和特色,其療效得到臨床認可,研究發現,針刺神庭、百會兩穴后可改善缺血再灌注損傷大鼠神經功能、改善記憶和學習能力[2-3]。 突觸可塑性指大腦神經元損傷后,突觸功能和形態上的改變,是腦神經元可塑性的基礎[4]。 在正常生理條件下,小膠質細胞M1、M2 亞型極化維持動態平衡,以維護神經系統正常功能,但受外界刺激后,小膠質細胞偏向 M1 型極化,從而促進 TNF-α、IL-1β 表達,加重中樞神經損傷[5]。 隨著miRNA 的研究,研究發現電針能夠激活miR-21 的表達并影響腦缺血損傷[6],電針調控miR-21 可能是其機制之一。 轉錄激活因子 3 (signal transducer and activator of transcription 3,STAT3)信號通路是腦缺血引起損傷的重要途徑,在腦缺血模型大鼠腦組織中被激活,抑制STAT3 活性可緩解大鼠腦損傷癥狀[7],且電針能影響STAT3 的表達。 因此本研究構建局灶性腦缺血大鼠模型,觀察電針對大鼠突觸可塑性、小膠質細胞極化的影響,并探討影響機制。
1 材料和方法
1.1 實驗動物
SPF 級雄性Wistar 128 只大鼠均購自廣州中醫藥大學實驗動物中心[SCXK(粵)2018-0034],在廣州中醫藥大學實驗[SYXK(粵)2018-0001],均7 周齡,體重220 ~250 g,于廣州中醫藥大學實驗室飼養,自由飲食飲水,光照周期為12 h,本研究經三亞市中醫院倫理委員會批準(SYLL-2017-12),并按實驗動物使用的3R 原則給予人道的關懷。
1.2 主要試劑與儀器
miR-21 和內參U6 引物(蘇州泓迅生物科技股份有限公司);尼莫地平片(天津市中央藥業有限公司,規格:每片20 mg,國藥準字 119004);兔抗鼠STAT3、兔抗鼠 p-STAT3、兔抗鼠 JAK2、兔抗鼠 p-JAK2、兔抗鼠內參 β-Actin、羊抗兔 IgG-HRP 二抗(上海恒斐生物科技有限公司, 貨號分別為K002382P、 bs-3429R-1、 K001746P、 K006248P、K006153P、SE134);Dylight 405 標記山羊抗兔 IgG(H+L)(北京百奧萊博科技有限公司,貨號為YT868);G-6805 型電針儀(上海華誼醫用儀器有限公司);無菌針灸針(0.3 mm×25 mm)(蘇州華佗蘇州華佗醫療器械有限公司);HM525 型冷凍切片機(德國MICROM 公司);ZF-388 型全自動凝膠成像分析系統(深圳三利化學品有限公司);BSF-30 型熒光顯微鏡(上海巴拓儀器有限公司)。
1.3 實驗方法
1.3.1 動物模型構建
采用大腦中動脈阻塞法(middle cerebral artery occlusion,MCAO)構建大腦中動脈致局灶性腦缺血模型[8],大鼠用2%戊巴比妥鈉腹腔注射麻醉,右側臥位固定,用消毒后的手術剪沿大鼠耳眼連線中點剪開皮膚,分離右側頸動脈、迷走神經、頸外動脈和頸內動脈,頸外動脈遠端用細線雙重結扎離斷,并在舌和上頜動脈分支近端切斷,小切口縫合線插入頸外動脈和頸內動脈殘端。 通過激光多普勒血流計監控腦血流,當出現至少70%腦血流減少時納入研究對象,閉塞60 min 建立局灶性腦缺血模型,假手術組只暴露大腦中動脈,不行凝閉。 分別模型建立后和治療3 周結束后參照Longa 評分[9]標準評價大鼠情況:手提大鼠尾巴懸空,無神經功能損傷,兩前肢向地面伸直(0 分);輕微神經功能缺損,病灶對側前肢肘曲,抬高,肘關節伸直,肩內斂(1 分);中度局灶性神經功能缺損,伴有癱瘓側轉現象(2 分);重度局灶性神經功能缺損,伴有向病灶對側跌倒現象(3 分);無自發活動和認知水平下降(4 分)。 剔除無癥狀(0 分)或癥狀過重(4 分)大鼠,1~3 分說明模型構建成功。 0 分說明假手術組大鼠構建成功。
1.3.2 分組及治療方法
模型制備成功大鼠分為模型組、電針組、尼莫地平組,每組32 只,假手術組32 只。 模型建立后2 h 電針組選取神庭、百會兩穴,用0.3 mm×25 mm 的1 寸毫針直刺神庭穴0.5 寸,斜刺百會穴0.5 寸,以5~10 次/s,強度 3~5 V 的疏密波,時間 30 min 行電針治療,每天一次;尼莫地平組每天灌胃給藥一次(20 mg/kg,2 mL)[10];假手術組、模型組灌胃給藥等體積的生理鹽水,連續治療3 周。
1.3.3 TTC 染色大鼠腦組織檢測大鼠梗死情況
治療3 周結束后,各組隨機選取8 只大鼠用2%戊巴比妥鈉腹腔注射麻醉,手術開胸,暴露心臟,用37℃生理鹽水灌注心臟,手術取經上述操作大鼠腦組織,置于-20℃冰箱中冷凍0.5 h 后取出,切片(2 mm),避光條件下置于37 ℃ 2,3,5-三苯基氯化四氮唑(TTC)中染色0.5 h。 可見染色后腦未梗死區域呈紅色,梗死區域呈白色,用Image Pro Plus 軟件計算每個腦組織的梗死體積。
1.3.4 透射電鏡觀察腦皮層區突觸超微并對形態學計量
治療結束后,各組隨機選取8 只大鼠用2%戊巴比妥鈉腹腔注射麻醉大鼠,立刻手術開胸,暴露心臟,行左心室主動脈插管,灌入100 mL 37℃生理鹽水,隨后用PBS(含有2.5%戊二醛和4%多聚甲醛)灌流0.5 h。 手術取經上述操作大鼠左側缺血腦皮層(見圖1),部分腦皮層放入PBS(含有2%戊二醛和2%多聚甲醛)溶液中固定3 h,固定結束后用PBS 清洗3 次,4℃條件下用1%鋨酸固定1 h,PBS 清洗3 次,梯度乙醇洗脫,丙酮脫水,在含有丙酮的包埋液中滲透2 h,純Epon812 包埋液中滲透3 h,滲透結束后置于60℃烘箱中過夜,超薄切片(約60 nm),將切片至于銅網上(300 目),經檸檬酸鉛和醋酸鈾染色,電鏡觀察突觸超微結構并根據Bertoni-Freddari 等[11]方格點計數法定量分析面數密度(Nv)、突觸體密度(Vv)、突觸連接帶面密度(Sv)、突觸后致密物質(PSD),用生物圖像分析儀定量分析突觸間隙寬度和突觸界面曲面率。

圖1 大鼠腦皮層Figure 1 Cerebral cortex of rats
1.3.5 免疫熒光檢測腦皮層區小膠質細胞極化情況
部分腦皮層隨后將切片平鋪至多聚賴氨酸處理后的載玻片上,PBS 清洗3 次,60℃烘箱烤片0.5 h,PBS 清洗3 次,室溫下在3 %過氧化氫溶液中孵育10 min,轉移至5%胎牛血清的濕盒中孵育0.5 h,孵育結束后加入兔抗鼠 Iba1、iNOS、Arg1 一抗(1 ∶200),4℃濕盒內孵育過夜,滴加Dylight 405 標記山羊抗兔 IgG(H+L)(1 ∶200),37℃ 孵育 2 h,使用DAPI 染核,封片,熒光顯微鏡拍照,使用Image J 軟件計數陽性細胞數。
1.3.6 qRT-PCR 法檢測腦皮層區miR-21 水平
治療結束后,剩余8 只大鼠脫頸處死,立刻手術取出腦皮層,取部分TRIzol 法提總RNA,按照逆轉錄試劑盒說明書操作行反轉錄為cDNA。 用qRTPCR 儀測定 miR-21 水平,miR-21 上游引物:5’-GAAATGCCTCACAGCTATCGT-3’;下游引物:5’-CCTCCACAAAGAGCCACC-3’。 內參 U6 上游引物5’-ATTGGAACGATACAGAGAAGATT-3’; 下 游 引物:5’-GGAACGCTTCACGAATTTG-3’。 反應體系(20 μL):上下游引物各 0.5 μL,2×Mix 10 μL,cDNA 模板 1 μL,H2O 8 μL。 反應條件設定為:95℃預變性5 min,95℃ 10 s、62℃ 30 s,78℃ 30 s,45個循環,72℃延伸 5 min。 2-ΔΔCT法對各組 miR-21 水平定量分析。
1.3.7 蛋白印跡法測定腦皮層區JAK2、p-JAK2、STAT3、p-STAT3 蛋白水平
部分腦皮層區置于含200 μL 蛋白裂解液的研缽中,充分研磨,離心取上清液,根據BCA 試劑盒說明書測定總蛋白含量,上樣行SDS-PAGE 電泳(濃縮膠 80 V、30 min,分離膠 120 V、60 min 電泳),濕法轉膜,室溫下5% BSA 封閉位點1 h,分別加入兔抗鼠JAK2、兔抗鼠 p-JAK2、兔抗鼠 STAT3、兔抗鼠p-STAT3、兔抗鼠內參 β-Actin 抗體(1 ∶1000),4 ℃孵育過夜,加入羊抗兔IgG-HRP 二抗(1 ∶1000),37℃條件下孵育1 h 后,ECL 顯影、曝光、凝膠成像儀拍照觀察并根據灰度值分析蛋白水平。
1.4 統計學方法
使用SPSS 22.0 版軟件對數據進行統計分析。數據以平均數±標準差()形式表示,多組比較行單因素方差分析,任意兩組相比行SNK-q檢驗。P<0.05 說明差異有統計學意義。
2 結果
2.1 各組大鼠治療后神經功能缺損評分
與假手術組相比,模型組大鼠神經功能缺損評分顯著升高(P<0.05);與模型組相比,電針組和尼莫地平組大鼠神經功能缺損評分明顯降低(P<0.05);電針組與尼莫地平組大鼠神經功能缺損評分差異無統計學意義(P>0.05)。 見表1。
表1 各組大鼠治療后神經功能缺損評分(, n=32)Table 1 Score of nerve function defect after treatment in each group

表1 各組大鼠治療后神經功能缺損評分(, n=32)Table 1 Score of nerve function defect after treatment in each group
注:與假手術組相比,aP<0.05;與模型組相比,bP<0.05。Note. Compared with the sham group,aP < 0.05. Compared with the model group,bP < 0.05.
組別Groups神經功能缺損評分Neurological deficit score假手術組Sham operation group 0.00±0.00模型組Model group 2.35±0.13a電針組Electroacupuncture group 1.72±0.10ab尼莫地平組Nimodipine group 1.73±0.11ab
2.2 各組大鼠腦梗死體積比較
與假手術組相比,模型組大鼠腦梗死體積顯著升高(P<0.05);與模型組相比,電針組和尼莫地平組大鼠腦梗死體積明顯降低(P<0.05);電針組與尼莫地平組大鼠腦梗死體積差異無統計學意義(P>0.05)。 見圖 2 和表 2。
表2 各組大鼠腦梗死體積比較( ,n=8)Table 2 Comparison of cerebral infarction volume of rats in each group
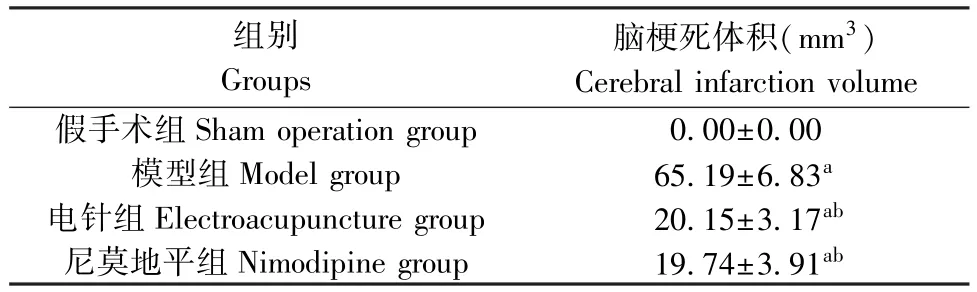
表2 各組大鼠腦梗死體積比較( ,n=8)Table 2 Comparison of cerebral infarction volume of rats in each group
注:與假手術組相比,aP<0.05;與模型組相比,bP<0.05。Note. Compared with the sham group,aP < 0.05. Compared with the model group,bP < 0.05.
組別Groups腦梗死體積(mm3)Cerebral infarction volume假手術組Sham operation group 0.00±0.00模型組Model group 65.19±6.83a電針組Electroacupuncture group 20.15±3.17ab尼莫地平組Nimodipine group 19.74±3.91ab

圖2 各組大鼠腦梗死情況Note. A, Sham operation group. B, Model group. C,Electroacupuncture group. D, Nimodipine group.Figure 2 Cerebral infarction of rats in each group
2.3 各組大鼠腦皮層區突觸超微結構觀察和形態學計量分析
模型組突觸數目明顯減少,神經突起中細胞骨架結構散亂,突觸間隙變窄,連接帶變短,伴有巨大空泡樣,軸漿漲大;電針組可見突觸數量增多,神經突起中細胞骨架結構清晰,突觸間隙變寬,連接帶變長,伴有少量空泡樣;尼莫地平組突觸超微結構與電針組類似,見圖3。 與假手術組相比,模型組大鼠突觸 Nv、Vv、Sv、PSD、突觸界面曲面率、突觸間隙寬度明顯降低(P<0.05);與模型組相比,電針組、尼莫地平組大鼠突觸 Nv、Vv、Sv、PSD、突觸界面曲面率、突觸間隙寬度顯著升高(P<0.05);電針組與尼莫地平組大鼠突觸 Nv、Vv、Sv、PSD、突觸界面曲面率、突觸間隙寬度差異無統計學意義(P>0.05),見圖 3 和表3。
表3 各組大鼠突觸形態學計量分析( ,n=8)Table 3 Morphological and quantitative analysis of synapses in rats of each group

表3 各組大鼠突觸形態學計量分析( ,n=8)Table 3 Morphological and quantitative analysis of synapses in rats of each group
注:與假手術組相比,aP<0.05;與模型組相比,bP<0.05。Note. Compared with the sham group,aP < 0.05. Compared with the model group,bP < 0.05.
組別Groups面數密度Nv(piece/μm3)突觸體密度Vv(μm2/μm3)突觸連接帶面密度Sv(μm2/μm3)突觸后致密物質PSD(nm)突觸界面曲面率Surface rate of synaptic interface突觸間隙寬度(nm)Width of synaptic space假手術組Sham operation group 2.15±0.18 0.12±0.03 0.14±0.02 49.57±3.06 1.25±0.06 25.78±1.29模型組Model group 0.48±0.06a 0.04±0.01a 0.04±0.02a 32.18±2.29a 1.06±0.04a 13.57±1.18a電針組Electroacupuncture group 1.29±0.14ab 0.08±0.02ab 0.07±0.03ab 39.01±3.18ab 1.12±0.03ab 18.70±1.24ab尼莫地平組Nimodipine group 1.26±0.15ab 0.08±0.03ab 0.07±0.02ab 40.02±3.37ab 1.13±0.05ab 17.69±1.36ab

圖3 各組大鼠腦皮層區突觸超微結構Note. A, Sham operation group. B, Model group. C,Electroacupuncture group. D, Nimodipine group.Figure 3 Synaptic ultrastructure of cerebral cortex of rats in each group
2.4 各組大鼠腦皮層區小膠質細胞極化情況比較
與假手術組相比,模型組大鼠腦皮層M1 小膠質細胞(iNOS)數量顯著升高(P<0.05),M2 型小膠質細胞(Arg1)數量明顯降低(P<0.05);與模型組相比,電針組和尼莫地平組M1 型小膠質細胞數量明顯降低(P<0.05),M2 型小膠質細胞數量顯著升高(P<0.05);電針組與尼莫地平組M1 型小膠質細胞和M2 型小膠質細胞數量差異無統計學意義(P>0.05),見圖 4 和表 4。

圖4 各組大鼠腦皮層區小膠質細胞數Note. A, Sham operation group. B, Model group. C, Electroacupuncture group. D, Nimodipine group.Arrows indicate positive cells.Figure 4 Number of microglias in the cortex of rats in each group
表4 各組大鼠小膠質細胞數( ,n=8)Table 4 Number of microglias in each rat group

表4 各組大鼠小膠質細胞數( ,n=8)Table 4 Number of microglias in each rat group
注:與假手術組相比,aP<0.05;與模型組相比,bP<0.05。Note. Compared with the sham operation group,aP < 0.05. Compared with the model group,bP < 0.05.
組別Groups M1 型小膠質細胞(個/視野)M1 type small keratinocytes(piece/field of vision)M2 型小膠質細胞(個/視野)M2 type small keratinocytes(piece/field of vision)假手術組 Sham operation group 52.74±7.28 150.46±15.73 12.06±2.71a電針組 Electroacupuncture group 22.29±5.14ab 50.84±6.22ab尼莫地平組Nimodipine group 18.25±7.10ab 51.49±7.53ab模型組Model group 98.48±10.76a
2.5 各組大鼠腦皮層區 miR-21、 STAT3、 p-STAT3、JAK2、p-JAK2 水平
各組大鼠腦皮層區STAT3、JAK2 水平無明顯變化(P>0.05)。 與假手術組相比,模型組大鼠腦皮層區 miR-21、p-STAT3、p-JAK2 水平顯著升高(P<0.05);與模型組相比,電針組和尼莫地平組大鼠腦皮層區 miR-21、p-STAT3、p-JAK2 水平明顯降低(P<0.05);電針組與尼莫地平組大鼠腦皮層區miR-21、p-STAT3、p-JAK2 水平差異無統計學意義(P>0.05)。 見圖 5 和表 5。
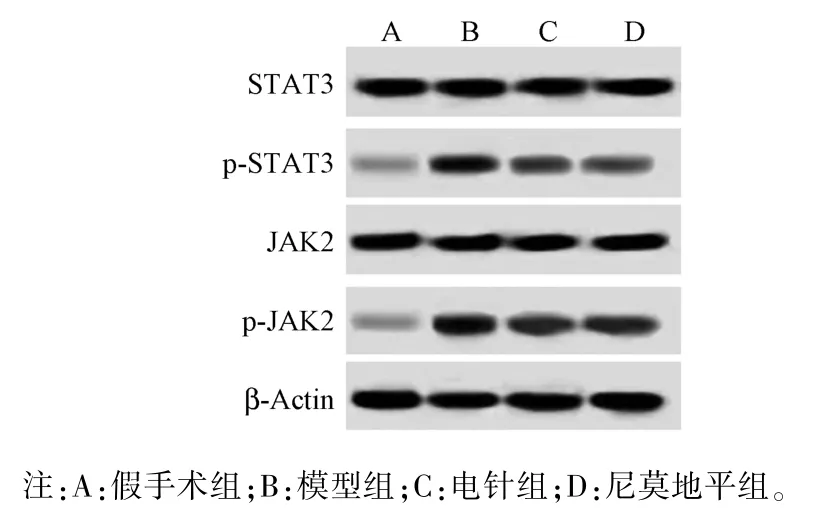
圖5 各組大鼠腦皮層區 STAT3、p-STAT3、JAK2、p-JAK2 水平Note. A, Sham operation group. B, Model group. C,Electroacupuncture group. D, Nimodipine group.Figure 5 STAT3, p-STAT3, JAK2 and p-Jak2 levels in the cerebral cortex of rats in each group
表5 各組大鼠腦皮層區miR-21、STAT3、p-STAT3、JAK2、p-JAK2 水平( ,n=8)Table 5 miR-21, STAT3, p-STAT3, JAK2, and p-JAK2 levels in the cerebral cortex of rats in each group

表5 各組大鼠腦皮層區miR-21、STAT3、p-STAT3、JAK2、p-JAK2 水平( ,n=8)Table 5 miR-21, STAT3, p-STAT3, JAK2, and p-JAK2 levels in the cerebral cortex of rats in each group
注:與假手術組相比,aP<0.05;與模型組相比,bP<0.05。Note. Compared with the sham group,aP < 0.05. Compared with the model group,bP < 0.05.
組別Groups miR-21/U6 p-STAT3/STAT3 p-JAK2/JAK2假手術組 Sham operation group 1.06±0.17 0.24±0.04 0.27±0.04模型組 Model group 2.46±0.25a 1.25±0.18a 1.30±0.14a電針組 Electroacupuncture group 1.71±0.19ab 0.81±0.09ab 0.76±0.09ab尼莫地平組 Nimodipine group 1.72±0.21ab 0.77±0.08ab 0.77±0.08ab
3 討論
腦缺血中醫論證與虛(氣虛、陰虛)、風(外風、肝風)、氣(氣逆)、火(心火、肝火)、血(血瘀)、痰(濕痰、風痰)六端相關[12]。 針灸作為腦缺血的治療手段,神庭位于人中心之處,神庭“神處其中則靈,靈則應,應則保身”,可調控人神經系統[13]。 百會為百脈之宗,各經脈之氣匯聚之地,可貫達全身,連貫全身周穴,調控機體陰陽平衡[14]。 本研究為選擇神庭、百會穴行電針治療,探究電針對局灶性腦缺血大鼠的影響,MCAO 法構建大腦中動脈致局灶性腦缺血模型,與假手術組相比,模型組大鼠神經功能缺損評分、腦梗死體積顯著升高,提示模型構建后神經功能損傷嚴重。 與模型組相比,經電針后,大鼠神經功能缺損評分、腦梗死體積明顯降低,說明電針能夠緩解局灶性腦缺血大鼠腦損傷,具有一定臨床應用價值。
大腦皮層神經網絡作為自組織、信息處理、行為適應的復雜系統由大量的神經元組成,正常情況下神經元的興奮性和抑制性突觸可塑性處于平衡狀態,維持大腦信息生成和傳遞效率,但在腦缺血后出現興奮性氨基酸毒性作用,導致突觸可塑性發生改變[15-16]。 本研究發現,與假手術組相比,模型組大鼠腦組織突觸數目明顯減少、間隙變窄、連接帶變短,神經突起中細胞骨架結構散亂,伴有巨大空泡樣,軸漿漲大,Nv、Vv、Sv、PSD、突觸界面曲面率、突觸間隙寬度明顯降低,說明模型組大鼠突觸形態和結構改變。 經電針治療后,大鼠腦組織突觸數量增多、間隙變寬、連接帶變長,神經突起中細胞骨架結構清晰,突觸 Nv、Vv、Sv、PSD、突觸界面曲面率、突觸間隙寬度顯著升高,說明電針治療可保護突觸可塑性,恢復突觸界面曲面率,可能對于自組織、信息處理、行為適應有緩解作用。 小膠質細胞對于促進突觸發育、維持突觸正常功能和突觸可塑性具有調節作用,腦缺血后會導致小膠質極化,小膠質與神經元接觸時間延長,導致部分突觸結構消失,缺血早期梗死區向M2 型極化;隨著病情的嚴重向M1 型極化,而M1 型主導炎癥反應,從而過表達CD86、MHCⅡ、iNOS、Fcγ 受體,可分泌炎性介質以加重中樞神經細胞炎癥反應,導致腦組織受損[17]。本研究發現,與假手術組相比,模型組大鼠海馬區M1 型小膠質細胞數量顯著升高,M2 型小膠質細胞數量明顯降低,提示該研究中腦缺血已處于嚴重時期,小膠質細胞向M1 型極化嚴重,而M1 型主導炎癥反應,加重腦損傷。 經治療后小膠質細胞可向M2亞型極化,從而過表達CD206、Arg1 以分泌保護因子清除參與中樞神經免疫、修復,同時可清除中樞代謝廢物,實現對神經的保護[18]。 本研究同樣證明,經電針治療后,大鼠M1 型小膠質細胞數量明顯降低,M2 型小膠質細胞數量顯著升高,說明電針可改善小膠質細胞極化失衡,恢復神經功能。 但是電針通過何種信號通路以保護突觸可塑性和維維持膠質細胞極化平衡有待進一步研究。
本研究發現,與假手術組相比,miR-21 水平和STAT3、JAK2 磷酸化水平顯著升高,說明腦缺血大鼠腦皮層區miR-21/JAK2/STAT3 通路被激活。 在腦缺血大鼠腦皮層區N-甲基-D-天冬氨酸受體(NMDAR)高度活化可誘導JAK2 磷酸化,從而促使STAT3 磷酸化參與調節破壞突觸可塑性[19]。 miR-21 可能調控多基因、多環路表達紊亂,可影響一系列調控失常的精神分裂結構網絡,STAT3 可參與神經細胞炎癥反應,以加重中樞神經損傷;miR-21 其中通過別的通路調控STAT3 信號通路在精神分裂癥大鼠腦組織中處于激活狀態影響疾病[20]。 經電針治療后,大鼠腦皮層區 miR-21 水平和 STAT3、JAK2 磷酸化水平明顯降低,說明電針可抑制miR-21/JAK2/STAT3 通路活性。
綜上所述,局灶性腦缺血大鼠行神庭、百會穴電針治療可保護突觸可塑性和維持膠質細胞極化平衡,可能與抑制miR-21/JAK2/STAT3 通路活性相關。 但是具體調控機制還有待深入研究。

