Mn-Co/二維TiO2催化劑對甲苯的催化氧化性能
鐘少濤,陳定盛,盧 龍*,胡春華,方 平,陳雄波,岑超平
(1.南昌大學資源環境與化工學院,鄱陽湖環境與資源利用教育部重點實驗室,江西 南昌 330031;2.生態與環境部華南環境科學研究所,廣東省水污染與空氣污染控制重點實驗室,廣東省空氣污染控制工程實驗室,廣東 廣州 510655)
隨著我國經濟社會的高速發展,工業化水平不斷提高,能源消耗持續加快,伴隨著環境污染日益加重。揮發性有機化合物(VOCs)是重要的大氣污染物之一,是二次有機氣溶膠(SOA)、PM2.5[1]和O3[2-3]形成的重要前驅體,并且對人體健康危害極大[4]。目前,VOCs主要去除方法包括催化氧化法、吸附法、吸收法、直接燃燒法、生物凈化法、等離子體處理法等[5-7]。其中催化氧化法具有節能、高效、無二次污染等優點,從而受到廣泛運用[8]。催化氧化法的核心是催化劑,常用的催化劑有貴金屬催化劑和過渡金屬催化劑[9-10]。雖然過渡金屬催化劑的活性低于貴金屬催化劑,但其具有價廉,低溫還原性好等優點而受到廣泛研究[11-13]。
在過渡金屬催化劑中,錳和鈷催化劑是一類環境友好型催化劑,具有較好的活性,特別是Mn-Co雙金屬催化劑對VOCs具有良好的催化活性[14-15],這是因為Mn和Co納米晶緊密接觸,改變了晶型結構和金屬價態,增強了兩者之間的協同作用,提高了催化活性[16-17]。除了催化活性組分之外,催化劑載體在VOCs的催化反應中也起重要作用。負載型催化劑具有較大的比表面積,有利于活性組分分散和提高污染物吸附位點,可極大提高催化活性[18]。此外載體的酸性、孔隙結構也是影響催化活性的重要因素[19]。
TiO2是一種白色粉末狀的兩性金屬氧化物,廣泛作為催化劑載體。有研究報道,TiO2作為載體負載活性組分能夠形成金屬-載體強相互作用,從而提高催化劑的活性[20-21]。此外,有研究表明[22],超薄的二維TiO2納米片具有高比表面積和更多的活性反應位點,有利于提高催化劑反應活性。本文采用水熱法制備二維TiO2納米片,然后使用浸漬法負載Mn-Co活性組分,制備Mn-Co/TiO2催化劑,研究了不同活性組分配比、負載量、焙燒溫度和不同反應空速對催化劑催化氧化甲苯的影響,并采用XRD、SEM、H2-TPR和BET等手段分析對其理化性質進行表征分析。
1 材料制備與方法
1.1 試劑與材料
鈦酸異丙酯(上海麥克林生化科技有限公司,97%)、乙二醇(上海麥克林生化科技有限公司)P25(上海麥克林生化科技有限公司,分析純)、聚醚P123(上海麥克林生化科技有限公司,分析純)、無水乙醇(上海麥克林生化科技有限公司,分析純)、六水合硝酸鈷(上海麥克林生化科技有限公司,分析純)、檸檬酸(上海麥克林生化科技有限公司,分析純)、四水硝酸錳(上海阿拉丁生化科技股份有限公司,分析純);鹽酸(廣州化學試劑廠,分析純)。
1.2 催化劑的制備
1.2.1 二維TiO2納米片的制備
TiO2納米片制備:TiO2納米片是根據水熱法制備[22]。首先在劇烈攪拌下,將1.05 g的鈦酸異丙酯加入到0.74 g的濃鹽酸溶液中;其次將0.2 g的聚醚P123溶于3.0 g的乙醇溶液中攪拌至溶解。再將P123與乙醇混合溶液加入到鈦酸異丙酯與濃鹽酸混合液中攪拌30 min。然后取2.5 g攪拌后的混合液加入到20 mL乙二醇溶液中繼續攪拌30 min,最后將其轉移至45 mL的高壓反應釜中在150 ℃下加熱20 h。將水熱反應后的產物用乙醇和去離子水交替洗滌3次,然后在80 ℃下干燥12 h,在550 ℃下焙燒2 h獲得TiO2納米片。
1.2.2 負載型TiO2納米片催化劑的制備
活性組分的負載采用浸漬法制備。將制備好的TiO2納米片分散至50 mL去離子水中,并超聲處理5 min并攪拌1 h。然后按一定錳鈷摩爾量比,取適量的硝酸錳、硝酸鈷和檸檬酸(檸檬酸的摩爾量等于兩種金屬摩爾量之和)加入至溶液中繼續攪拌5 h之后放入鼓風干燥箱中80 ℃烘干。將烘干后的樣品放入馬弗爐焙燒;待樣品冷卻后研磨,過篩獲得催化劑樣品。
1.3 催化劑活性評價
催化劑活性評價實驗在VOCs固定床反應器中進行,石英玻璃反應管內徑6 mm,長50 cm。取200 mg 40~60目的樣品用石英棉填入反應管中。利用液相甲苯鼓泡法由載氣N2流經裝有液態甲苯的玻璃鼓泡瓶帶出甲苯氣體,通過調節載氣N2流量和水浴溫度控制甲苯濃度約為2 054 mg·m-3。氮氣、氧氣和甲苯氣體在氣體混合罐中充分混合后進入催化床反應器。床層溫度由程序加熱升溫控制儀控制。測試反應溫度區間為140 ℃~300 ℃,以20 ℃為溫度梯度,在每個溫度階段穩定30 min后再采樣。反應前后的氣體濃度由氣相色譜儀(Agilent 6890N)進行檢測分析。催化劑活性采用甲苯轉化率T進行評價,計算方法如式(1):
T=(CIN-COUT)/CIN×100%
(1)
式中:CIN進氣口中甲苯含量,COUT出氣口中甲苯含量,單位:mg·m-3。
1.4 催化劑的表征
采用德國Bruker公司D8 ADVANCE多晶(粉末)X射線衍射儀進行X線衍射分析(XRD);采用日本日立公司S4800型掃描電鏡顯微鏡測定樣品形貌;采用美國麥克公司ASAP2020M+C型吸附儀測定樣品比表面積、孔徑結構參數(BET);采用美國麥克公司AutoChemII2920型化學吸附儀測定樣品的氧化還原能力(H2-TPR)。
2 結果與討論
2.1 催化劑物理化學性質表征
2.1.1 XRD分析
圖1為焙燒溫度300 ℃,活性組分負載量為16 wt%條件下制備不同錳鈷摩爾比(催化劑合成時加入Mn、Co物質的量比)的Mn-Co/TiO2催化劑的XRD圖譜。由圖1可知,TiO2載體在2θ為25.5°、36.9°、37.9°、38.5°、48.2°、53.8°、55°、63.0°、69.2°、70.89°、75.4°出現銳鈦礦型衍射峰[24],說明TiO2載體為銳鈦礦相,而Mn8-Co1/P25在2θ為27.4°出現微弱的金紅石型衍射峰,說明P25為金紅石銳鈦礦混合相。有研究表明[25],銳鈦礦型TiO2表現出比金紅石型更好的催化性能。隨著錳鈷摩爾比的增加,銳鈦礦型衍射峰強度逐漸減弱,推測Mn和Co的摻雜導致TiO2結晶度降低,Mn、Co和Ti物種之間形成強烈的相互作用,使得Mn和Co主要以無定形態或者高度分散的狀態存在于TiO2表面,這有助于增加表面氧物種及流動性[26]。而當錳鈷摩爾比增至10:1,TiO2的特征衍射峰增強,推測這是Mn過量出現燒結現象,導致Mn、Co和Ti物種之間的相互作用減弱,生成Mn2O3,而Mn2O3分散性較好,XRD難以檢測出Mn2O3的結晶相[27]。Mn8-Co1/TiO2表現出最弱的TiO2特征衍射峰,說明錳鈷摩爾比8:1時,Mn、Co和Ti物種之間的相互作用最強烈,使得表面氧物種增多和氧的流動性增強,從而顯著提高了催化劑催化還原性能,這與2.2.1中Mn8-Co1/TiO2甲苯催化活性最高的實驗結果相一致。此外,Mn8Co1Oz在2θ為36.4°出現一個寬的衍射峰,可歸屬于CoMnO3相[28],并且隨著將活性組分負載至TiO2,CoMnO3衍射峰消失,進一步說明Mn、Co可以高度分散在TiO2表面,從而提高催化劑的催化性能。
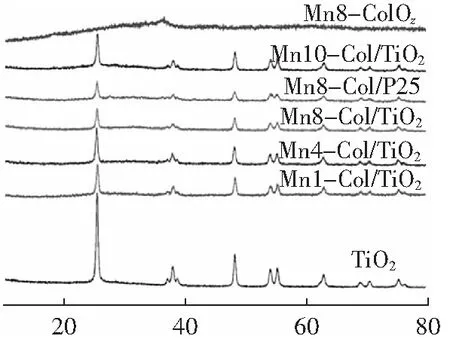
2θ/(°)圖1 不同錳鈷摩爾比的Mn-Co/TiO2催化劑的XRD圖譜
2.1.2 H2-TPR分析
圖2為焙燒溫度300 ℃、負載量為16 wt%條件下制備不同錳鈷摩爾比的Mn-Co/TiO2催化劑的H2-TPR圖譜。由圖2可知,TiO2基本沒有還原性。對于Mn8Co1Ox在200 ℃~300 ℃出現的峰可歸為MnxCoyOz被還原成Mn2O3和Co3O4[29],在300 ℃~400 ℃出現的峰可歸為Co3O4和Mn2O3被還原為CoO和MnO[30],在400 ℃~600 ℃之間出現的寬峰可歸為Co2+被還原為Co0[29-30]。與Mn-Co混合氧化物相比,Mn-Co/TiO2催化劑的還原曲線有很大的不同。對于Mn-Co/TiO2,還原峰的位置和峰面積與錳鈷摩爾比有關,隨著Mn含量增加,在200 ℃~250 ℃出現明顯的雙峰,且峰面積增大,可歸為Mn-Co/TiO2表面吸附的氧物種、氧空位和Mn4+物種[30-31],而在250 ℃~350 ℃出現的峰可歸為Mn2O3和Co3O4被還原為MnO和CoO,在400 ℃~600 ℃出現的峰可歸為CoO被還原為Co[31],并且隨著Mn含量的增加,峰位置往高溫偏移,說明Mn、Co之間存在強烈相互作用,導致Co2+還原越來越困難。根據先前的研究[29,31],Mn-Co/TiO2在3個溫度區間發生的還原反應可歸為以下3個步驟。
MnxCoyOZ(s)+H2(g)→Mn2O3+Co3O4(s)+H2O(g)
(1)
Mn2O3-Co3O4(s)+H2(g)→MnO+CoO(s)+H2O(g)
(2)
MnO-CoO+H2(g)→MnO(s)+Co(s)+H2O
(3)
此外,通過對H2-TPR峰擬合得到H2消耗(可還原氧物種量)見表1。由表1可知,Mn8Co1Ox在第1個還原峰的H2消耗為2.41 mmol·g-1,遠大于其他催化劑,然而考慮到Mn8-Co1/TiO2中Mn和Co負載量僅16 wt%,因此Mn8-Co1/TiO2中單位重量的H2消耗量比Mn8Co1Oz的消耗量高約245%,先前的研究已表明[30],將Mn-Co負載在載體上,其低溫還原性更強。結合圖2,錳鈷摩爾比增大,Mn-Co/TiO2在低溫下的第1個還原峰面積隨之增大,H2消耗增多,當Mn/Co為8時,H2消耗量達到最大1.20,而Mn/Co增至10,H2消耗量降至0.70。不同錳鈷摩爾比的催化劑在第1個還原峰的H2消耗遵循以下順序:Mn8-Co1/TiO2>Mn4-Co1/TiO2>Mn10-Co1/TiO2>Mn8-Co1/P25>Mn1-Co1/TiO2,其與它們的甲苯催化活性順序相一致。研究表明,Mn8-Co1/TiO2催化劑具有更多高價態的Mn離子,并且能形成更多的氧空位以及更強的氧移動性,因此具有更好的低溫還原性能。
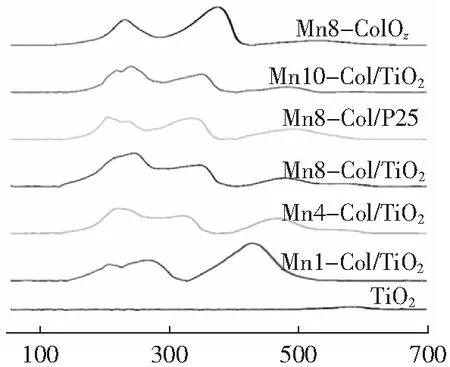
T/℃圖2 不同錳鈷摩爾比的Mn-Co/TiO2催化劑的H2-TPR圖譜
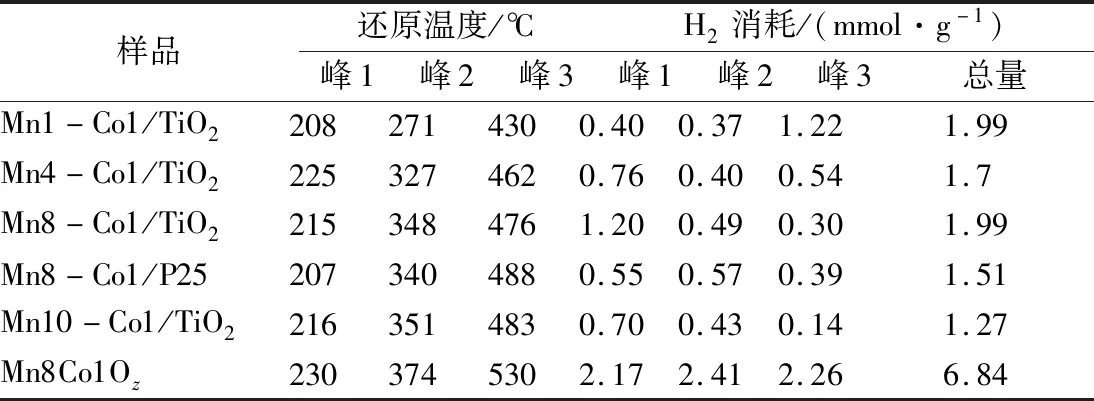
表1 Mn-Co/TiO2催化劑的H2還原溫度和消耗量
2.1.3 BET分析
表2為催化劑錳鈷摩爾比8:1,活性組分負載量為16 wt%,其在不同焙燒溫度下的比表面積、平均孔徑和孔容。由表2可知,隨著焙燒溫度的升高,催化劑比表面積下降,孔徑增加,焙燒溫度為300 ℃升至500 ℃,催化劑比表面積從61.9 m2·g-1降至51.9 m2·g-1,這說明,催化劑在高溫下出現燒結現象,催化劑結構發生改變,比表面積減小,導致催化劑表面活性位點減少,進而降低催化劑的催化性能,這與2.2.2討論的結果相吻合。此外,同等焙燒溫度下,Mn8-Co1/P25的比表面積小于Mn8-Co1/TiO2,這也說明Mn8-Co1/TiO2催化劑中活性組分分散性更好,有更多的活性位點。

表2 Mn-Co/TiO2催化劑在不同焙燒溫度下的比表面積、孔徑和孔容
2.1.4 SEM分析
圖3為錳鈷摩爾比為8:1,焙燒溫度300 ℃,不同活性組分負載量的催化劑的SEM圖。由圖3可知,未負載活性組分的TiO2載體為片狀的結構,表面平整,并且無序堆疊在一起,具有豐富的孔隙結構。隨著Mn-Co活性組分的負載,催化劑表面形貌發生較大的改變,當活性組分負載量為12 wt%和16 wt%時,活性組分能較為均勻的分布在催化劑表面,而負載量增至20%,催化劑表面出現較多和較大的顆粒狀物質,其原因可能是活性組分過量,在催化劑浸漬過程中不能均勻覆蓋在載體表面,造成團聚堆積現象。過量的活性組分反而容易堵塞催化劑孔隙,減少活性位點,不利于甲苯的吸附和降解,從而降低催化劑的催化性能。

圖3 不同活性組分負載量的Mn-Co/TiO2催化劑的SEM圖
2.2 催化劑催化氧化性能
2.2.1 不同錳鈷摩爾比對Mn-Co/TiO2催化劑活性的影響
圖4為TiO2納米片為載體,活性組分負載量為16 wt%,焙燒溫度為300 ℃條件下制備不同錳鈷摩爾比的催化劑在反應空速為32 000 h-1時催化氧化甲苯活性的影響。由圖4可知,催化劑在較低溫度下呈現出良好的甲苯轉化效果,隨著錳鈷摩爾比從1:1增加到8:1時,催化劑甲苯催化反應活性隨之增強。特別是Mn:Co為8:1時,催化劑效果最佳(t50≈227 ℃,t90≈238 ℃,t50、t90分別為甲苯轉化率達到50%和90%時所需的反應溫度),并且在反應溫度為240 ℃,甲苯轉化率約為100%,然而,當Mn:Co提高至10:1時,催化活性明顯降低。由圖可知,催化劑的甲苯催化活性遵循以下順序:Mn8-Co1/TiO2>Mn4-Co1/TiO2>Mn10-Co1/TiO2>Mn8-Co1/P25>Mn8Co1Oz>Mn1-Co1/TiO2。需要指出的是Mn8-Co1/TiO2(t90≈227 ℃)比Mn8-Co1/P25(t90≈245 ℃)和Mn8Co1Oz(t90≈252 ℃)表現出更好的甲苯催化氧化活性,說明TiO2納米片比P25具有更好的載體性能。Mn8-Co1/TiO2相比較于貴金屬Au催化劑[23]、MnCoOx[14]、Mn-Co/CF[16]催化劑,其甲苯的催化氧化活性更高。以上結果表明,TiO2負載Mn、Co活性組分對甲苯具有良好的催化氧化活性。

T/℃圖4 不同錳鈷摩爾比對Mn-Co/TiO2催化劑活性的影響
2.2.2 焙燒溫度對Mn-Co/TiO2催化劑活性的影響
圖5為錳鈷摩爾比為8:1,活性組分負載量為16 wt%在不同焙燒溫度下制備的催化劑在反應空速為32 000 h-1時催化劑活性的影響。由圖5可知,催化劑在300 ℃焙燒,其甲苯的轉化率在反應溫度240 ℃下接近100%,而在400 ℃和500 ℃下焙燒的催化劑,甲苯轉化率僅73%和28%。這說明焙燒溫度可極大的影響催化劑對甲苯的催化活性,催化活性隨著焙燒溫度的升高而降低。分析認為,在高溫焙燒環境中,催化劑表面結構發生改變,進而造成催化劑表面的活性組分分散性降低,活性位點減少,導致催化劑的催化活性降低。結果表明,Mn-Co/TiO2催化劑在較低溫度下焙燒,其對甲苯催化活性更好。
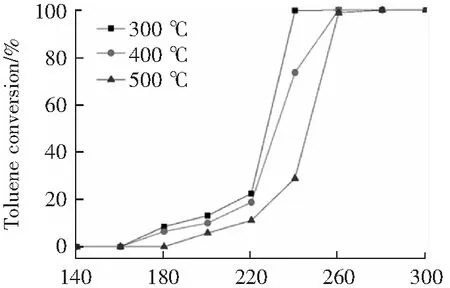
T/℃圖5 不同焙燒溫度對Mn-Co/TiO2催化劑活性的影響
2.2.3 活性組分負載量對Mn-Co/TiO2催化劑活性的影響
圖6為錳鈷摩爾比為8:1,焙燒溫度為300 ℃,不同錳鈷活性組分負載量的催化劑在反應空速為32 000 h-1時催化劑活性的影響。由圖6可知,不同錳鈷負載量的催化劑在反應溫度220 ℃~260 ℃區間內對甲苯的催化活性表現出顯著差異,其中,Mn-Co負載量為16 wt%的催化劑的催化活性最佳,在反應溫度為240 ℃時,甲苯轉化率接近100%,其次是20 wt% Mn-Co/TiO2(甲苯轉化率92%),12 wt% Mn-Co/TiO2(甲苯轉化率64%)。由上述可知,催化劑活性組分負載量存在一個臨界值,超過臨界值,催化劑的催化活性反而降低。推測活性組分的增加,可以提供更多的催化活性位點,促進更多的甲苯分子與活性組分充分接觸,從而提高催化劑的催化活性,然而當負載量超過16 wt%時,催化劑表面活性組分出現堆積,造成分散度降低,活性位點反而減少,不利于甲苯分子吸附和催化,從而導致催化活性的降低。因此,適宜的活性組分負載量可以提高Mn-Co/TiO2催化劑催化氧化甲苯的性能。
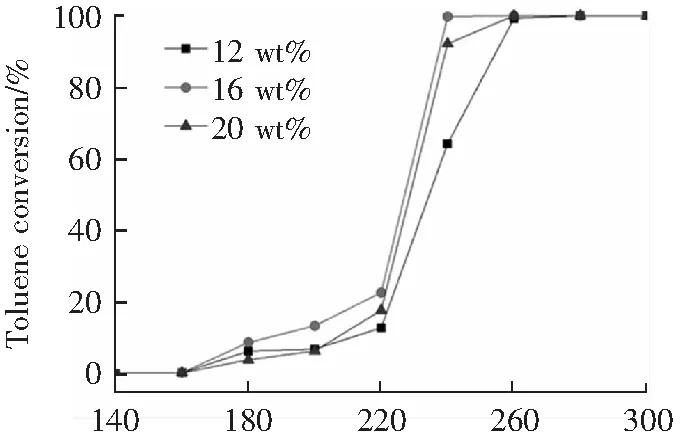
T/℃圖6 不同活性組分負載量對Mn-Co/TiO2催化劑活性的影響
2.2.4 空速對Mn-Co/TiO2催化劑活性的影響
圖7為錳鈷摩爾比為8:1,焙燒溫度300 ℃,活性組分負載量為16 wt%條件下制備的催化劑在不同空速條件下對催化劑活性的影響。空速的大小直接反映催化劑與污染物分子接觸反應時間的長短。由圖7可知,當空速從16 000 h-1增加至32 000 h-1,催化劑催化活性并未有明顯的降低,兩空速條件下的t90≈238 ℃,表明即使空速增加1倍,甲苯分子與催化劑依然可以保持充分接觸,在較低溫度下實現甲苯的高效去除。然而當空速增加至64 000 h-1,在238 ℃的反應溫度下,催化劑活性明顯降低,并且其t90≈260 ℃,與低空速下對應的t90相比,升高了近22 ℃。這是因為在此空速下,甲苯分子與催化活性組分之間接觸時間極短,催化反應不充分,部分甲苯分子來不及穩定吸附在催化劑表面進行反應就離開了催化劑反應層,而只有更高的反應溫度下,才能使甲苯分子完全轉化。
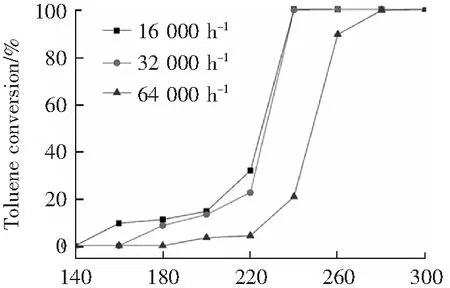
T/℃圖7 不同反應空速條件對Mn-Co/TiO2催化劑活性影響
3 結論
采用二維TiO2納米片為載體制備的Mn-Co/TiO2催化劑對甲苯具有良好的催化性能。在錳鈷摩爾比為8:1,負載量為16 wt%,焙燒溫度為300 ℃,空速為32 000 h-1的條件下,Mn-Co/TiO2催化劑在240 ℃下甲苯轉化率達100%。TiO2的二維片狀結構有助于活性組分的分散,提高催化劑比表面積,并且Ti與Mn-Co之間可形成強烈的相互作用,有利于更多高價態Mn離子和氧空位的形成,增強了Mn-Co/TiO2的深度氧化能力,提高了氧化還原性能。與MnCoOx和Mn-Co/P25催化劑相比,Mn-Co/TiO2對甲苯具有更好的催化活性。

