穩定表達線粒體鈣離子熒光探針4mt-GCaMP6巨噬細胞系的構建
華盛平,王 瑤,鄭潤琪,李金亮,張維娜,夏 晴
(國家生物醫學分析中心,北京 100850)
巨噬細胞作為一種在固有免疫應答和適應性免疫啟動中發揮重要作用的免疫細胞,在保護機體免受感染方面發揮著關鍵作用。巨噬細胞免疫學功能主要包括吞噬(病原體、病毒感染細胞、細胞碎片和死細胞等)、抗原遞呈和細胞因子分泌[1-2]。鈣離子是細胞內重要的第二信使,在細胞周期、運動、自噬和凋亡等生物學事件中發揮重要調節作用[3]。細胞中鈣離子主要存在于細胞漿、線粒體和內質網中,對線粒體發揮功能至關重要[4]。鈣離子促進線粒體內ATP的產生,當線粒體內鈣離子濃度過載時會導致細胞死亡[5]。近年來,鈣離子信號在免疫細胞生物學功能中的作用受到關注,發現鈣離子信號在T細胞分泌集落刺激因子以及肥大細胞脫顆粒過程中均發揮了重要作用[6-7]。相對于T細胞和肥大細胞,有關巨噬細胞鈣離子信號的研究較少,特別是關于線粒體鈣離子信號在巨噬細胞中的作用和調控機制尚未見報道。
4mt-GCaMP6線粒體鈣離子熒光探針是在GCaMP6探針基礎上加入線粒體靶向定位序列,通過綠色熒光強度可特征性地指示線粒體內鈣離子濃度的變化[8]。本研究使用4mt-GCaMP6制備慢病毒并感染永生化小鼠骨髓來源的巨噬細胞(immortalized bone marrow-derived macrophages,iBMDM),構建穩定表達線粒體鈣離子熒光探針的巨噬細胞系iBMDM-4mt-GCaMP6,為探究線粒體鈣信號在巨噬細胞生物學功能中的作用及相關分子機制提供工具。
1 材料與方法
1.1 細胞和主要試劑
iBMDM巨噬細胞和293T細胞取自本實驗室細胞庫。4mt-GCaMP6線粒體鈣離子熒光探針為本實驗室前期構建[8],慢病毒包裝質粒(psPAX2和pCMV-VSVG)取自本實驗室質粒庫。DMEM基礎培養基、胰蛋白酶和青鏈霉素(中科邁晨科技有限公司),胎牛血清(美國Gibco公司),聚凝胺(上海漢恒生物有限公司),嘌呤霉素(北京吉普賽生物技術有限公司),離子霉素(上海陶素生化公司)。Ringer溶液為實驗室自制(mmol·L-1:NaCl 155,KCl 4.5,CaCl22.0,MgCl21.0,HEPES 5.0,葡萄糖10.0,pH=7.4)。病毒濃縮柱(美國Millipore公司),Mito-Tracker?Red FM和Lab-Tek八腔室蓋玻片(美國Thermo Fisher公司)。
1.2 4mt-GCaMP6慢病毒的制備
將293T細胞傳代接種于10 cm培養皿中,待細胞密度為40%時,細胞換液加新鮮的DMEM培養基10 mL。配置磷酸鈣轉染體系:HBS溶液1 mL,4mt-GCaMP6質粒 6 mg,psPAX2質粒 4.5 mg,pCMV-VSVG質粒1.5 mg。用移液槍將轉染體系混合均勻后靜置5 min,緩慢逐滴加入CaCl267 mL,混合均勻后靜置15 min,隨后將轉染體系逐滴加入培養基中。6 h后細胞換液加入培養基10 mL,48 h后補加培養基5 mL,72 h后收集含有病毒的培養上清到離心管中。常溫離心機中200×g離心15 min,隨后取上清用0.45 mm濾器過濾到病毒濃縮柱中。4℃,7000×g離心30 min,隨后在病毒間操作臺收取病毒濃縮液,分裝病毒濃縮液至EP管中,-80℃冰箱長期保存。
1.3 線粒體鈣離子熒光探針巨噬細胞系構建
每皿1×106巨噬細胞iBMDM接種于直徑6 cm的培養皿中,在培養皿中加37℃預溫的DMEM培養基4 mL。細胞貼壁后加入4mt-GCaMP6慢病毒濃縮液100 mL,同時加入聚凝胺8 mmol·L-1終濃度。病毒感染36 h后加入嘌呤霉素2 mg·L-1終濃度,抗性篩選培養7 d,獲得穩定表達線粒體鈣離子熒光探針的細胞系iBMDM-4mt-GCaMP6。
1.4 觀測線粒體鈣離子iBMDM-4mt-GCaMP6熒光探針表達和共定位
將離子霉素抗性篩選7 d后的iBMDM-4mt-GCaMP6細胞用胰蛋白酶消化后,按每孔3×104細胞均勻接種于Lab-Tek八腔室中。待細胞完全貼壁并狀態良好時,用生理鹽水洗3次,去除原DMEM培養基。每孔加入Ringer緩沖液300 mL,緩沖液中含有200 nmol·L-1線粒體指示探針Mito-Tracker?Red FM。細胞培養箱中孵育30 min后,將Lab-Tek八腔室置激光共聚焦熒光顯微鏡下觀測,在波長488 nm的激發光下觀察iBMDM-4mt-GCaMP6細胞的線粒體鈣離子熒光探針發光強度和線粒體共定位。
1.5 離子霉素刺激下線粒體鈣離子動態成像
將穩定表達線粒體鈣離子熒光探針的iBMDM-4mt-GCaMP6細胞用胰蛋白酶消化后,按每孔3×104細胞均勻接種于Lab-Tek八腔室中。待細胞完全貼壁并狀態良好時,用生理鹽水洗3次去除原DMEM培養基,每孔加入預溫的Ringer緩沖液150 mL,置共聚焦熒光顯微鏡成像系統下,以每幀3 s的間隔預先拍攝30 s。提前用預溫的Ringer緩沖液稀釋離子霉素至目標濃度,拍攝第30秒時向觀測腔室快速滴加Ringer緩沖液150 μL,離子霉素終濃度 10 μmol·L-1,持續拍攝10 min。多孔拍攝結束后,使用Volocity軟件對實驗數據統計分析,每孔統計20個細胞(n=20)。
2 結果
2.1 慢病毒感染后線粒體鈣離子熒光探針在巨噬細胞iBMDM成功表達的鑒定
將線粒體鈣離子熒光探針4mt-GCaMP6慢病毒感染巨噬細胞iBMDM后,嘌呤霉素抗性篩選7 d,將具有嘌呤霉素抗性的細胞置于共聚焦熒光顯微鏡下觀測。在綠色熒光通道下可見細胞有明顯的綠色熒光,發出綠色熒光的部分為絲網狀結構,發光細胞率為100%(圖1)。共聚焦熒光顯微鏡觀測結果顯示,線粒體鈣離子熒光探針4mt-GCaMP6在巨噬細胞iBMDM中成功表達,表明iBMDM-4mt-GCaMP6細胞系構建成功。
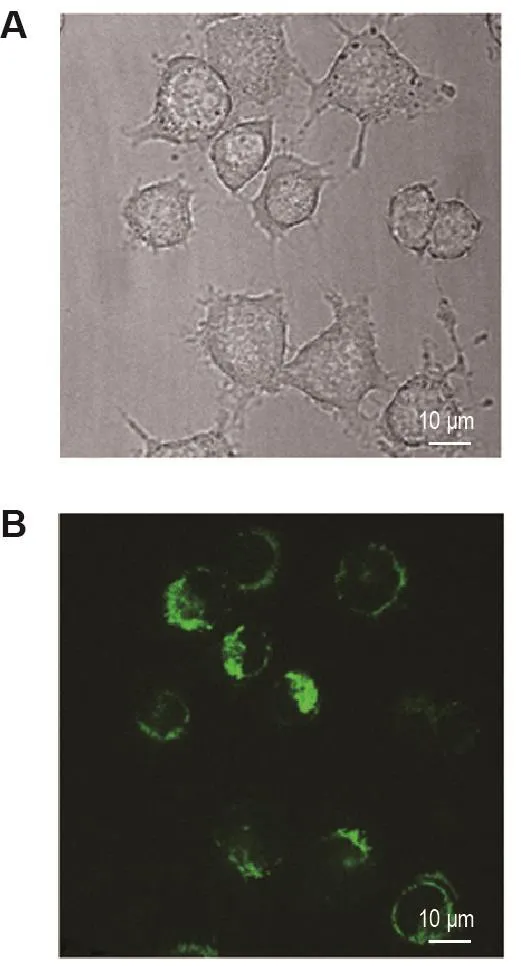
Fig.1 Expression of mitochondrial calcium probe 4mt-GCaMP6 in immortalized bone marrow-derived macrophages(iBMDM).A:cells were excited with bright field;B:cells were excited with 488 nm laser(green).
2.2 線粒體鈣離子探針和線粒體指示探針共定位一致
為進一步驗證iBMDM-4mt-GCaMP6細胞系能夠正確指征線粒體定位,使用線粒體指示染料Mito-Tracker?Red FM與iBMDM-4mt-GCaMP6細胞共孵育30 min。隨后用共聚焦熒光顯微鏡觀測,在綠色熒光通道下細胞中絲網狀結構發出綠色熒光(圖2A),在紅色熒光通道下Mito-Tracker?Red FM指征細胞線粒體為紅色熒光區域(圖2B),紅綠熒光通道同時打開時觀測到二者重合為黃色(圖2C)。使用Volocity軟件對紅綠熒光通道進行共定位分析,共定位系數為91.2%。線粒體指示探針Mito-Tracker?Red FM共定位實驗表明,構建的鈣離子熒光探針細胞iBMDM-4mt-GCaMP6可有效指示細胞線粒體內鈣離子。
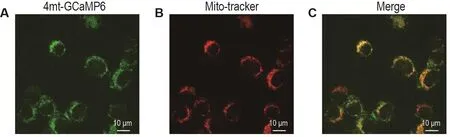
Fig.2 Co-localization of mitochondrial calcium fluorescent probe 4mt-GCaMP6 and mitochondrial indicator probe Mito-TrackerTMRed FM.A:mitochondrial calcium probe 4mt-GCaMP6 was excited with 488 nm laser(green);B:mitochondrial indicator probe Mito-Tracker? Red FM was excited with 561 nm laser(red);C:cells were excited with 488 and 561 nm laser.
2.3 離子霉素刺激后鈣離子熒光探針可指示巨噬細胞線粒體鈣流變化
由圖3所示,為驗證所構建的iBMDM-4mt-GCaMP6細胞能否響應刺激,指示細胞線粒體內鈣離子濃度變化,使用內質網鈣離子釋放劑離子霉素刺激細胞,在激光共聚焦熒光顯微鏡下動態觀測線粒體鈣離子濃度的變化。離子霉素是經典的內質網鈣離子釋放劑,可導致內質網鈣離子短時間內釋放到胞漿并進入到線粒體內,促使線粒體內鈣離子濃度增加。激光共聚焦熒光顯微鏡觀測結果顯示,iBMDM-4mt-GCaMP6細胞加入離子霉素10 μmol·L-1刺激后,線粒體內鈣離子濃度發生動態改變(圖3A),細胞內綠色熒光鈣離子信號在6~9 s內發生2倍的瞬時增強,在持續約45 s后逐漸回落到基礎水平(圖3B)。離子霉素響應實驗表明,構建的線粒體鈣離子熒光探針細胞iBMDM-4mt-GCaMP6可有效、準確地指示巨噬細胞線粒體鈣離子濃度的變化。

Fig.3 Transient increase of mitochondrial calcium fluorescence probe signal induced by ionomycin in macrophages.A:changes of mitochondrial calcium flow in cells before and after the addition of ionomycin;B:GCaMP6 fluorescence change which represents mitochondrial Ca2+alterations was calculated by F/F0,where F0 refers to the median value of the fluorescence signals during the baseline period(from 0 to 30 s).±s,n=20.
3 討論
線粒體是細胞的能量工廠,通過三羧酸循環及氧化磷酸化為細胞合成ATP。鈣離子能夠直接激活電子傳遞鏈上的一系列蛋白質的活性,如ATP合成酶等。鈣離子在線粒體內濃度的升高可促進線粒體ATP的產生,提供細胞增殖、運動和細胞因子分泌等各種生命活動所需要的能量[9]。
鈣穩態在細胞生理和病理生理中起關鍵作用,胞內鈣離子濃度持續升高可引發細胞死亡。線粒體鈣穩態的動態平衡,對于線粒體能量代謝、形態維持和氧化狀態的調節等具有重要意義[10]。近年來,鈣離子信號在免疫細胞功能調控中的作用受到關注。Vaeth等[11]發現,儲備型鈣離子內流、鈣調神經磷酸酶和活化T細胞的核因子,三者通過上調細胞糖酵解和氧化磷酸化來調控T細胞的活化和增殖。Vennekens 等[12]發現,瞬時受體電位通道 4(transient receptor potential melastain type 4,TRPM4)缺陷的肥大細胞脫顆粒能力增強并釋放更多組胺、白三烯和腫瘤壞死因子,并且TRPM4缺陷小鼠有更嚴重的免疫球蛋白E介導的急性皮膚過敏反應[12]。
鈣離子信號在巨噬細胞響應病原體刺激、吞噬及細胞因子分泌過程中的作用已有報道。Schappe等[13]發現,TRPM7介導的鈣離子內流是脂多糖誘導巨噬細胞激活所必需的,TRPM7缺陷的巨噬細胞在內毒素激活時不能分泌白細胞介素1β和其他關鍵的促炎細胞因子。Zumerle等[14]發現,細胞間由ATP介導的鈣離子信號可增強巨噬細胞的吞噬能力,但關于線粒體鈣離子信號在巨噬細胞中作用的研究還鮮見報道,原因可能主要是因為缺乏能夠明確指示線粒體鈣離子濃度變化的手段。
基因編碼的綠色熒光鈣離子探針GCaMP6通過在質粒的N端添加不同的定位序列,能夠將該探針靶向定位到質膜、線粒體以和內質網中,從而觀察不同細胞器內鈣離子的變化[15]。本研究中使用4mt-GCaMP6線粒體鈣離子熒光探針,在GCaMP6質粒中添加了線粒體定位序列4mt,從而靶向細胞中線粒體內鈣離子。Zhao等[8]使用線粒體鈣離子探針4mt-GCaMP6觀測細胞有絲分裂時線粒體鈣離子動態變化,揭示了線粒體對急性細胞能量應激的代謝適應機制。Wang等[16]使用線粒體基質鈣離子探針mt-GCaMP6s觀測卵母細胞成熟和激活過程中線粒體鈣離子動態變化,證明線粒體鈣離子對卵母細胞激活的重要性。
綜上所述,本研究使用可視化的定位線粒體鈣離子的基因編輯探針4mt-GCaMP6,使用慢病毒感染方式構建了可視化觀測線粒體鈣離子濃度變化的巨噬細胞系iBMDM-4mt-GCaMP6。該工具細胞的成功構建,該工具細胞的成功構建,為后續研究巨噬細胞吞噬或殺傷病原體及發揮抗原遞呈等生物學功能時線粒體鈣離子濃度的變化,以及不同極化狀態時的特征、作用和相關調控機制等提供了有利工具。

