肥胖型多囊卵巢綜合征的氧化應激與脂代謝關系的研究
王虎生 阮祥燕* 程姣姣 Alfred O. Mueck ,2
(1. 首都醫科大學附屬北京婦產醫院內分泌科,北京 100026;2. 德國圖賓根大學婦產醫院婦女健康部與婦女健康研究中心,圖賓根 D-72076)
多囊卵巢綜合征(polycystic ovary syndrome, PCOS)是育齡期女性無排卵性不孕的最常見病因,根據2003年鹿特丹診斷標準[1],全球PCOS患病率為6%~21%[2],臨床表現以稀發排卵或持續無排卵、雄激素過高的臨床或生化表現、卵巢多囊樣改變為特征,常伴有肥胖、血脂紊亂、胰島素抵抗等代謝異常,是常見的生殖內分泌代謝性疾病,嚴重影響患者的生命質量、生育及遠期健康[3]。
PCOS的病因和發病機制尚不十分清楚,目前研究[4]顯示,其可能是由于某些遺傳基因與環境因素相互作用所致。因此探索PCOS的發病機制仍然是醫務科研工作者需要解決的難題。近期有文獻[5]報道,氧化應激在PCOS的發展過程中起決定性作用,但具體的發病機制仍不清楚。因PCOS與代謝綜合征有很多共同之處且相互影響,且PCOS患者中代謝綜合征的患病率較非PCOS患者可增加3倍[6],前期研究[7]顯示,合并代謝綜合征的PCOS患者機體抗氧化能力會降低,且與三酰甘油(triglyceride,TG)及高密度脂蛋白膽固醇(high density lipoprotein-cholesterol, HDL-C)升高相關,代謝綜合征可能加速PCOS的氧化應激進展過程。肥胖是代謝綜合征重要的組成部分,也是多囊卵巢綜合征的主要危險因素,同時PCOS患者似乎有更高的肥胖風險,二者之間可能存在多種潛在的相互作用機制[8-9],近期研究[10-11]提示,氧化應激是肥胖與相關并發癥的聯系樞紐。而國內關于肥胖型PCOS患者氧化應激的研究受限,鑒于此背景,本研究旨在探討肥胖型PCOS患者氧化應激程度及其與脂代謝的關系,將有利于進一步闡明PCOS的發病機制,協助PCOS的診斷、早期預防及臨床治療。
1 對象與方法
1.1 研究對象
本研究選取2018年8月至2018年11月就診于首都醫科大學附屬北京婦產醫院內分泌科被確診為PCOS的130例患者作為研究組,年齡21~40歲。根據我國《中國成人超重和肥胖癥預防與控制指南》[12]的定義,以體質量指數(body mass index, BMI)為標準, 18.5 kg/m2≤BMI<24 kg/m為體質量正常,24 kg/m2≤BMI<28 kg/m2為超重,BMI≥28 kg/m2為肥胖,將PCOS患者分為3組,正常體質量PCOS組(G2,45例)、超重PCOS組(G3,42例)、肥胖PCOS組(G4,43例)。同時選取40例因女方輸卵管因素或男方因素而不孕或正常體檢的正常體質量的健康育齡女性(月經規律,無多毛、黑棘皮癥、痤瘡等高雄激素體征,基礎內分泌檢查正常,陰道B超檢查示子宮和雙側卵巢均無明顯異常)作為正常體質量對照組(G1)。所有患者均充分知情并自愿參加本研究。
納入標準依據 2003 年美國生殖醫學會(American Society for Reproductive Medicine, ASRM) 和歐洲人類生殖與胚胎學會(European Society of Human Reproductive and Embryology, ESHRE) 提出的 PCOS 鹿特丹診斷標準[1]:① 稀發排卵或無排卵(oligo-anovulation, OA);②高雄激素血癥(hyperandrogenism, HA) 或高雄激素的臨床表現(如多毛、痤瘡等);③卵巢多囊樣改變(polycystic ovary, PCO),即單側卵巢內直徑 2~9 mm 的卵泡≥12個或卵巢體積>10 mL。上述3條中符合2條即診斷為 PCOS。
排除標準:①所有患者3個月內有激素類藥物治療史;②心肝腎功能異常;③妊娠;④既往服用降糖藥物、降壓藥物、抗血小板聚集藥物等任何可能影響機體氧化應激狀態的藥物。同時需排除甲狀腺疾病、庫欣綜合征、高泌乳素血癥、非典型先天性腎上腺增生、分泌雄激素腫瘤等其他引起內分泌紊亂的相關性疾病。
1.2 測量指標
1) 一般指標:年齡、腰圍、BMI=體質量(kg)/身高2(m2) 。
2) 內分泌代謝指標:卵泡刺激素(follicle stimulating hormone, FSH)、黃體生成素(luteinizing hormone, LH)、睪酮(testosterone, TT)、TG、總膽固醇(total cholesterol, TC)、HDL-C、低密度脂蛋白膽固醇(low density lipoprotein-cholesterol, LDL-C)。采血時間:月經規律者取月經第3~5天,無規律者或閉經者任意時間。
3) 血清學指標的測定:患者均充分睡眠,于早晨8:00~10:00 空腹肘靜脈采血。內分泌代謝指標的測定采用美國拜耳公司生產的 Centaur 全自動化學發光免疫分析儀。另抽取靜脈血2 mL,于室溫狀態下靜置10~20 min,使血液自然凝固。然后將樣本以3 000 r/min 的速度離心約10 min,仔細收集上層血清,暫凍存于-20 ℃低溫冰箱中。通過南京建成生物工程研究所試劑盒比色法測定抗氧化指標如總抗氧化活性(total antioxidant activity, TAA)、超氧化物歧化酶(superoxide dismutase, SOD)、丙二醛(malondialdehyde, MDA)、維生素E(vitamin E, VE)、武漢優爾生試劑盒ELISA法測定視黃醇(retinol, RET)。
1. 3 統計學方法
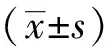
2 結果
2.1 各組人體測量學和內分泌代謝指標的比較
4組的人體測量學指標及內分泌代謝指標比較,除FSH外,其余各人體測量學指標及激素代謝指標差異均有統計學意義(P<0.05)。其中3組PCOS患者的LH、TT均高于正常體質量對照組,肥胖PCOS組(G4)的BMI、WC、LDL-C均明顯高于其他3組,TC、TG均明顯高于正常體質量對照組(G1)及正常體質量PCOS(G2)組,而HDL-C明顯低于正常對照組(G1)及正常體質量PCOS組(G2)(P<0.05)。肥胖PCOS組(G4)的TC、TG、LH、HDL-C及TT與超重PCOS(G3)組相比差異無統計學意義(P>0.05),詳見表1。

表1 各組人體測量學指標及內分泌代謝指標的比較
2.2 各組氧化應激指標的比較
研究結果顯示,3組PCOS患者的MDA均明顯高于正常體質量對照組(P<0.05),而在3組PCOS患者中,肥胖PCOS組的MDA明顯高于其他兩組,超重PCOS組次之,正常體質量PCOS組最低(P<0.05)。3組PCOS患者的SOD、RET均明顯低于正常體質量對照組,其中肥胖PCOS組與超重PCOS組的SOD、RET明顯低于正常體質量PCOS組,而肥胖PCOS組的SOD及RET與超重PCOS組相比差異無統計學意義。肥胖PCOS組與超重PCOS組的TAA與VE均明顯低于正常體質量對照組(P<0.05),而正常體質量PCOS組的TAA、VE與正常體質量對照組相比差異無統計學意義(P>0.05),詳見表2。

表2 各組氧化應激指標的比較
2.3 各氧化應激指標與人體測量學及代謝指標的相關分析
將各氧化應激指標與所有研究對象的人體測量學指標及代謝指標行相關分析,結果顯示,各氧化應激指標與年齡無明顯相關性,而氧化指標MDA與BMI、TC、TG呈正相關(P<0.05),而抗氧化指標SOD及RET與BMI、腰圍、TC、TG、LDL-C均呈負相關(P<0.05);TAA與BMI、腰圍、TG呈負相關(P<0.05);VE與腰圍呈負相關(P<0.05),詳見表3。

表3 各氧化應激指標與人體測量學及代謝指標相關分析Tab.3 Correlation analysis between oxidative stress indexes and anthropometric and metabolic indicators in the groups
2.4 線性回歸分析各人體測量學指標及激素代謝指標與各氧化應激指標的關系
將本研究的分組以及表1的混雜因素作為自變量(除外腰圍),各氧化應激指標作為因變量,做線性回歸,分析結果顯示各氧化應激指標均不受年齡(可能是本研究的混雜因素)影響。其中MDA、RET及VE均受分組變量影響,MDA隨著本研究BMI分組的遞增而升高,回歸系數為0.214(P=0.005),RET與VE均隨著本研究BMI分組的遞增而降低,回歸系數分別為-0.243(P=0.001)、-0.174 (P=0.023)。而SOD及TAA均隨著TG的增加而降低,回歸系數分別為-0.411(P<0.001)、-0.269(P<0.001)。詳見表4。

表4 線性回歸分析各人體測量學指標及激素代謝指標與各氧化應激指標的關系Tab.4 Association of important independent variables with serum oxidative stress indicators by linear regression analysis in the subjects
3 討論
本研究氧化指標選取反映機體氧化能力具有代表性的MDA,而抗氧化指標選取了SOD、TAA、VE、RET。結果顯示,肥胖型PCOS組的氧化應激水平最高,超重及肥胖型PCOS的抗氧化能力均低于正常體質量PCOS組及正常體質量對照組。線性回歸分析MDA、TAA均受分組影響,MDA隨著本研究BMI分組的遞增而升高,RET隨著本研究BMI分組的遞增而降低。而TG對SOD、TAA影響明顯,SOD及TAA均隨著TG的增加而降低,回歸系數分別為-0.411(P=0.000)、-0.269(P=0.000)。
肥胖是由于脂肪過度堆積引起的一種嚴重營養問題,最新研究[13]證實,隨著全球經濟增長和營養模式的變化,食物的過多攝入,久坐的生活方式以及缺乏身體鍛煉,全球BMI值仍在持續增長。顯然肥胖已成為一個全球關注的公共衛生問題,世界衛生組織(World Health Organization,WHO)已經將肥胖定義成一種疾病,更將肥胖認定為糖尿病、高血壓、心腦血管疾病等慢性疾病的重要危險因素。而PCOS患者似乎有更高的肥胖風險[9],是超重和肥胖女性最常見的代謝性疾病,肥胖是PCOS的主要危險因素,是患PCOS的女性最常見的合并癥,尤其腹型肥胖患者是 PCOS代謝合并癥發生的主要原因,二者之間可能存在多種潛在的機制。近期研究[10-11]提示,氧化應激是肥胖與相關并發癥的聯系樞紐。國內關于肥胖型PCOS氧化應激的研究有限。國外研究[14]報道,肥胖與PCOS患者的氧化應激有直接關系。
氧化應激是機體在正常生理狀態下處于動態平衡的氧化與抗氧化系統失衡,機體傾向于氧化狀態時,過多的自由基使機體處于一種應激狀態,對機體產生氧化損傷,最終引起細胞的死亡或凋亡、組織損傷及疾病發生。近期有文獻[5]報道氧化應激在PCOS的發展過程中起決定性作用。本研究選取的MDA是一種常見的脂質過氧化物,也是反映PCOS患者氧化應激水平較好的代表性指標[15]。一項薈萃分析[16]中PCOS患者的MDA較對照組平均增加了47%。本團隊前期研究[17]結果也觀察到PCOS患者的MDA明顯高于對照組,并且合并代謝綜合征的PCOS患者其MDA高于非代謝綜合征的PCOS患者及對照組[7]。而肥胖是代謝綜合征的重要組成部分,本研究顯示,肥胖型PCOS的MDA最高,且線性回歸分析進一步證實PCOS氧化能力隨著本研究BMI分組的遞增而增加,提示肥胖型PCOS患者的氧化應激損傷較非肥胖PCOS患者及正常體質量對照組更嚴重。進一步得出氧化應激在肥胖型PCOS發病中的作用更明顯,而體質量增加是導致PCOS患者血脂異常、氧化應激及慢性炎癥發生的常見因素,肥胖又與體內高氧化應激狀態密切相關[18],Chen等的研究[14]也提示腹型肥胖可以加重PCOS患者脂肪組織的氧化損傷,而氧化應激又引起細胞損傷,導致脂肪細胞分泌細胞因子功能失調,脂肪堆積,引發、加重肥胖。所以氧化應激與肥胖交互作用相互影響,這種惡性循環在肥胖型PCOS患者中更為明顯,因此臨床上才會有研究[19]報道降低體質量>5%就能改變或減輕月經紊亂,有利于恢復排卵及生育功能,可能原因是肥胖得到控制,氧化應激損傷就相應減輕,卵泡的損傷得到修復,從而最終恢復正常的排卵功能。
TAA是代表破壞自由基能力的抗氧化指標,SOD是有效保護機體免受活性氧損害的抗氧化指標,VE、RET均為體內非酶性抗氧化劑。一項研究[20]報道PCOS的SOD明顯低于對照組,提示SOD可能是決定PCOS氧化應激的有效臨床指標。另外有研究[21]報道PCOS的TAA、VE明顯降低,本研究顯示,超重及肥胖型PCOS的SOD、RET均低于正常體質量PCOS及正常體質量對照組,超重及肥胖型PCOS的TAA、VE均低于正常體質量對照組,這提示超重及肥胖型PCOS的抗氧化能力較正常體質量PCOS及正常體質量對照組明顯下降,且線性回歸分析進一步證實,隨著本研究BMI分組及TG的遞增,抗氧化能力降低,TG是代謝綜合征的重要組成成分,本團隊前期研究[7]顯示,TG對PCOS合并代謝綜合征患者的氧化應激影響明顯,隨著TG的增加,機體抗氧化能力降低,而肥胖可加重PCOS患者代謝綜合征的發生[22],且有研究[23]已證實肥胖患者體內的脂肪酸對引起三酰甘油的增加并最終導致高脂血癥有一定的作用,因此肥胖成為代謝綜合征的先決條件[24],所以推測肥胖也可能是通過引起血脂異常引起機體抗氧化能力的降低。
綜上所述,肥胖型PCOS患者的氧化能力明顯升高而抗氧化能力明顯降低,提示氧化應激在肥胖型PCOS發病中的作用更明顯,肥胖型PCOS患者抗氧化能力的降低與三酰甘油升高相關,提示肥胖可能通過脂代謝紊亂加重PCOS患者的氧化應激過程。

