高產酸扣囊復膜酵母的篩選與培養基配方優化
張宸瑞,高瑞杰,繆禮鴻*,劉蒲臨,廖衛芳
(武漢輕工大學 生命科學與技術學院,湖北 武漢 430000)
米酒因其獨特的風味及口感受到廣大消費者青睞。酒曲是決定米酒品質的關鍵因素之一。酒曲內微生物的相互作用不僅生成了酒體內醇、醛、酸等物質,也是有機酸的重要來源。有機酸的組成比例及類型對米酒的品質有很大影響,SHEN F等[1]采用液相色譜對米酒進行了測定,發現米酒中的有機酸包括草酸、乙酸、乳酸、蘋果酸、琥珀酸、檸檬酸和酒石酸等。其中乙酸屬于揮發性酸,是賦予酒體有醇厚感的主要物質,使酒體溫和,具有酸快爽味;而乳酸在酒體中會讓其稍有澀感,酸味尖利[2]。此外,有機酸也是生成酯類的重要前驅物質[3],閆華文等[4]對6種不同地區的米酒酒曲進行分析,在其中4種酒曲中發現了扣囊復膜酵母(Saccharomycopsis fibuligera)。李靜心等[5]研究表明,扣囊復膜酵母在白酒高溫大曲真菌組成中占25.66%。扣囊復膜酵母(S.fibuligera)是多種酒曲和酒醅中的主要酵母菌之一[6-7]。具有產有機酸、醇類、酯類和水解淀粉等多種能力[8-10]。吳健等[11]比較了扣囊復膜酵母(S.fibuligera)、畢赤酵母、釀酒酵母等4種酵母菌在米曲汁培養基中發酵產酸能力,結果表明扣囊復膜酵母(S.fibuligera)產總酸能力最強達3.57 g/L,且具有一定的產淀粉酶能力。鑒于扣囊復膜酵母(S.fibuligera)在酒曲中具有一定優勢,并對酒體品質具有促進作用,因此,可以將其制備成菌劑提高酒體質量。黃芳等[12]的研究表明,使用糖蜜作為培養基碳源,也能提升酵母菌的數量。孫思佳等[13]采用響應面法對扣囊復膜酵母(S.fibuligera)培養基進行了優化,以OD600nm值計算的酵母菌的生物量提高了170%。
本研究采用平板分離方法,從不同來源的米酒及黃酒曲中分離篩選產酸酵母菌株,采用分子生物學法對其進行鑒定,比較測定了不同菌株的總酸產量和耐受性差異,并通過培養基的優化提高產酸酵母菌株液態發酵總菌數,為該菌種的開發應用奠定基礎。
1 材料與方法
1.1 材料與試劑
1.1.1 酒曲及材料來源
10種酒曲[湖北房縣任氏米酒曲(R)、湖北房縣元氏黃酒曲(Y)、湖北房縣黃酒曲(7#)、湖北孝感孝南區米酒曲(3#)、湖北孝感某廠區米酒曲(YL、H、F)、湖北廣水米酒曲(GS)、四川達州大竹縣華聯米酒曲(5#)、四川達州大竹縣石河鎮米酒曲(6#)],用無菌密封袋保存。糯米:市售,經粉碎機磨碎后過40目篩后備用。
1.1.2 試劑
α-淀粉酶(3×104U/mL)、耐高溫糖化酶(1×105U/mL):棗莊杰諾生物酶有限公司;2×F8 FastLong聚合酶鏈式反應(polymerase chain reaction,PCR)MasterMix,北京艾德萊生物科技有限公司;寶生物工程(大連)有限公司;PCR引物、基因組脫氧核糖核酸(deoxyribonucleic acid,DNA)抽提試劑盒:生工生物工程(上海)股份有限公司;酵母膏、蛋白胨:安琪酵母有限公司;葡萄糖、乳酸、無水乙醇、異丙醇、可溶性淀粉、蔗糖、乳糖、甲醛溶液(36%):國藥集團化學試劑有限公司;3,5-二硝基水楊酸(dinitrosalicylic acid,DNS):北京索萊寶科技有限公司;β-巰基乙醇:上海試劑四分廠;牛肉膏:北京奧博星生物試劑公司;以上試劑均為分析純或生化試劑。
1.1.3 培養基
糯米糖化液發酵培養基:糯米粉與水按料液比1∶3(g∶mL)混合,混勻后按15 U/g干料添加α-淀粉酶,于95 ℃水浴鍋中處理90 min,然后冷卻后再按150 U/g干料添加糖化酶,于65 ℃水浴鍋中處理30 min,期間需不斷攪拌,分裝好后115 ℃滅菌30 min。
酵母浸出粉胨葡萄糖(yeastextractpeptonedextrose,YPD)培養基[9]:葡萄糖20 g/L,酵母膏10 g/L,蛋白胨20 g/L,蒸餾水1 000 mL;YPD固體培養基添加2%瓊脂粉,培養基115 ℃滅菌30 min。
馬丁孟加拉紅-鏈霉素培養基[14]:葡萄糖10 g/L、蛋白胨5g/L、KH2PO41g/L、MgSO4·7H2O0.5g/L、孟加拉紅33.4mg/L、鏈霉素30 μg/mL,121 ℃滅菌20 min。
1.2 儀器與設備
ZHJH-C1115B超凈工作臺、ZXDP-A2160恒溫培養箱、ZHWY-2102搖床:上海智城科技有限公司;T-Gradient 聚合酶鏈式反應儀:德國Biometra公司;SYDR/1305凝膠成像儀:美國Syngene公司;7890A氣相色譜儀:美國安捷倫公司;UV-5900PC紫外可見分光光度計:上海元析儀器有限公司;WH-3渦旋振蕩儀:上海滬西分析儀器廠有限公司;ST2100E pH計:奧豪斯國際貿易(上海)有限公司;78-1磁力加熱攪拌器:國華(常州)儀器制造有限公司;Centrifuge 5424小型臺式高速離心機:德國Eppendorf公司;YXQ-LS-50Sll立式壓力蒸汽滅菌鍋:上海博訊實業有限公司醫療設備廠。
1.3 實驗方法
1.3.1 酵母菌株的分離及鑒定
(1)菌株分離方法及總基因組抽提方法
稱取酒曲10 g添加到90 mL無菌水中,30 ℃、170 r/min搖床振蕩1 h使其混勻。樣品梯度稀釋(10-2、10-3、10-4),涂布孟加拉紅培養基上,30 ℃靜置培養1~2 d后挑取形態不同的單菌落,多次在YPD平板上劃線純化,獲得純培養的菌株。取純化后的菌株,挑取單菌落接種于YPD培養基中,30 ℃、170 r/min恒溫搖床內培養24 h,用Ezup柱式酵母基因組DNA抽提試劑盒提取DNA,完成后置于-20 ℃冰箱中保存備用。
(2)26S rDNA PCR擴增及測序[15]
PCR擴增26S rDNA,酵母26S rDNA正向引物NL1:5'-GCATATCAATAAGCGGAGGAAAAG-3';反向引物NL4:5'-GGTCCGTGTTTCAAGACGG-3'。
PCR擴增體系:25 μL 2×F8 FastLong PCR MasterMix、22 μL三蒸水、1 μL正向引物、1 μL反向引物、1 μL提取出的酵母DNA模板。
PCR擴增程序:94 ℃預變性5 min;94 ℃變性30 s,54 ℃退火30 s,72 ℃延伸60 s,循環33 次;72 ℃延伸10 min。PCR產物經瓊脂糖凝膠電泳檢測,送至蘇州金唯智生物科技有限公司進行測序。
(3)測序結果分析及菌種鑒定[16-17]
測序結果采DNAStar軟件人工校對,校正序列在美國國家生物技術信息中心(national center for biotechnology in formation,NCBI)的GenBank數據庫中進行同源序列搜索,采用MEGA 5.2軟件中的鄰接(neighbor-joining,NJ)法,1 000次Bootstrap檢驗構建系統發育樹。
1.3.2 篩選菌株的發酵能力
酵母菌種子液的制備:在YPD平板上挑取單菌菌落,接種于YPD液體(培養基pH 5.89,下同)培養基中,30 ℃、170 r/min搖床培養24 h,得一級種子液。按1%接種YPD液體培養基,28 ℃、170 r/min搖床培養12 h,得到二級種子液。
將篩選的酵母菌的二級種子液接種至糯米糖化液中,搖勻后放入28 ℃培養箱內靜置培養7 d,取樣測定總酸和殘糖含量。
1.3.3 分析檢測
發酵液經蒸餾后總酸含量測定按照國標GB/T 13662—2018《黃酒》中的氣相色譜法[18],氣相色譜檢測條件:分流比為20∶1,氫氣(H2)流速為30 mL/min,空氣流速為400 mL/min,N2流速為25 mL/min,柱溫60 ℃,維持5 min,再以10 ℃/min升溫至160 ℃,維持5 min。檢測器溫度200 ℃,進樣口溫度220 ℃,總運行時間20 min。以上發酵液均做3組平行樣;殘糖含量的測定采用DNS法[19];pH值采用pH計測定;酵母菌總數使用血球計數板計數法計數[14]。
1.3.4 篩選菌株耐受性比較
(1)耐溫能力測定
分裝裝瓶量30 mL/100 mL的YPD培養基,按2%體積比接種二級種子液,將其分別在24 ℃、27 ℃、30 ℃、33 ℃、36 ℃、39 ℃、42 ℃、45 ℃條件下170 r/min搖床培養20 h后取出。稀釋一定倍數后測定OD600nm值。
(2)耐酸能力測定
分裝裝瓶量30 mL/100 mL的YPD培養基,將其pH分別調至3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0。按2%體積比接種二級種子液,在30 ℃、170 r/min搖床培養20 h后取出測定OD600nm值。
(3)耐酒精能力測定
二級種子液按2%體積比接種至不同體積分數乙醇(2%、4%、6%、8%、10%)YPD培養基中,在30 ℃、170 r/min搖床培養20 h后取出測定OD600nm值。
1.3.5 培養基配方優化
單因素試驗:以YPD液體培養基為對照,在其培養基配方基礎上對碳源(10 g/L糖蜜、蔗糖、葡萄糖、乳糖、可溶性淀粉)及氮源(10 g/L(NH4)2SO4、大豆蛋白胨、蛋白胨)進行優化。
響應面試驗:以菌株3-1生長量(Y)為響應值,糖蜜(A)、葡萄糖(B)、大豆蛋白胨(C)及酵母浸出粉(D)添加量為影響因子,進行Box-Behnken試驗設計,采用Design Expert 8.0.6.1軟件預測最佳培養基組分及濃度。
2 結果與分析
2.1 不同米酒曲樣品酵母菌的分離與鑒定結果
從10個酒曲樣品中共分離獲得31株酵母,其系統發育樹見圖1,鑒定結果見表1。由表1可知,共獲得7個屬的7種酵母菌,扣囊復膜孢酵母(Saccharomycopsis fibuligera)6株,Cyberlindnera fabianii共5株,釀酒酵母(Saccharomyces cerevisiae)8株,熱帶假絲酵母(Candida tropicalis)5株,異常威克漢姆酵母(Wickerhamomyces anomalus)5株,庫德畢赤酵母(Pichia kudriavzevii)和葡萄牙棒孢酵母(Clavispora lusitaniae)各1株。扣囊復膜孢酵母在6個米酒曲樣品中均有出現,說明扣囊復膜孢酵母廣泛存在于多種不同地域來源的米酒曲中。W.anomalus與C.fabianii出現的頻率也較高,在4種酒曲中均有出現。W.anomalus是米酒發酵的另一種常見生香酵母[20],除P.kudriavzevii和C.lusitaniae外,其余酵母均在不同酒曲中多次出現。與釀酒酵母相比,扣囊復膜酵母較強的產酸能力可能與丙酮酸轉化為乙醇的效率較低有關,且扣囊復膜酵母可產生大量液態氨基酸[21]。對提高米酒風味及品質有至關重要的作用,故選6株扣囊復膜酵母進行下一步試驗。

表1 酵母分離與鑒定結果Table 1 Isolation and identification results of yeasts
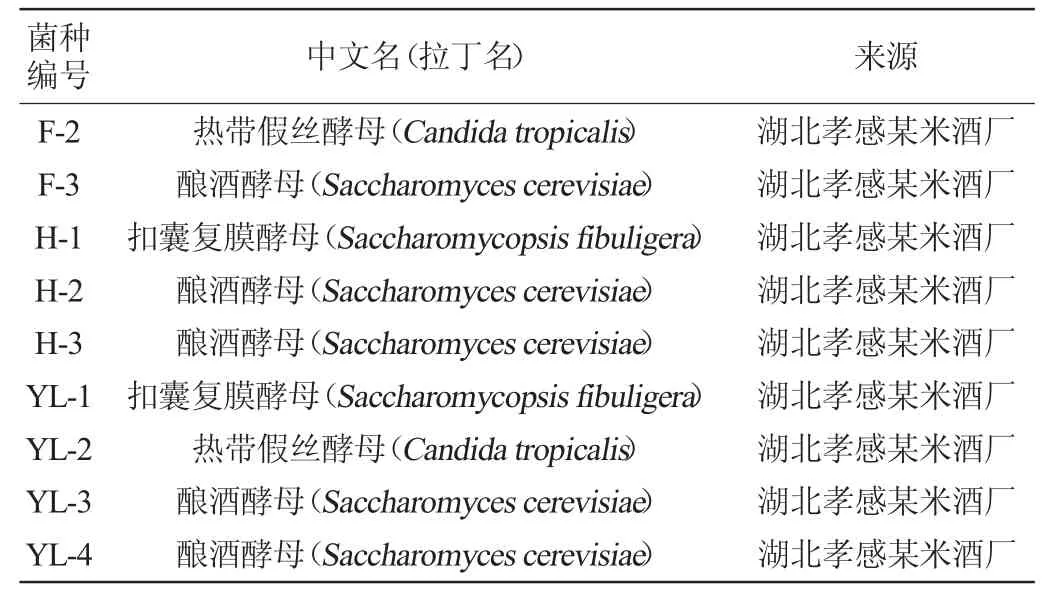
續表

圖1 基于26S rDNA D1/D2區域序列酒曲來源的酵母菌的系統發育樹Fig.1 Phylogenetic tree of yeasts isolated from Jiuqu based on 26S rDNA D1/D2 region alignment
2.2 不同扣囊復膜孢酵母菌株發酵特性及產酸能力比較結果
由表2可知,扣囊復膜酵母不同菌株之間產總酸、酒精和乙酸乙酯等能力差異較大。經測定,糯米糖化液初始還原糖含量為140 g/L,pH 5.9。殘糖值越低,說明發酵過程越徹底,而pH下降幅越大則表示該株酵母產酸能力越強。扣囊復膜酵母不同菌株之間乙酸乙酯產量相差絕對值達到29.86 mg/L,乙醇產量相差絕對值最高可達6.11%vol,正丙醇產量絕對值達到48.88 mg/L,殘糖含量之間差值達到31.3 g/L。pH值總體差距較小,而總酸與pH呈正相關,pH值越低的菌株,其總酸含量越高。在這些菌株中,菌株3-1的產酸和產乙酸乙酯、正丙醇能力最強,且最終發酵液pH值為2.89,在所有菌株中降幅最大。其總酸含量達5.40 g/L,乙酸乙酯產量達33.07 mg/L,正丙醇產量為84.33 mg/L。

表2 不同扣囊復膜酵母菌株的發酵蒸餾液總酸、殘糖及揮發成分測定結果Table 2 Determination results of total acid,residual sugar and volatile compounds in fermentation distillate of different Saccharomycopsis fibuligera strains
2.3 扣囊復膜酵母不同菌株的耐受性比較結果
不同扣囊復膜酵母的溫度、pH及酒精耐受性比較結果見圖2。

圖2 不同扣囊復膜酵母菌株的溫度(a)、pH(b)及乙醇(c)耐受性比較Fig.2 Comparison of temperature (a),pH (b) and alcohol (c) tolerance among different Saccharomycopsis fibuligera strains
由圖2a可知,所分離扣囊復膜酵母生長溫度范圍基本一致,不同菌株的最適生長溫度區間為28~32 ℃。當溫度高于36 ℃之后,所有菌株的生長均受到明顯抑制。結果表明,其中菌株3-1的耐熱性最好,在45 ℃培養時其OD600nm值仍達0.64,這可能與菌株的特性或發酵液中還未利用完全的殘糖具有的熱保護劑作用有關[22]。由圖2b可知,扣囊復膜酵母在pH較低的條件下生長情況較差,當pH5.5時,扣囊復膜酵母生長情況均開始受到不同程度的抑制。pH 6.0時不同菌株的生長量均達最大。當pH繼續上升,扣囊復膜酵母的生長情況均受到不同情況的抑制,菌株3-1的在pH6.0時,生長量在所有菌株中最高。由圖2c可知,扣囊復膜酵母不同菌株的耐乙醇生長能力具有一定差異。在乙醇含量為0~4%時,對扣囊復膜酵母的生長影響不大;當乙醇含量達6%時,多數菌株的生長均受到明顯抑制,但對菌株3-1的生長影響較小。隨著乙醇濃度的繼續上升,扣囊復膜酵母生長情況受到進一步抑制,當乙醇含量達到10%時,所有菌株基本上均不生長。高濃度的乙醇對酵母具有毒害作用,使得酵母喪失正常的生理功能[23],編號3-1的酵母在2%~10%的生長量均為最高,耐受性較好。
根據以上試驗結果,扣囊復膜酵母3-1菌株的總酸產量最高,綜合耐受性最好,故將其選為培養基優化的試驗菌株。
2.4 菌株3-1培養基優化
2.4.1 單因素試驗
由圖3a可知,菌株3-1在糖蜜培養基中的生物量最高,其原因可能是因為糖蜜中含有一定的可發酵性氮、多種維生素及礦物質,這些物質在酵母生長過程中均可被利用,并促進酵母生長[24]。由圖3b可知,使用大豆蛋白胨和普通蛋白胨的培養基中菌株3-1的生物量最高,而硫酸銨作氮源時其生物量最低。兩種蛋白胨對扣囊復膜酵母的生長量沒有明顯差異。

圖3 不同碳源(a)及氮源(b)對菌株3-1生長的影響Fig.3 Effect of different carbon sources (a) and nitrogen sources (b) on strain 3-1 growth
2.4.2 Box-Behnken響應面優化試驗
王瑤等[25]的研究表明,糖蜜與葡萄糖按3∶7的比例混合添加可以使成本降低的同時發酵產物的量得到一定的提升。所以本研究以菌株3-1生長量(Y)為響應值,糖蜜(A)、葡萄糖(B)、大豆蛋白胨(C)及酵母浸出粉(D)添加量為影響因子,進行Box-Behnken試驗設計。Box-Behnken試驗設計及結果見表3,方差分析見表4。

表3 Box-Behnken試驗設計及結果Table 3 Design and results of Box-Behnken experiments

表4 回歸模型方差分析Table 4 Variance analysis of regression model

續表
對表3數據進行擬合分析,得到回歸方程為Y=0.81+0.089A+0.093B+0.042C+0.044D-0.055AB-0.014AC+0.03AD+0.029BC+0.039BD-0.058CD-0.15A2-0.16B2-0.14C2-0.19D2
由表4及圖4可知,模型的P值<0.000 1,表明極顯著,失擬項P值=0.179 9>0.05,表明受未知因素影響較小,可以用此模型對菌株3-1生長進行分析和預測。回歸方程的決定系數R2=0.960 5,校正決定系數R2adj=0.921 2,表明該模型擬合度較好。對菌株3-1生長影響順序為葡萄糖(B)>糖蜜(A)>酵母浸粉(C)>大豆蛋白胨(D)。一次項A、B、C、D,二次項A2、B2、C2、D2對結果影響極顯著(P<0.01),交互項AB、CD對結果影響顯著(P<0.05)。

圖4 各因素對菌株3-1生長影響的響應面及等高線Fig.4 Response surface plots and contour lines of effects of interaction between each factors on strain 3-1 growth
通過Design Expert 8.0.6.1軟件對回歸方程求解,預測最佳培養基配方為:糖蜜添加量7.54 g/L,葡萄糖添加量7.68g/L,大豆蛋白胨添加量1.71g/L,酵母浸粉添加量1.71g/L。在此優化條件,OD600nm值理論值為0.842。為了便于實際操作,將最佳培養基配方修正為糖蜜添加量7.5 g/L,葡萄糖添加量7.7 g/L,大豆蛋白胨添加量1.7 g/L,酵母浸粉添加量1.7 g/L。在此優化條件下進行3次驗證試驗,OD600nm值實際值為0.839±0.07,與預測值基本一致。說明該回歸方程對菌株3-1生長量的分析和預測是可信的。優化后的培養基酵母總數達2.45×108個/mL,與對照培養基相比,酵母菌總數提升了63%。
3 結論
本研究從不同地域來源的多種米酒曲和黃酒曲樣品中共分離和鑒定了31株酵母菌,其中扣囊復膜酵母是米酒曲中的主要酵母菌之一。通過試驗比較測定了6株不同扣囊復膜酵母菌株的產酸能力和對溫度及乙醇等耐受性,篩選獲得了1株產總酸能力強、耐受性好的扣囊復膜酵母菌株3-1。在單因素試驗的基礎上,采用響應面法對扣囊復膜酵母3-1培養基進行優化,建立了合理可靠的二次多項模型,模型與試驗數據擬合度較高。優化后的培養基配方為糖蜜7.5 g/L,葡萄糖7.7 g/L,大豆蛋白胨1.7 g/L,酵母浸粉1.7 g/L。在此優化條件下,扣囊復膜酵母菌株3-1總菌數達2.45×108個/mL,比YPD液體培養基的酵母菌總數提升了63%。本研究將為扣囊復膜酵母在米酒強化曲的制備與成品米酒總酸含量優化等方面的應用提供基礎。

