sncRNAs調控植入前胚胎母源因子降解機制的研究進展
邵靜,許保增
(中國農業科學院特產研究所,吉林 長春 130112)
精子和卵子結合形成的受精卵拉開了早期胚胎發育的序幕,可是只有當胚胎真正繼承了雙親的遺傳物質,生命才算正式開始,這一刻被稱為合子基因組激活(zygotic genome activation,ZGA)。ZGA是胚胎著床前的關鍵時期,也是決定胚胎能否繼續發育的重要階段,甚至影響到原腸胚的形成和早期胚胎分化[1]。受精卵發育的第一步就是將兩個終末分化的配子重新編程為全能胚胎[2]。但是在受精早期,雌、雄原核融合的合子核基因組處于轉錄靜止狀態,無法合成蛋白質,胚胎的早期發育完全由卵母細胞中儲存的母源因子(mRNA和蛋白質)控制。母源因子是維持受精后第一次卵裂的必要物質,可以驅動早期胚胎快速地進行有絲分裂[3]。但隨著母源因子被逐漸消耗和降解,胚胎需要依靠自身物質來繼續發育,胚胎發育由母源轉錄本調控轉變為由合子核基因組調控,這一過程就是母源-合子轉換(maternal-to-zygotic Transition,MZT)[4]。ZGA和母源因子的清除協調作用,共同完成了MZT,使胚胎獲得能夠分化成完整個體的全能性。由于MZT在早期胚胎發育中存在關鍵作用,有關母源因子清除和ZGA發生機制的研究一直備受干細胞生物學、表觀遺傳學和發育生物學等領域研究者的關注。雖然ZGA在后生動物中普遍存在,但不同物種中ZGA的發生時間存在差異。小鼠胚胎基因組激活發生在2-細胞胚胎晚期[5];大型家畜的早期胚胎發育通常更依賴母源因子,例如豬和牛的ZGA發生在4-細胞到16-細胞之間[6,7];人類胚胎基因組的轉錄激活一般在4-細胞和8-細胞時期[8-10]。
小分子非編碼RNA(small non-coding RNA,sncRNA)是一類長度僅為20-30 nt的非編碼RNA,過去曾被認為是“垃圾DNA”的非功能性轉錄產物,主要包括微小RNA(microRNA,miRNA)、與PIWI蛋白相互作用的RNA(Piwi-interacting RNA,piRNA)和小干擾RNA(small interference RNA,siRNA)[11]。但深入研究發現,這些sncRNA可以在RNA干擾(RNAi)中發揮作用,通過調節基因的表達參與多種生命活動,例如生長發育、細胞凋亡和各種疾病發生[12,13]。也有研究認為sncRNAs能夠定向調節靶mRNA的表達,在早期胚胎中激活或產生清除母源因子的信號通路,參與母源轉錄本的降解,使胚胎能夠順利完成母源因子的清除和合子基因組的激活,從而將卵母細胞對早期胚胎的發育控制權轉向合子基因組[14]。本文總結了近年來sncRNA參與母源因子清除的主要研究進展,綜述sncRNA調節MZT的研究現狀。
1 母源因子降解對合子基因組激活的作用
1.1 母源因子的定義
精子和卵子結合所形成的受精卵是個體發育的基礎,但事實上受精卵是由雌雄原核融合的合子核以及卵細胞的細胞質組成。在卵裂初期,合子基因組沒有表達,細胞質中儲存的RNA和蛋白質控制著早期胚胎的有絲分裂,這些物質被稱為母源因子,負責表達母源因子的基因則為母源基因。胚胎早期發育完全依賴于母源因子。Motley是斑馬魚胚胎中的母源因子,控制染色體的分離和細胞質的分裂,Motley突變后胚胎中的染色體排列異常,細胞質分裂不均勻[15]。合子阻滯基因1(Zygote arrest 1,Zar1)是最早被發現的調控早期胚胎發育的母源基因,Zar1基因缺失會導致雌鼠不育,受精卵缺失Zar1基因則會在1-細胞階段停止發育[16]。但隨著胚胎發育越來越復雜,胚胎需要激活自身的基因組才能成長為新個體,母源因子逐漸消耗并被清除。
1.2 母源因子降解是合子基因組激活的前提
在母源因子主導胚胎基因組轉變的過程中,絕大多數母源因子都會降解,母源因子及時降解是保障合子基因組完成激活和胚胎繼續發育的前提。一部分母源mRNA在ZGA之前甚至在受精之前就被母源物質清除,屬于母源性降解(Maternal decay,M-decay);還有一些母源mRNA需要在部分合子基因表達之后被胚胎產物降解,稱為合子性降解(Zygotic decay,Z-decay)[17]。果蠅有1/3的合子核基因可能會促使母源mRNA降解[18]。小鼠中絕大多數母源mRNA都在2-細胞期后降解,BTG4基因只在卵母細胞和受精卵中表達,敲除BTG4的小鼠卵母細胞雖然具備受精能力但只能發育到2-細胞,并且本該降解掉的母源mRNA仍然存在[19]。敲除小鼠卵母細胞中調控DNA甲基化的Stella基因后有一半的胚胎由于ZGA缺陷而不能發育到4-細胞[20]。人類胚胎普遍在8-細胞發生ZGA,如果母源mRNA沒有及時清除,胚胎發育會受到阻礙,胚胎基因組也不會表達[21]。在正常斑馬魚胚胎中,YTHDF2會識別母源mRNA的m6A甲基化修飾并使mRNA降解,敲除YTHDF2后母源mRNA的半衰期延長,原腸胚形成時間推遲,注射外源YTHDF2則會使表型恢復正常[22]。山羊胚胎也有類似的現象,ZGA過程中YTHDF2呈高水平表達,轉錄組測序顯示母源mRNA的含量在ZGA之前都呈現下降的趨勢,敲除YTHDF2后脫帽酶DCP1A的表達量下調,母源mRNA不能完全降解,很多胚胎沒有發育成囊胚[23]。綜上,母源因子在早期胚胎發育中起到決定作用,在MZT階段,母源因子能否正常降解調控著合子基因組的激活時間以及胚胎的發育速度。
2 miRNA
2.1 miRNA的作用機制
miRNA是較早被發現的非編碼RNA,從此掀起了傳統中心法則之外的非編碼RNA功能機制的研究熱潮。miRNA廣泛存在于動物的各個組織中,哺乳動物約半數的基因表達都會受到miRNA的調節。miRNA與靶基因并不是一一對應的,一個miRNA可以有多個靶基因,一個基因也可以受到很多miRNA的調節,因此形成了復雜的基因調節網絡[24]。與其他RNA一樣,miRNA也是由細胞核內的DNA轉錄而來。如圖1所示,miRNA基因在聚合酶II的作用下轉錄成初級miRNA(pri-miRNA)[25]。DGCR8識別pri-miRNA并與Drosha酶形成復合物將pri-miRNA分解為只有70~80 nt的前體miRNA(pre-miRNA)[26]。pre-miRNA經轉運蛋白Exportin 5運輸到細胞核外,被細胞質中的RNA內切酶III家族的Dicer酶切割成20 nt左右的雙鏈miRNA,在AGO2蛋白的共同作用下將雙鏈打開,暴露出其中的引導鏈,引導鏈與RNA誘導沉默復合體(RNA-induced silencing complex,RISC)結合,引導成熟的miRNA與調節靶基因穩定性的3'UTR結合,抑制靶基因的翻譯[27]。
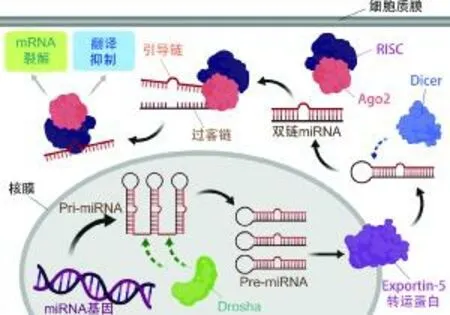
圖1 miRNA的生物形成及作用機制[28]Fig.1 The biogenesis and action mechanism of miRNA[28]
2.2 miRNA與ZGA期間降解母源因子
miRNA是胚胎發育從母源因子調控轉變成合子基因組調控的主要參與者。這些小分子內源性非編碼RNA在卵巢組織、顆粒細胞、卵母細胞、卵泡液和胚胎中表達,有些miRNA還可以經囊泡排到胞外,與細胞內的miRNA共同參與生物體生存和發育的調節[29]。現有研究發現,降低果蠅AGO1基因表達會使胚胎發育停滯,還會導致神經系統功能紊亂[30];AGO2蛋白參與RNA誘導沉默復合體的形成,缺失該蛋白后,小鼠胚胎不能正常發育成原腸胚[31];DGCR8是miRNA加工過程中的重要蛋白,敲除DGCR8基因后小鼠胚胎只能短暫發育到6.5 d[32];無獨有偶,小鼠早期胚胎缺失Dicer基因后往往在原腸胚前后停止發育[33],這些結果都表明早期胚胎的發育一定要有miRNA的存在。
miRNA主要參與母源因子的合子性降解通路。miR-430在斑馬魚早期胚胎中廣泛表達,屬于第一批被合子基因表達的miRNA。斑馬魚的很多母源mRNA都受到miR-430的調節,而miR-430的多數靶基因也都屬于母源mRNA,早期胚胎缺失miR-430會導致上百個母源mRNA的表達不能被充分抑制,缺乏Dicer的斑馬魚胚胎在形成原腸胚的過程中會出現阻礙,但通過注射miR-430可以彌補這種阻礙繼續發育,說明miR-430主要在ZGA階段起作用[34]。Nanog、Pou5f1和SoxB1是來自卵母細胞的高度表達的母源轉錄因子,通過激活miR-430的表達清除母源因子并調節ZGA,缺失這種基因的斑馬魚胚胎則不能發育成原腸胚,包括miR-430在內的半數合子基因也無法激活[35,36]。miR-309簇編碼的8個miRNA(miR-3、miR-4、miR-5、miR-6-1、miR-6-2、miR-6-3、miR-286和miR-309),在果蠅胚胎的合子基因組開始轉錄時也會被表達出來,敲除miR-309簇后母源mRNA顯著上調,證明這些miRNA可以在清除果蠅胚胎母源因子中發揮作用[37]。RNA結合蛋白Smaug(SMG)屬于母源性降解通路,可以與果蠅胚胎中的母源轉錄本結合,在脫腺苷酸化酶復合體的作用下降解母源因子[38],也能夠促進miR-309簇的表達,將SMG突變后miR-309等8個miRNA的表達量明顯降低,而母源因子的含量卻沒有明顯下降[39]。與miR-430類似,miR-427是由非洲爪蟾胚胎基因組表達的miRNA,在受精7 h后就可以檢測到很高的豐度,但在原腸胚形成后會迅速減少,在成年的非洲爪蟾中不會再表達[40]。非洲爪蟾合子基因組激活前依賴母源性細胞周期蛋白A1和B1進行快速地卵裂,但miR-427靶向表達母源性細胞周期蛋白的轉錄本的3'UTR,使母源性細胞周期蛋白逐漸衰減,促使合子基因表達,為胚胎提供新的細胞周期蛋白,并且非洲爪蟾的很多母源性mRNA都存在miR-427的潛在靶位點,這表明miR-427可能是降低母源mRNA表達的重要參與者[41]。線蟲中有miR-35-42和miR-51-56可以誘導母源mRNA脫腺苷酸化來降解母源因子[42]。
小鼠的合子基因在2-細胞晚期開始表達的同時,miR-290-295簇也在第一時間被編碼形成,并且在4-細胞時期轉錄速度加快,在這之前胚胎中都只有少量的miR-290-295[43]。分析小鼠不同時期胚胎的基因表達譜,與miRNA作用機制相關的AGO2基因的表達量在不同的胚胎時期有很大的波動,2-細胞胚胎表達量下降了5倍,但在4-細胞和8-細胞期又恢復到高水平,到桑葚胚時期迅速下降[44]。在牛的早期胚胎中,miR-125、miR-127和miR-145的表達量在4-細胞和8-細胞時期升高[45],miR-130a和miR-21的表達量在8-細胞時期增加[46]。雞的miR-302家族是小鼠的miR-290家族、非洲爪蟾的miR-427家族以及斑馬魚的miR-430家族的直系同源物,在卵裂中后期(EGK.VIII期)表達量大幅度增加,并在胚盤期(EGK.X期,相當于哺乳動物的囊胚期)大量表達[47,48],這種動態的表達模式也可能是miRNA能夠調節MZT的一種體現。
多能性因子OCT4、Nanog、SOX2和KLF4有調節合子基因組激活的作用,OCT4是人類ZGA必要的轉錄因子,其結合位點富集在ZGA時期的染色質開放區域[49]。將miR-294與OCT4、SOX2和KLF4外源基因共同導入小鼠胚胎成纖維細胞,可以讓細胞的重編程效率比沒有轉染miR-294的細胞高10倍[50]。在沒有誘導多能性的外源轉錄因子的情況下轉染miR-302仍然能使人或小鼠的成纖維細胞重編程為多能細胞[51]。NOBOX是在牛早期胚胎發育中起作用的母源基因,miR-196a能夠靶向NOBOX的3'UTR區域在MZT期間清除這種母源因子,可以檢測到NOBOX表達量在8-細胞期迅速降低,miR-196a的表達量增加的時期和胚胎基因組激活的時間是一致的[52]。SEBOX是一種母體效應基因,一直到小鼠的ZGA之前都有很高的表達量,該基因被敲除后不會影響卵母細胞的發育,但原核期胚胎缺失SEBOX則會使母源因子不能完全降解以及調控ZGA的基因異常表達,從而導致2-細胞胚胎發育受阻[53]。研究發現敲除miR-125家族會增加SEBOX的表達量,并導致在MZT期間調控ZGA基因的表達量上升[54]。胚胎也可以通過攝取子宮內膜的miRNA激活相關基因的表達來調節著床時間,例如子宮內膜的miR-30d可以間接觸發與人類胚胎粘附相關的基因的表達[55]。
現階段關于miRNA對ZGA的研究大多集中在胚胎不同發育階段的表達譜分析,miRNA在卵母細胞和不同時期的胚胎中差異表達也是miRNA能夠在早期胚胎發育過程中起調節作用的依據之一。miRNA主要通過抑制母體效應基因的翻譯,降低母源轉錄本的穩定性,加速母源因子的降解等途徑清除母源因子。目前,miRNA對MZT和ZGA的作用只在昆蟲和斑馬魚等脊椎動物中得到了明確的驗證,在哺乳動物中的實際作用效果還需要進一步探究。miRNA只是小分子非編碼RNA的一個分支,并不能完全代表sncRNAs在ZGA過程中的功能機制。
3 siRNA
3.1 siRNA的作用機制
siRNA也是RNA干擾的主要途徑之一,在基因表達的過程中發揮調節作用。與miRNA類似,內源性siRNA(endo-siRNA)的形成也需要在Dicer酶的作用下將機體內部產生的具有同源性的雙鏈RNA(dsRNA)切割成長度為21~25 bp的雙鏈小RNA片段[56]。成熟的endo-siRNA的雙鏈結構是siRNA發揮RNA干擾功能的前提條件。如圖2所示,endo-siRNA中的隨從鏈被分離降解,引導鏈與Argonaute家族的AGO2蛋白結合構成RISC,與mRNA結合誘導靶基因降解[57]。相比于miRNA,endo-siRNA對于靶基因具有更高的特異性識別能力。endo-siRNA可以靶向mRNA的任何區域而不局限在非編碼區,miRNA只需要種子序列的7個堿基與靶位點結合便可以抑制mRNA的翻譯,而siRNA的序列則需要與靶基因完全匹配才能使用RISC中的核酸內切酶切斷結合位點處的mRNA,被切斷的mRNA迅速被細胞中的酶降解,不能再進行下一步的翻譯表達[58]。生物體中的endo-siRNA大多分布在體細胞和生殖細胞的假基因、內含子和轉座子區域[59]。siRNA現已成為分子和細胞實驗不可或缺的工具。研究人員利用siRNA的這一作用機理,通過簡單的轉染技術將外源的siRNA導入實驗對象中,實現基因的敲除,以此進行疾病防治、新藥開發以及基因診斷等不同領域的研究。雖然siRNA在生物體中的很多調節機制都不明確,但由于siRNA與靶標轉錄本結合的特異性高于miRNA,對mRNA的降解能力也更強,所以目前siRNA作為基因敲除工具在生物醫學領域有比miRNA更廣泛的應用。
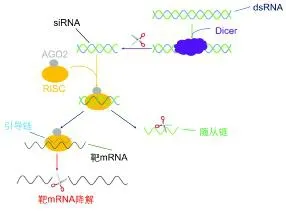
圖2 siRNA的作用機制[60]Fig.2 The action mechanism of siRNA[60]
3.2 siRNA與母源因子的降解
endo-siRNA在卵母細胞中高度表達,已有報道顯示siRNA能夠調節早期胚胎的發育過程。卵母細胞儲存的大部分母源因子一方面可以調控卵母細胞順利進入減數第二次分裂中期,使其擁有受精能力,另一方面又可以在早期胚胎中表達,支持胚胎前期的卵裂,所以母源因子的缺失和突變都可能造成雌性動物的不孕或流產[19,61]。將小鼠卵母細胞中的Dicer基因敲除后,紡錘體的形成受阻,同源染色體也不能正常分離,卵母細胞的發育將停滯在第一次減數分裂,導致小鼠不能受精[62];存在于卵母細胞中的miRNA和endo-siRNA需要在Dicer酶的參與下才能形成。Suh等[63]敲除小鼠卵母細胞中的DGCR8基因后,細胞內mRNA的表達水平沒有明顯變化,卵母細胞仍然可以發育成熟,并能與精子結合產生正常的受精卵。由于siRNA的形成過程中不需要DGCR8蛋白的調節,DGCR8基因的缺失只能抑制卵母細胞中miRNA的生成,說明endo-siRNA是卵母細胞發育成熟以及動物生育不可缺少的調節因子。Stein等[64]進行卵母細胞轉錄組測序時發現miRNA的活性在卵母細胞發育的過程中始終受到抑制,這也說明miRNA在卵母細胞生長過程中幾乎不發揮作用。
抑制相關miRNA的表達也可能是siRNA調節ZGA的一種方式。Zhao等[65]在斑馬魚早期胚胎中注射不同的siRNA后,胚胎的大腦和尾巴都會發生不同程度的損傷,并且會導致胚胎中能夠降解母源因子的miR-430的表達量降低,將siRNA與miR-430共同導入胚胎中則不會再出現這些缺陷。產生這種現象的原因可能是siRNA與miRNA的合成與作用路徑中存在對Dicer酶等共同組分的競爭關系。Argonaute蛋白家族的AGO1-4的4個成員都可以參與miRNA形成RISC的過程,缺失任一成員雖然都會抑制miRNA的活性,卻也可以通過增加其他蛋白來彌補,但是siRNA的作用通路只有AGO2的參與。將小鼠胚胎中的AGO2敲除后胚胎只能發育到2-細胞期,本該降解的母源因子也依舊存在,與之對應,敲除AGO3和AGO4蛋白后胚胎依然可以成長到囊胚期,這些現象表明siRNA也可能促進母源因子的消除[66]。對小鼠不同時期的胚胎進行RNA和小RNA測序,在卵母細胞和4-細胞胚胎中差異表達的母源基因里有1/4都受到endo-siRNA的靶向調控[67]。Han等[68]對秀麗線蟲的卵母細胞和胚胎中的小RNA進行高通量測序,發現endo-siRNA的長度大多是22 nt和26 nt,其中26 nt的endo-siRNA在胚胎中上調,而在第四階段的幼蟲期開始下降,在此期間26 nt的endo-siRNA所靶向的母源轉錄本驟減,推測這類endo-siRNA可以清除合子發育過程中的母源因子。之前也有研究表明參與MZT的lncRNA可以在Dicer酶的作用下轉化為endosiRNA[69]。
目前明確的siRNA的功能還只是在調節卵母細胞發育成熟這一層面,即使有很多現象能夠反映endosiRNA可以通過母源降解性通路清除母源mRNA調節早期胚胎的ZGA,但由于研究對象和研究方法的單一,當前并不能確定siRNA在ZGA中的具體作用效果和機制。但endo-siRNA在哺乳動物生殖細胞中廣泛分布的這一特點仍然為探索它在早期胚胎發育中所扮演的角色提供了很多可能性。
4 piRNA
4.1 piRNA的作用機制
與miRNA和endo-siRNA不同的是,內源性piRNA的形成機制更加復雜,它的形成過程中不需要Dicer酶的參與。PiRNA是一類長度為25~35 nt的單鏈非編碼小RNA,因為需要與PIWI亞家族的成員蛋白結合才能發揮作用而被命名為PIWI蛋白相互作用RNA(Piwi-interacting RNA,piRNA)[70,71]。piRNA最早是在哺乳動物生殖細胞中被發現的,目前也被認為主要存在于動物的生殖細胞中,所以現階段關于piRNA的研究內容也都圍繞生殖生理方面。編碼piRNA的基因呈現不連續的簇狀分布所以被稱為piRNA簇,可以單向或雙向轉錄生成pre-piRNA[72]。如圖3所示,果蠅生殖細胞中成熟的piRNA的形成需要經過兩種途徑的協同作用,分別是初級加工途徑和被稱為“乒乓循環”的次級加工途徑[73]。pre-piRNA被轉運到細胞質后與AGO3結合,經Zuc核酸內切酶切割后變成piRNA中間體,然后與PIWI蛋白家族中的Aub結合,被核酸酶剪切成最終的長度后進入乒乓循環;PIWI-piRNA復合體識別并切割與piRNA互補的mRNA,使之變成新的piRNA,新piRNA與AGO3蛋白結合后繼續切割與之互補的mRNA,如此循環往復,piRNA的含量增加,含有與piRNA互補序列的mRNA的含量減少,直到被完全破壞[74]。
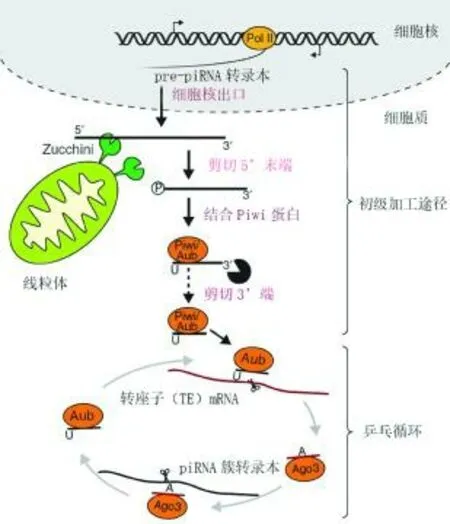
圖3 果蠅piRNA的發生途徑[75]Fig.3 The piRNA pathway in the [75]
4.2 piRNA對母源mRNA清除的影響
目前關于piRNA的探究普遍集中在雄性配子的發育與男性不育的治療方面,對它在早期胚胎中的影響尚不清楚,但有一些現象反映piRNA也能參與母源因子的清除。Ohnishi等[76]利用高通量測序分析小鼠減數第二次分裂中期的卵母細胞和不同階段的植入前胚胎的RNA表達水平,推測piRNA可能會沉默一些妨礙早期胚胎重編程的逆轉錄轉座子。Wei等[77]通過下一代測序技術發現斑馬魚的256-細胞期胚胎有高水平的piRNA,這種表達模式可能與母源因子的降解相關。Kawaoka等[78]分析了家蠶卵母細胞和胚胎的基因表達譜,發現受精卵中的piRNA發生了激烈的乒乓循環,推測piRNA可以通過沉默特定轉座子的方式調節早期胚胎發育。埃及伊蚊胚胎ZGA發生前無tapiR1的表達,敲除該piRNA,則早期胚胎發育停滯,tapiR1的缺失會造成母源因子上調并破壞合子基因組轉錄[79]。Rouget等[80]發現果蠅早期胚胎中的piRNA可以與Smaug、CCR4等脫腺苷酸化酶復合體結合到母源基因Nanos的3'UTR區域促使其降解,通過這種方式來參與早期胚胎母源因子的降解。Barckmann等[81]在果蠅早期胚胎中發現了數百個可以與Aub蛋白結合的母源mRNA,在MZT期間這些mRNA都與PIWI-piRNA結合并被切割和降解;將胚胎中參與降解母源轉錄本的CCR4基因突變后piRNA的表達量隨之上升,推測piRNA也可以通過降解母源因子來彌補CCR4缺失的不足。
5 展望
高通量測序和基因敲除技術的廣泛應用逐漸揭開了sncRNAs的神秘面紗。不斷有研究發現sncRNAs可以參與早期胚胎MZT過程中的母源因子清除,激發合子基因組的表達,但具體的作用機制還需要進一步探究。從sncRNAs水平上研究早期胚胎MZT的機制,將有助于獲得早期胚胎發育機制的重要分子標記,為增加哺乳動物的繁殖潛力和提高后代存活率提供理論依據。

