基于計算機虛擬篩選研究菝葜抗肝癌的作用機制*
鄺玉慧,徐方飚,陳曉琦,戴璐璐,謝抗,陳欣菊
1.河南中醫藥大學第一附屬醫院,河南 鄭州 450000; 2.中國中醫科學院西苑醫院,北京 100091; 3.廣東藥科大學中醫藥研究院,廣東 廣州 510006
原發性肝癌大多數為肝細胞癌(hepatocellular carcinoma,HCC,以下簡稱“肝癌”),占原發性肝癌85%[1]左右,是全球最常見的消化系統惡性腫瘤,其較高的病死率嚴重威脅人們的健康和生命。大多數患者確診時已處于中晚期,失去了手術的機會,而靶向治療、介入治療及放化療的不良反應會進一步加重肝臟負擔。中醫藥是中華民族文化的瑰寶,中醫藥防治腫瘤有自己獨特的特色和優勢,在西醫治療手段的基礎上加強中醫藥療法,不僅能夠提高肝癌患者的生存率及生活質量,而且能夠減輕放化療帶來的不良反應,增強患者的免疫力。
菝葜為百合科植物菝葜(SmilaxchinaL) 的干燥根莖,又名金剛藤,2015年版《中華人民共和國藥典》記載菝葜具有利濕去濁、祛風除痹、解毒散瘀的功效。現代藥理研究發現,菝葜可以抑制腫瘤細胞的增殖、誘導腫瘤細胞的凋亡,激活巨噬細胞和增強宿主免疫系統功能,臨床上也常用于治療腫瘤的組方中。菝葜具有多成分、多靶點、多途徑的相互作用特點,而目前對菝葜的研究多集中針對某一疾病的某一個作用機制,缺乏對其機制系統的研究。
虛擬篩選是利用計算機進行分子對接模擬,幫助篩選小分子藥物的一項技術。網絡藥理學融合了系統生物學、信息網絡學和計算機科學,將網絡藥理學與網絡分析相結合,能夠系統預測和揭示藥物、化學成分、基因、靶點與疾病之間相互關系和作用機制。利用網絡藥理學和虛擬篩選[2]多層次構建網絡模型,是從整體的視角研究中醫藥,闡釋中藥有效性和科學性的新方式。因此,本研究通過網絡藥理學及分子對接技術預測菝葜抗肝癌的潛在作用靶點和通路,明確其作用途徑。
1 材料與方法
1.1 數據庫與軟件應用中藥系統藥理學數據庫與分析平臺(http://lsp.nwu.edu.cn/tcmsp.php);Uniprot數據庫(https://www.uniprot.org);疾病數據庫Genecard(https://www.genecards.org/)、PharmDB-K數據庫(http://pharmdb.org/)、GAD數據庫(https://geneticassociationdb.nih.gov/);數據分析軟件STRINGR(http://string-db.org/cgi/input.pl);基因本體 (gene ontology,GO)富集分析和京都基因與基因組百科全書(kyoto encyclopedia of genes and genomes,KEGG)通路富集分析數據庫Bioconductor(http://www.bioconductor.org/);Cytoscape3.7.2(插件ClueGO、CluePedia、CytoNCA、MOCODE)、R軟件;分子對接模擬軟件AutoDockTools;分子結構可視化及對接分析軟件Pymol。
1.2 菝葜活性成分與有效靶點的收集利用中藥系統藥理學分析平臺(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP)數據庫,檢索“菝葜”的所有化學成分,并根據口服生物利用度(oral bioavailability,OB)值≥30%,類藥性(drug likeness,DL)值≥0.18為篩選條件收集主要活性成分,建立藥物化學成分數據庫,搜索相應的活性成分靶點并查閱近期文獻報道,補充未預測到活性成分的已知靶點,然后再通過Uniprot數據庫中的UniProKB檢索功能(https://www.uniprot.org/),通過輸入靶蛋白名稱,限定物種為“Homo sapiens”,再將得到的靶點蛋白名稱轉化為基因ID,建立菝葜活性成分靶點數據庫。
1.3 肝癌靶點收集與PPI網絡的構建檢索關鍵詞“hepatocellular carcinoma”,限制物種為“homo sapiens”。對GeneCards、GAD和PharmDB-K數據庫收集的肝癌相關靶點基因,建立肝癌靶點數據庫。將肝癌靶點數據庫與菝葜活性成分靶點數據庫對比,提取相同靶基因構建“藥物-活性成分-靶點”網絡,并上傳String平臺,限制物種為“homo sapiens”構建蛋白互作網絡(protein-protein interaction networks,PPI)。然后導入Cytoscape3.7.2構建網絡,并采用CytoNCA對PPI網絡進行拓撲分析,得到核心網絡。
1.4 肝癌靶點的功能富集分析利用R軟件ClusterProfiler包進行富集分析,限定物種為“homo sapiens”,檢驗值pvalueCutoff≤0.05,qvalueCutoff≤0.05,對關鍵靶點進行GO生物功能和KEGG富集分析。
1.5 活性成分與關鍵靶點分子對接根據關鍵靶點對應的成分,從中篩選出調控靶點最多的成分,通過Pubchem數據庫下載小分子化合物結構,采用AutoDock軟件去水分子、氫等處理,運用Vina進行分子對接模擬獲取對接能量,pymol軟件對結果進行分析。
2 結果
2.1 菝葜活性成分與有效靶點的收集本研究通過TCMSP數據庫檢索到39個活性成分,共295個靶點。并根據DL和BL參數篩選13個有效活性成分并進行靶點預測,去除重復靶點后提取到112個有效靶點,通過Uniport數據庫進行基因ID轉換。
2.2 肝癌靶點收集通過關鍵詞“hepatocellular carcinoma”在GAD數據庫、GeneCards數據庫、PharmDB-K數據庫檢索人的基因,共獲得7 525個肝癌相關疾病靶點。然后將所得的肝癌靶標基因與藥物有效靶點基因進行對比,映射出11個有效活性成分(見表1),和53個關鍵靶點,即為菝葜治療肝癌潛在的靶標基因。構建“活性成分-靶點”網絡(見圖1)。
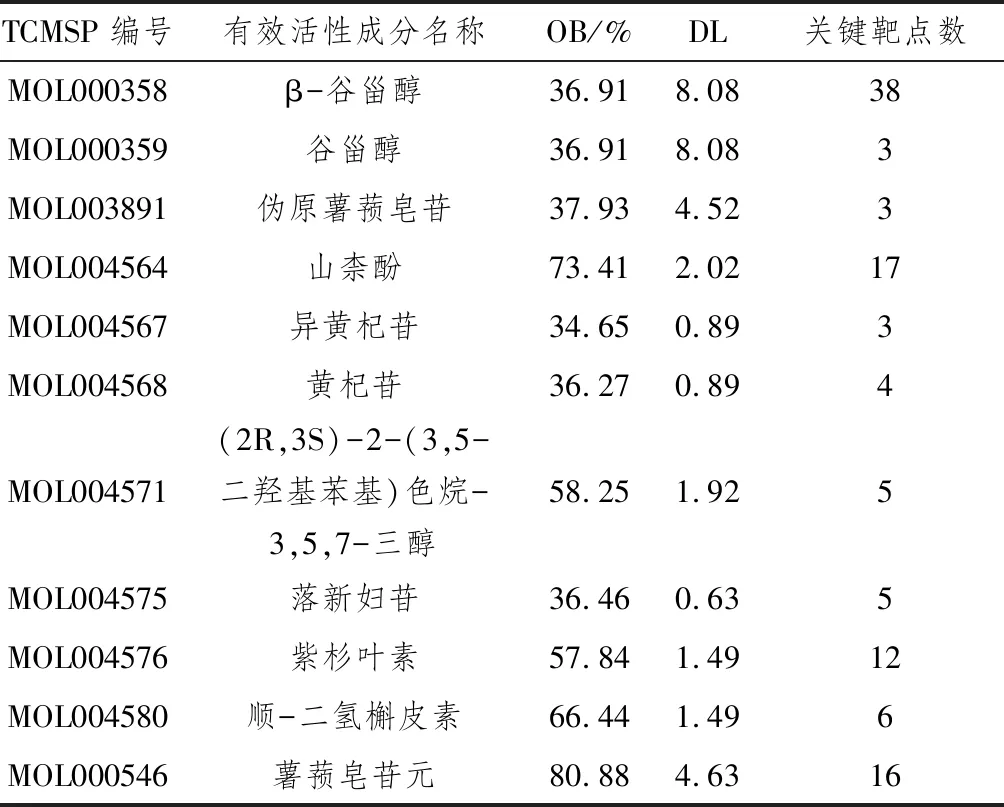
表1 菝葜有效活性成分及對應靶點數
2.3 蛋白互作網絡的構建及分析把共同靶標基因導入String軟件構建蛋白互作網絡PPI(見圖2A)。調取得到的蛋白相互作用數據導入Cytoscape3.7.2的插件CytoNCA根據網絡藥理學研究中評價網絡節點重要性的核心參數度值(degree)進行拓撲分析(見圖2B),degree越大,節點越大,顏色越深,說明節點在網絡中越接近網絡中心位置PPI網絡,即有越多的成分作用于該靶點。根據靶蛋白互作網絡圖中度值大于中位數2倍,即degree≥26為標準,得到7個核心靶點AKT1、VEGFA、CASP3、JUN、HSP90AA1、PPARG、RELA這些靶蛋白與肝癌的發生、轉移有關。
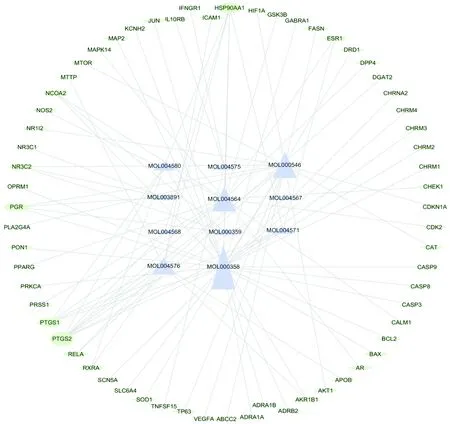
注:大紅色代表藥物菝葜,紫紅色代表藥物有效活性成分,湖藍色代表共同基因靶點圖1 活性成分-靶點網絡圖
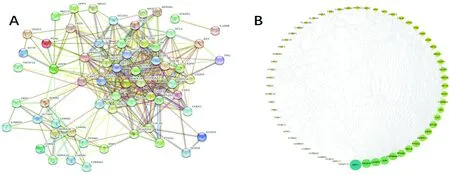
注:A為蛋白互作網絡PPI;B為CytoNCA拓撲分析圖2 蛋白互作網絡構建與拓樸分析圖
2.4 肝癌靶點的功能富集分析對靶點基因進行GO功能富集得到1 792個條目,其中生物學過程(biological process,BP)1 203個條目、細胞定位(cellular component,CC)34個條目、分子功能(molecular function,MF)53個條目。篩選排名前20個條目繪制氣泡圖(圖3A、3B、3C)。生物學過程BP主要表現在對脂多糖的反應、炎癥反應、氧化應激的反應、類固醇激素的反應、凋亡信號通路的調節、蛋白磷酸化的正調控、DNA結合轉錄因子活性等方面。KEGG通路富集分析得到129條信號通路并對前20個條目進行繪圖(如圖3D),主要涉及癌癥通路、HIF-1信號通路、P53通路、VEGF通路及病毒感染通路等。如表2為前20名顯著差異通路及相關基因靶點數,利用Cytoscape構建“通路-靶點”網絡(如圖4),靶點所富集的通路越多,則該靶點所代表的長方形形狀越大,同理通路所含富集的靶點越多則該通路所代表的六邊形形狀越大。

注:A:GO-BP;B:GO-CC;圖3C-MF;3:D-KEGG通路富集圖3 肝癌靶點功能富集分析圖

表2 KEGG富集分析前20個相關通路
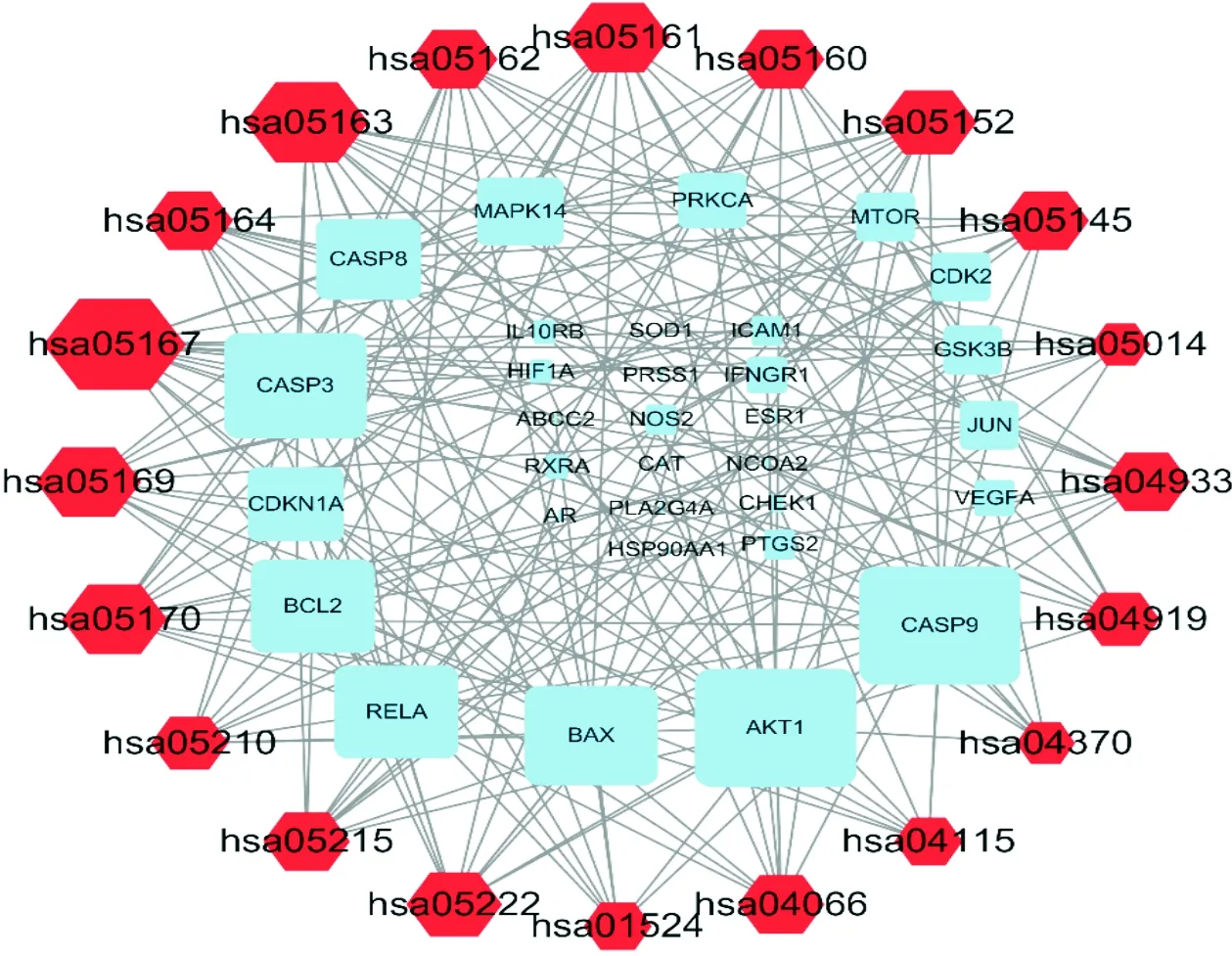
圖4 前20位相關條KEGG靶點-通路圖
2.5 活性成分與關鍵靶點分子對接通過ADME原則篩選的11個活性成分為β-谷甾醇、谷甾醇、山柰酚、偽原薯蕷皂苷、異黃杞苷、黃杞苷、(2R,3S)-2-(3,5-二羥基苯基)色烷-3,5,7-三醇、落新婦苷、紫杉葉素、順-二氫槲皮素、薯蕷皂苷元。通過TCMSP數據庫獲取11個活性成分mol2結構,PDB數據庫獲取7個核心靶點結構,對應PDB ID為:AKT1(ID:6s9w)、VEGFA(ID:1mkk)、CASP3(ID:3v3k)、JUN(ID:5t01)、HSP90AA1(ID:6gr5)、PPARG(ID:6ms7)和RELA(ID:2o61)。利用AutoDock去除蛋白自身配體和去氫、去水分子處理,通過Vina進行配體與分子對接模擬,結合力熱圖(見圖5)。根據以上結果,選擇靶點數目靠前的兩個活性成分β-谷甾醇(beta-sitosterol)和山柰酚(Kaempferid)與圖4中度值最高的靶點AKT1和CASP9,通過Pymol顯示對接結構,β-谷甾醇和山柰酚分別可以穩定地對接到AKT1和CASP9蛋白結構中(見圖6)。
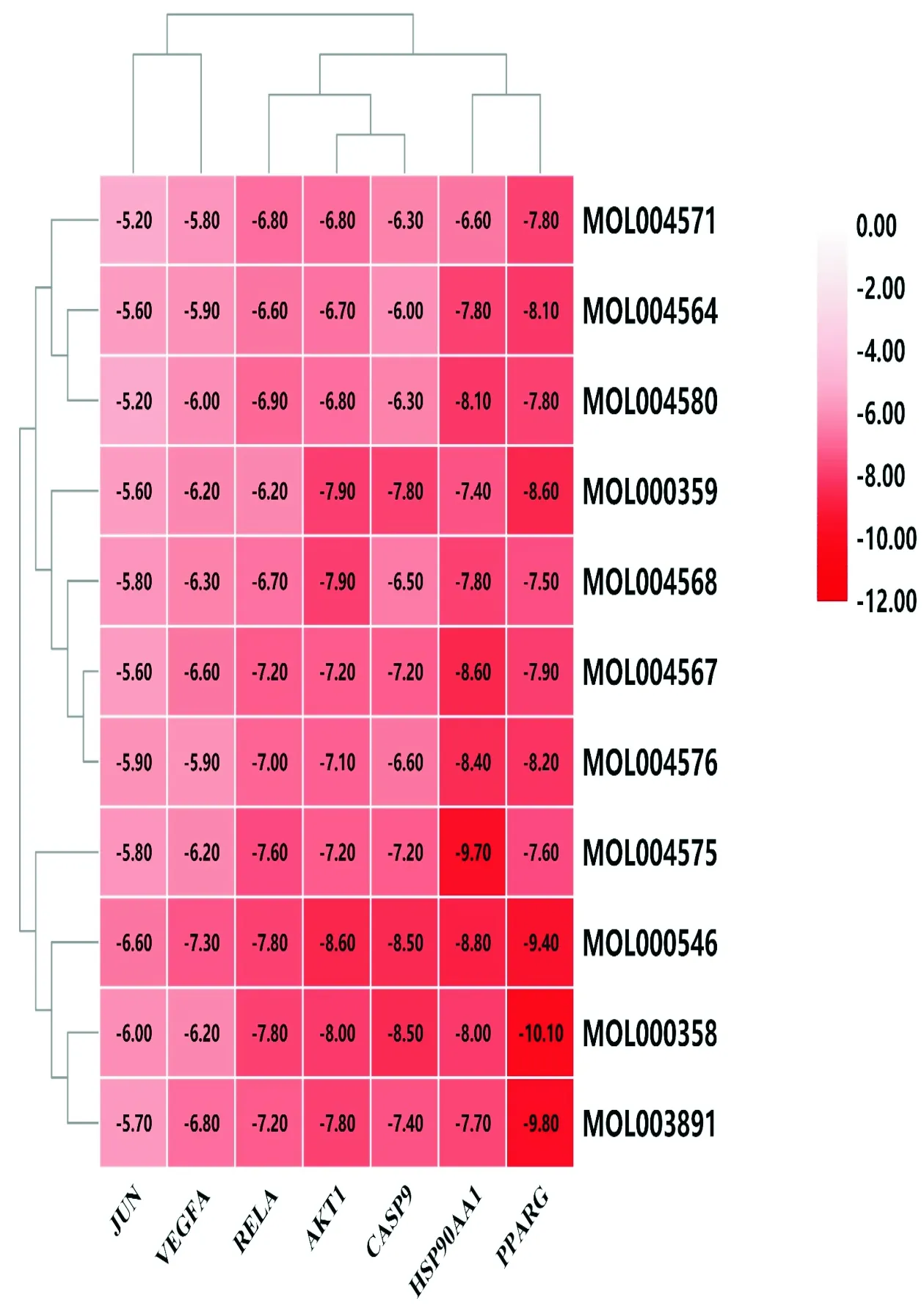
圖5 分子對接結合力熱圖
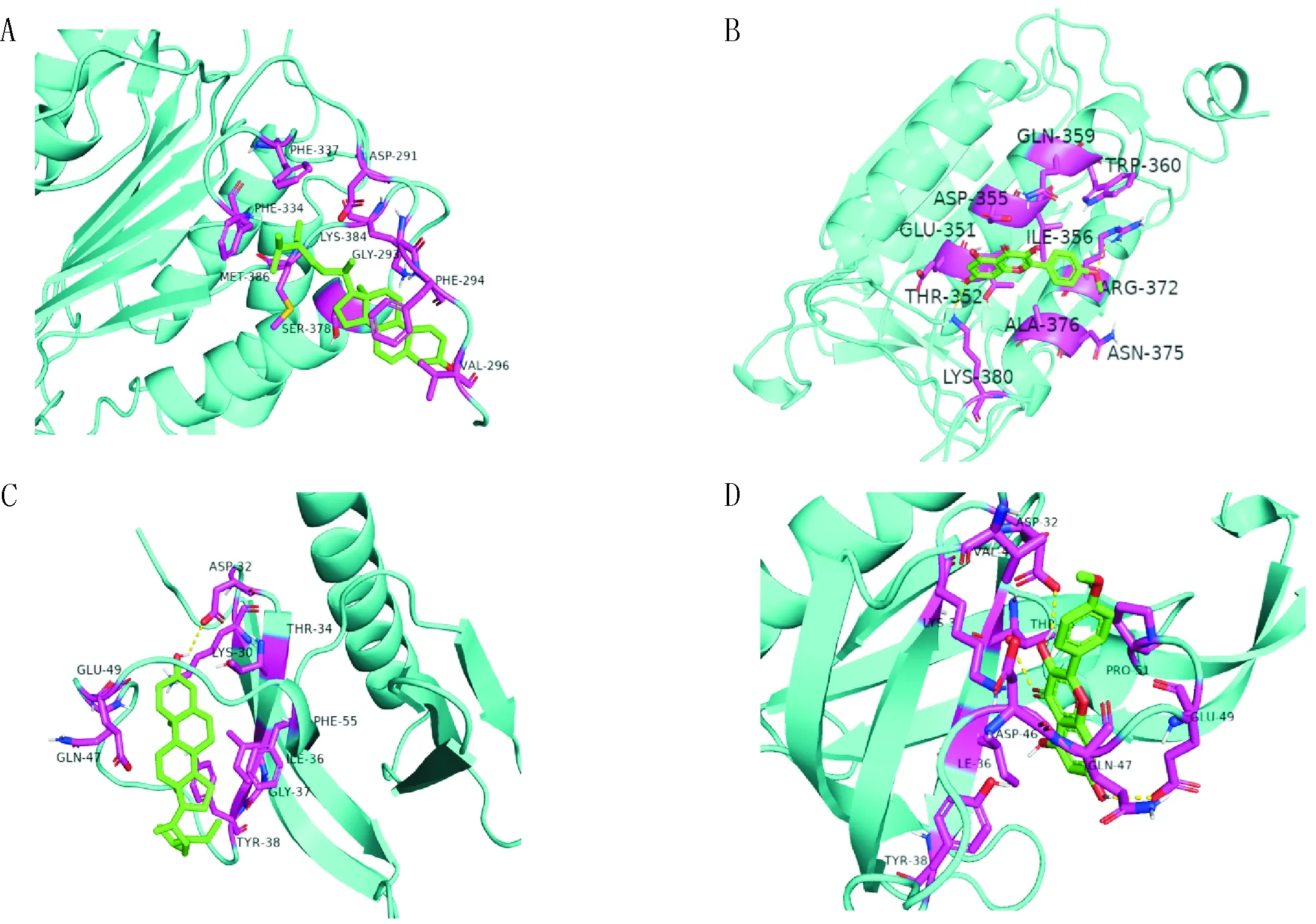
注:A:CASP9與β-谷甾醇;B:CASP9與山柰酚;C:AKT1與β-谷甾醇;D:AKT1與山柰酚圖6 分子對接結構圖
3 討論
從TCMSP數據庫得到11個活性化學成分和7個核心靶點,菝葜抗肝癌的核心靶點有AKT1、VEGFA、CASP3、JUN、HSP90AA1、PPARG、RELA等;主要是通過抗腫瘤血管生成、抑制肝癌細胞的增殖、促進肝癌細胞的凋亡和調控細胞周期等多靶點、多通路的抗肝癌方式。并根據虛擬篩選,發現11個活性成分與7個核心靶點對接結合能均較好,是菝葜發揮抗肝癌作用的重要化學成分,此外其與7個核心靶點均具有較好的結合能力。若結合能<0 kcal·mol-1,說明配體與受體可以進行自發結合,若結合能<-5.0 kcal·mol-1,說明兩者具有較好的結合性。從分子對接熱圖中可以直觀看到,11個活性成分均與7個核心靶點結合能均<-5.0 kcal·mol-1,這說明具有良好的結合力。
進一步研究菝葜抗GO生物過程和KEGG信號通路富集分析發現,菝葜抗肝癌靶點的生物過程涉及對脂多糖的反應、炎癥反應、凋亡信號通路的調節、蛋白磷酸化的正調控、DNA結合轉錄因子活性等方面,這些通路即菝葜重要靶標抗肝癌的主要生物學過程。
本研究通過網絡藥理學方法篩選出菝葜抗肝癌的主要活性成分β-谷甾醇、山柰酚和薯蕷皂苷元等與臨床研究報道[3-4]基本一致。臨床藥理研究發現,菝葜有抗炎鎮痛[5]、抗腫瘤[6]、抗氧化[7]、抑菌[8]、調節免疫體[9]、降血糖[10]等功能。有研究發現,菝葜可能增加PI3K/Akt依賴性eNOS磷酸化內皮細胞中NO的產生與降低VEGF和NOS水平有關,從而誘導血管舒張,抑制腫瘤血管的新生[11-12]。同時菝葜使腫瘤細胞停滯在G2/M期,誘導腫瘤細胞凋亡,可能與激活CASP3,抑制NF-κB和下調Bcl-2和AKT有關[13]。
MAPK14是MAPK家族中的一員,被稱為腫瘤抑制因子,與腫瘤和炎癥的發生密切相關[14]。熱休克蛋白90(HSP90)作為腫瘤蛋白起著調節蛋白質構象,穩定和降解的作用[15]。VEGF是刺激血管生成的主要因子,在多數腫瘤中表達上調。VEGF/VEGFR2通路可能與高表達HSP90AA1/HSPA8患者的HCC復發有關[16]。目前己發現的Caspase(CASP)的家族成員具有傳遞凋亡信號作用,在維持其致瘤性和轉移中起關鍵作用[17]。AKT是一種蘇氨酸蛋白激酶[18-19],其家族成員主要有3個,分別是AKT1、AKT2和AKT3這3個成員結構類似,激活PI3K/Akt信號通路能夠促進肝癌細胞的增殖、遷移和侵襲。
薯蕷皂苷元(diosgenin,DG)除有抗腫瘤外,還具有保肝、抗病毒、抗氧化、抗炎及降血脂等藥理活性[20-22]。王華等[23]發現DG能夠顯著影響丙氨酸、天冬氨酸和谷氨酸代謝,從細胞代謝組學方面驗證了DG抗腫瘤的作用。DG可能通過抑制對乙酰氨基酚誘導的CYP2E1的活化,上調Bcl-2和Bid的蛋白表達,下調Bax和p53的蛋白表達,減輕對乙酰氨基酚導致的肝毒性[24]。通過抑制STAT3蛋白,進而抑制VEGF表達,抑制血管新生[25]。β-谷甾醇(Beta-Sitosterol,BS)通過細胞周期停滯和凋亡誘導作用在肝癌、肺癌、胃癌、乳腺癌中具有抗腫瘤活性,具有抗癌特性的無毒類化合物[26-27]。研究發現山柰酚下調ERK磷酸化以及NFκB和cMyc表達,上調p21表達,抑制VEGF的分泌,證明其具有抑制血管新生的作用[28]。KF能促進的含氧自由基進而激活磷酸化p53和磷酸化ATM,刺激死亡受體4和死亡受體5,誘導腫瘤細胞凋亡[29]。Yang等[30]研究發現KF抑制MEK/ERK和STAT3信號轉導途徑,以及激活線粒體凋亡通路,促進腫瘤細胞死亡。張帆等[31]發現KF通過激活凋亡經典通路中的NLRP3和CASP1,從而促進NLRP3炎性小體的組裝來誘導HepG2細胞凋亡。KF可能通過下調Bcl-2,并上調Bax、CASP3和CASP9,促進PARP的裂解,下調磷酸化的AKT、TIMP2和MMP2,抑制胃癌(astric cancer,GC)細胞和膽管癌(cholangiocarcinoma,CCA)細胞的增殖[32-33]。這與臨床研究發現的通過MAPK、PI3K/AKT、CASP、JAK-STAT等信號通路,抑制肝癌細胞增殖和凋亡,以及通過PI3K/AKT通路促進肝癌細胞自噬基本一致[34-35]。
綜上所述,本研究中所預測的菝葜主要活性成分及抗肝癌靶點與臨床結果基本一致。隨著網絡藥理學與分子生物學等發展,中藥抗肝癌機制研究已深入分子基因層面。目前臨床關于菝葜中有效活性成分及作用機制的研究與本研究所預測結果基本一致。本研究初步分析了菝葜抗肝癌的活性成分及相關的信號通路和生物過程,為菝葜抗肝癌的藥理活性、靶點研究及作用機制提供了一定的理論支持,為以后藥理實驗的研究提供了方向。肝癌的發生與發展涉及多個基因和多個通絡,然而肝癌細胞信號通路復雜,一些菝葜活性成分及其作用機制尚未進行深入研究,因此可以在本研究的基礎上進一步研究菝葜抗肝癌的分子作用機制。

