急性髓系白血病患者血清sPD-L1、OPN水平與療效及VEGF的關系研究*
馮硯平
廣東省中山市人民醫院檢驗醫學中心,廣東中山 528400
急性髓系白血病(AML)由造血干細胞惡性增殖、異常分化導致,臨床表現常有貧血、出血、感染,發病率和病死率均較高,且病情發展快[1]。因此,尋求能夠評估AML患者療效的指標,對于降低病死率具有重要價值。可溶性程序性死亡因子配體-1(sPD-L1)會和程序性死亡因子(PD)結合,使腫瘤細胞逃避免疫殺傷,導致惡性腫瘤的發生以及發展,其水平的變化能夠反映細胞凋亡能力[2]。血管內皮生長因子(VEGF)作為血管再生的關鍵因子,在實體瘤的發生、發展以及轉移中起到重要作用。研究表明,VEGF在血液惡性腫瘤的有絲分裂中起到促進作用[3]。骨橋蛋白(OPN)是促血管新生因子,可促進腫瘤血管新生[4]。但目前對于sPD-L1、 OPN與VEGF關系的報道較少,基于此,本文以AML患者為研究對象,分析血清sPD-L、OPN對AML患者療效的評估價值,以及sPD-L1、OPN表達與VEGF的關系,現報道如下。
1 資料與方法
1.1一般資料 選取2019年6月至2020年6月在本院診治的AML患者60例作為AML組,其中男38例,女22例;年齡28~69歲,平均(43.21±11.67)歲;按照FAB分型分為M1型、M2型、M3型、M4型、M5型各4例、15例、17例、14例、10例。納入標準:臨床確診為AML。排除標準:(1)肺、腎、肝等臟器發生器質性病變者;(2)精神系統、免疫系統疾病者;(3)其他類型白血病患者;(4)對本研究藥物過敏者;(5)妊娠期或者哺乳期的女性;(6)中途退出本研究者。選取同期健康志愿者60例作為對照組,其中男36例,女24例;年齡22~68歲,平均(42.92±12.61)歲。兩組的性別、年齡差異均無統計學意義(P>0.05),具有可比性。本研究經醫院醫學倫理委員會批準。所有研究對象簽署知情同意書。
1.2方法
1.2.1治療方法 AML組均采用誘導化療,除M3型外,其余的43例患者中7例采用MA方案,13例采用CAG方案,23例采用DA方案;M3型患者采用ATRA+砷劑方案。MA方案:阿糖胞苷靜脈滴注,每次120~150 mg/m2,每天1次,連續滴注3 d;米托蒽醌靜脈滴注,每次6~8 mg/m2,每天1次,連續滴注3 d。CAG方案:阿糖胞苷皮下注射,每次10 mg/m2,1天2次,連續注射14 d;阿克拉霉素靜脈滴注,每次10 mg,每天1次,連續滴注8 d;粒細胞集落刺激因子皮下注射,每次200 μg/m2,每天1次,當白細胞計數(WBC)>20×109/L則停用。DA方案:阿糖胞苷靜脈滴注,每次120~150 mg/m2,每天1次,連續滴注7 d;柔紅霉素靜脈滴注,每次35~45 mg/m2,每天1次,連續滴注3 d。ATRA+砷劑方案:10 mg/d的三氧化二砷與500 mL 5%的葡萄糖溶液靜脈滴注,每天1次,連續滴注14 d。
1.2.2觀察指標 (1)AML組于治療前后、對照組于體檢當天空腹抽取3 mL的外周肘靜脈血,采用轉速為1 000 r/min的低溫離心機進行15 min的離心處理,取上清液保存于-80 ℃待測。采用酶聯免疫吸附試驗(ELISA)檢測血清sPD-L1、OPN、VEGF水平,試劑盒購自北京健平九星生物醫藥科技有限公司。(2)療效評判標準:按照《血液病評估及療效標準》進行評估。經過治療,AML患者臨床癥狀已經消失,中性粒細胞≥1.5×109/L,血小板計數≥100×109/L,并且骨髓內原始粒細胞Ⅰ型和Ⅱ型占比≤5%,在白細胞分類里沒有檢測出白血病細胞,紅細胞以及巨核細胞恢復正常,則為完全緩解(CR);經過治療,骨髓內原始粒細胞Ⅰ型和Ⅱ型占比>5%且≤20%,或者臨床表現、血象中,有一個沒有完全緩解,則為部分緩解(PR);臨床表現、血象、骨髓象都沒有部分緩解,則為未緩解。

2 結 果
2.1血清sPD-L1、OPN、VEGF水平比較 AML組治療后血清sPD-L1、OPN、VEGF水平與治療前比較均降低(P<0.05),AML組治療前后血清sPD-L1、OPN、VEGF水平均高于對照組(P<0.05),見表1。AML組按照療效分為CR組18例、PR組27例和未緩解組15例,sPD-L1、OPN、VEGF水平比較均為CR組 表1 AML組、對照組血清sPD-L1、OPN、VEGF水平比較 表2 AML組不同療效患者血清sPD-L1、OPN、VEGF水平比較 2.2血清sPD-L1、OPN水平與VEGF的相關性 經Pearson相關分析,AML患者治療前后血清sPD-L1、OPN水平與VEGF均呈正相關(治療前:r=0.345、0.557,P<0.05;治療后:r=0.799、0.888,P<0.05),見圖1。 注:A、B為治療前,C、D為治療后。 AML是血液系統疾病,其發病可能和酗酒、吸煙、病毒感染、地域環境等有關,相對于其他類型的白血病,其危害程度更高,病情更為兇險,且進展更快。AML患者體內一些生物活性因子以及生物標志物會發生增殖異常,導致造血干細胞的凋亡受到阻礙,并且新血管的生成可為造血干細胞提供養分,有助于惡性造血干細胞的異常增殖,最終導致造血功能遭受破壞[5-6]。研究證實,AML造血干細胞的異常增殖和凋亡與許多生物細胞因子有關[7]。sPD-L1作為能夠反映細胞凋亡的細胞因子,在淋巴細胞、樹突狀細胞、腫瘤細胞中表達,和其受體PD-1結合后能夠傳出抑制信號,阻礙T細胞的活化,并對免疫系統功能產生抑制作用,從而使疾病發展[8]。OPN是可分泌的細胞因子,和細胞外基質形成有關,在腫瘤中異常高表達,并且會促進新血管生成[9]。VEGF作為評估新血管形成的標志物,通過作用于絡氨酸激酶受體,從而增加血管通透性,促進血管形成、血管內皮細胞的遷移和增殖、細胞外基質變性[10]。因此,本文檢測并分析AML患者的sPD-L1、OPN、VEGF水平,為AML的臨床治療提供輔助參考。 本研究中,AML組血清sPD-L1、OPN、VEGF水平在治療后均降低(P<0.05),AML組治療前后均明顯高于對照組(P<0.05);AML患者治療后血清sPD-L1、OPN、VEGF水平比較:CR組 經Pearson相關分析,治療前后血清sPD-L1、OPN水平與VEGF均呈正相關,提示在AML的發生和發展中血清sPD-L1、OPN、VEGF有相互促進以及協同作用。VEGF為AML的發生、發展提供合適的環境,促進分泌sPD-L1,血清sPD-L1幫助逃避抗腫瘤免疫,促進了疾病進展,因此sPD-L1與VEGF相互促進[14]。OPN可激活VEGF,且是正反饋的信號通路,可對VEGF抗體的負反饋信號起到拮抗作用。OPN能夠上調VEGF,二者協同刺激形成管腔以及促進內皮細胞的遷移,而VEGF可誘導OPN表達,二者協同促進新血管生成,并促進腫瘤的生長以及轉移[15]。 綜上所述,AML患者血清sPD-L1、OPN、VEGF水平均呈異常高表達,且療效越差其水平越高,故血清sPD-L1、OPN對療效具有一定的評估價值。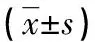
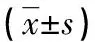

3 討 論

